液质联用技术在新药研发中的应用
2019-01-22许晓辉邱国玉景武堂马友振王小乔贾汝玲
许晓辉,邱国玉,景武堂,马友振,王小乔,贾汝玲,杜 清
(1兰州市食品药品检验所,甘肃 兰州730050;2甘肃省人民医院外科,甘肃 兰州 730000;3江苏万邦生化医药集团有限责任公司,江苏徐州,221004;4青海民族大学药学院,青海省青藏高原植物化学重点实验室,青海西宁810007)
0 引言
新药研发是寻找替代目前临床上使用有缺陷的药物或者寻找能够治疗特定疾病的高效低毒药物,它是从化合物库中,通过体内体外活性筛选出候选药物,再经过临床试验验证,才上市应用到患者身上。因此,新药研发是一项复杂、艰巨的工作,一个新药的问世周期是12~15年(图1)[1]。在新药研发中应用的分析技术有色谱、质谱、核磁共振,而对复杂组分定性定量应用比较广泛的是液质联用(liquid chromatography-mass spectrometry,LC-MS)。目前,液质联用技术已经成为新药研发的重要技术手段,它具有高灵敏度、高通量、快速等优点,被广泛的应用到新药结构发现,新药的吸收、分布、代谢、排泄检测,新药药理活性的研究等方面。本文从与药物相关化合物结构的鉴定、新药体外活性研究、新药体内药代动力学及与新药作用相关的药效标志物等方面探讨了液质联用技术在新药研究中的应用。

图1 基于化合物生物活性筛选的新药发现过程示意图
1 LC-MS概述
LC-MS系统元件包括进样器、HPLC系统(或UPLC系统)、电离源、质量分析器和检测器。理想情况下,这些元素都在一个计算机系统的控制之下。典型的反相高效液相色谱系统连接到MS将使用一些水或甲醇或乙腈的组合作为流动相。同时还要添加离子化试剂,典型的离子化试剂主要包括乙酸铵、甲酸铵、乙酸和甲酸等。超高效液相色谱质谱联用是目前使用比较广泛的仪器,其有多种电离源。最常见的两种源是电喷雾电离(electrospray ionization,ESI)和大气压化学电离(atmospheric pressure chemical ionization,APCI);这两种类型源现在都是用于LC-MS应用的质谱仪标准配置。在ESI系统中,高压场(3-5kv)向柱状喷射,导致带电荷的液滴聚焦于质量分析裂解器,这些液滴在接近质谱仪入口时变得越来越小,当液滴变得越来越小时,单个离子就会在一个被称为“离子-蒸发”的过程中出现,这些离子就会被MS系统分离出来。在APCI中,加热蒸发柱洗脱液,然后电晕放电电离溶剂分子,然后通过化学电离机制产生分析物离子。图2列示了目前比较常见的几种液质联用仪,主要有单四极质谱仪、飞行时间质谱仪、三重四级杆质谱仪和离子阱质谱仪。其中,飞行时间(TOF)质谱计,它具有额外的能力提供更高质量分辨率光谱;三重四极质谱仪,它最常用于生物分析,但也可用于代谢物鉴定;离子阱质谱仪,其具有独特的产生MSn数据的能力,这些数据可以进行化合物结构解析。除了这四种类型的质谱计之外,还有一种混合质谱仪,它将两种基本的质谱仪结合在一起,构成了一个混合系统,该混合系统囊括了“Q-TOF”MS-MS系统[2]。总的来说,四级杆液质联用的强项在定量,飞行时间或离子阱液质联用的强项在定性。液质联用强大的分析能力,分析级别能够达到ng级别水平,能够提供相对分子量和丰富的结构信息,与谱库检索联合应用,能够快速对化合物进行拟合匹配,定性化合物,尤其适合微量复杂组分体系的分析、不易分离或缺乏特征紫外吸收的化合物,对已知、未知物的定性定量、在以药物生物活性为指导的目标化合物筛选,靶标分析,药物及其代谢物血浆、胆汁、尿液中的检测等。新药研发经历不同阶段,从化学设计合成目标化合物到候选药物的药理筛选,LC-MS已被用于所有这些阶段,并在许多情况下成为首选的分析工具。
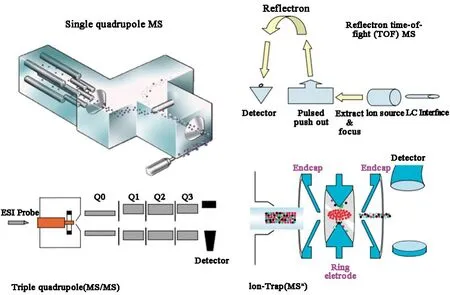
图2 不同类型的质谱仪
2 液质联用技术在新药研发中的应用
在新药研发过程中,对潜在的新药先导化合物进行鉴定是新药高通量筛选的关键。而液质联用的高分离能力和高灵敏度选择性于一体,能够同时分析多个化合物,可对生物基质内的微量药物进行可靠的定性验证与定量检测。目前液质联用技术在新药研发中的应用主要集中在与药物相关化合物结构的确证、药物体外生物活性筛选、体内药物代谢和药代动力学等方面。
2.1 与药物相关化合物结构的确证在新药研发的初级阶段,目标化合物设计合成后,得到一系列潜在的可能成为候选药物的目标化合物,应用LC-MS对这些潜在的可能成为候选药物的化合物进行结构确证和纯度分析,这是作为构建化合物库的第一步。一个通用的系统是运用紫外检测器对所得化合物进行纯度评估,用液质联用仪的MS系统对化合物结构进行确证,MS系统是单四级杆或飞行时间质谱或离子阱,这些系统通常高度自动化。目前,LC-MS工作中都具备高度的自动化和便捷化,能够同时分析化合物的纯度和给出化合物结构方面的质谱信息。这个过程是基于LC-MS硬件系统和软件系统相组合的信号同时检测,这些信号是根据所观察到或预期的化合物的m/z响应触发的。在新药未知物结构鉴定方面,应用多的是飞行时间质谱或离子阱质谱,具体操作应该是:首先用Q-TOF获得高分辨数据,得到分子构成,其次分析每一个碎片,得出结构,最后用标准品在相同的条件下做Q-TOF,如果得到的结果与分析出的结果是完全一致,则该未知物就被鉴定出来,如果需要进一步鉴定该未知物,则需要分离出该未知物,与1H-NMR、13C-NMR、IR相配合,确证结构。在已知药物结构鉴定方面,用LC-MS/MS同时分析已知物与已知物的标准品,两者结果相比较,如果完全一样,一般情况就可确定已知物结构。与新药作用相关的药效标志物寻找是新药体内体外筛选的主要依据,药物活性标记物的识别与检测对于研究药物活性与作用机理非常重要,可以准确的预测药物药理活性,同时也可减少药物研发和临床试验的时间和成本。目前,大多数药物的研发模式都是基于活性标记物的药理活性研究为目标,以药物对该相关疾病模型的标志物的影响作用与大小为依据,通过检测药物作用于模型后,活性标志物上调或者下降用来预测被研究药物药理作用,同时,药物活性标记物的变化可以预测或发现与候选药物相关的安全问题,揭示药理活性或表明临床疗效,在新药研发方面,使用液质联用去发现或鉴定药物药理活性标志物,药理活性标记物的发现与确证将加速将加速药物的研发速度[3-7]。吴光昊[8]基于液质联用技术开展了抗体偶联药物(ADC)结构研究及鉴定,借助质谱技术,以ADC药物的载药分布与偶联位点的质量特性为切入点对抗体偶联药物结构进行表征分析,为ADC药物质量异质性研究打下扎实基础。
2.2 药物体外生物活性筛选药物体外活性筛选主要包括以下几个层次的筛选:计算机模拟药物筛选、分子水平的药物筛选模型、细胞水平的药物筛选模型。候选药物的体外活性筛选要经过一系列生物活性实验来确证,主要有药物作用于培养的人体细胞后细胞组织形态、DNA、RNA、酶、细胞周期等发生的变化,药物与能够体现药物活性的药物标志物的作用效果,比如药物与拓扑异构酶的作用,药物与细胞周期调控因子p53的作用,评估候选药物抑制一种或多种人细胞调控因子的潜力,而LC-MS/MS被用于这个步骤主要是去研究药物与靶点结合的识别或者通过高通量筛选去识别活性化合物。目前,已有大量应用液质联用去筛选药物体外生物的研究成果被报道。例如,活性乙酰水解酶(PAF-AH)是一种血小板活化因子,是血管系统及炎症系统中的细胞间调节分子,刘维等[9]建立一种简单、快速、特异、稳定地LC-MS/MS法检测新型药物过敏反应介质血小板活化因子C-18(PAF C-18)及其乙酰水解酶(PAF-AH)活性的方法,该方法可以通过外源性添加PAF C-18在一定时间内的下降程度,间接反映PAF-AH活性,为开展相关药物过敏的临床药效学研究提供了指导。也有液质联用与其他生物活性筛选方法相结合来筛选药物药理活性,如朴香兰等[10]应用酪氨酸酶抑制实验-液质联用方法快速寻找到苦参中具有较强酪氨酸酶抑制成分槐属二氢黄酮G和苦参酮,这两个化合物的酪氨酸酶抑制活性强于已知的酪氨酸酶曲酸的活性。刘侗等[11]以体外培养的人脐静脉内皮细胞(ECV-304)为研究材料,建立以H2O2诱导内皮细胞的氧化损伤模型,以内皮细胞的存活率为指标,研究通顶散各萃取部位对ECV-304的保护作用,结果表明藜芦生物碱、人参皂苷和甘草皂苷是通顶散抗过氧化氢损伤活性物质。近年来,蛋白质组学和代谢组学研究是新药开发的一种重要高通量筛选技术,新药靶标的发现鉴定、药物的作用模式、药物与蛋白质作用机理是药物筛选蛋白质组学研究的主要内容[12],而液质联用是蛋白质组学和代谢组学研究分析的主要工具,基于液质联用分析技术的高通量蛋白质组学药物活性筛选有利于加速新药研发的速度。ZHU等[13]基于代谢组学,开发了一种快速、灵敏、高通量的肿瘤细胞中20种内源性核苷和核苷酸的液质联用分析方法,而内源性核苷和核苷酸是代谢组学研究中最具差异性的代谢物,这20种内源性核苷酸和核苷酸的定量分析方法符合具体扩增代谢组学研究的定量要求,具有较好的选择性,当应用肿瘤细胞筛选抗肿瘤药物,可以通过检测施加药物后的肿瘤细胞中内源性核苷和核苷酸而判断药物药效。
2.3 体内药物代谢和药代动力学药物体内活性筛选主要有以下两个层次:动物个体水平的药物筛选模型和人体临床筛选模型。LC-MS在新药发现中最常见的应用是药物的吸收、分布、代谢、排泄(ADME)研究,它们占药物代谢和药代动力学(DMPK)研究的大部分工作。药代学研究首先是体内ADME筛查、其次是各种体内临床前ADME-PK筛查、代谢产物的鉴定、体内筛选还有一个重要指标是代谢稳定性试验。图3是动物体内药代动力学筛选样品制备策略图,它使用96孔板进行样品制备,蛋白质沉淀常常是样品制备的首要步骤,这种制备方式有一定的便利性和高效性,而对于一些特殊的化合物,常常液-液萃取或者固相萃取方法进行前处理,药代动力学研究应用比较多的是三重四级杆液质联用[2]。早期药代动力学评价是药物发现过程的重要组成部分,能够区分化合物的体内药动学特性,从而使研究具有有针对性,加快研发进程。基于可供筛选的化合物数量、新靶点筛选技术,药代动力学筛选速度成为新药研发进展的关键。目前采用基于液相色谱质谱联用技术筛选药代动力学,有单一给药,也有盒式给药方法,所谓盒式给药即几种候选化合物混合后同时给单一动物进行快速样品分析,在体内研究多选择盒式给药,这样可提高化合物在体内的药代动力学筛选通量,节省实验资源和成本,缺点是可能会出现化合物相互作用,因此对所采用的分析方法进行评价和验证是必要的[14]。 王蕊等[15]应用 HPLC-MS/MS 分析恒河猴全血中调血脂化合物IMM-H007(见图3)的药代动力学,结果表明,IMM-007在体内血药浓度较低,主要以活性代谢产物M1和MP形式存在,MP的体内暴露量明显高于M1,该研究为进一步为探明新型调血脂药IMM-007后续药理毒理研究提供参考数据。杨兵等[16]基于高效液相-电喷雾-四级杆-线性离子阱串联质谱技术建立了一种高通量靶标磷脂组学分析方法,研究尿液中的磷脂轮廓并筛选出尿液样本中潜在的磷脂标志物,该检测分析方法在磷脂组学研究中具有简单、稳定和敏感的特点,可应用于后续大样本量的磷脂组学研究及潜在尿磷脂标志物的定量研究,为研究具有磷脂标记物的药物的体内代谢、药物动力学提供了指导。Hallur等[17]以 LC-ESI-MS/MS方法分析了FAK抑制剂Defactinib在小鼠体内的药代动力学,该方法简单、灵敏,具有良好的准确性和精密度,完全符合美国FDA的指导方针。恩曲替尼是一种有效的口腔间变性淋巴瘤激酶(ALK)抑制剂,Attwa等[18]建立了一种有效的LC-MS/MS方法,用于定量人血浆基质中的恩曲替尼,该方法具有快速、特异、灵敏等特点,被认为是人类血浆中恩曲替尼定量及其代谢降解评估的第一种方法。总之,应用液质联用去分析药物体内代谢物及药物药代动力学方面越来越受到研究者的关注[19-21],尤其在药物早期发现中,代谢物研究能够在实验动物模型描绘出完整的代谢轮廓图,发现不稳定的代谢途径以及评估代谢物的安全性,反过来通过化学途径修饰母体药物以改善药物的稳定性,寻找到代谢有利于药物发挥最大药效的结构[22]。然而,尽管LC-MS/MS作为药物和代谢物定量主要分析技术,但是一些非常基本的问题还没有得到充分的解决,如串联质谱法对被分析物的选择性,基质效应(离子抑制或增强)的潜在影响等[23]。
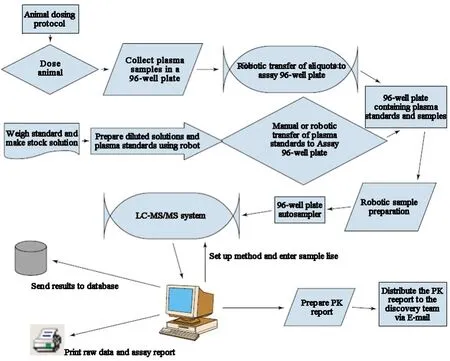
图3动物体内药代动力学样品制备分析策略图
3 总结
目前,液质联用技术已经变成新药研发中的重要分析技术之一,在新合成目标化合物或新发现能够潜在成为候选药物的化合物结构鉴定、高通量筛选,随着新型质谱技术及离子化技术的不断改进和发展,样品前处理技术的不断革新,鉴于现有仪器的潜力和可预见性,从分析能力和数据采集到化学计量学以及分析方法验证的瓶颈正在被取代,从自动化分析过程到快速、高通量的分析结果,液质联用将成为新药发现过程不可或缺的分析技术,将越来越多的被应用到新药研发中。
