燕麦麸皮中燕麦胶的提取纯化工艺优化及纯度测定
2019-01-21王振强贾俊伟王浩
王振强,贾俊伟,王浩
(1.黄河水利职业技术学院,河南开封475003;2.天津科技大学食品工程与生物技术学院,天津 300457)
燕麦属禾本科植物,是世界上主要农作物之一, 国际上主要产于俄罗斯、加拿大、美国及欧洲;我国则以裸燕麦为主,主要产于内蒙、山西、甘肃、青海等地[1-2]。燕麦是一种可溶性纤维,具有较高的营养价值,含有一系列葡萄糖分子聚合而成的β-葡聚糖,拥有多种保健功能[3]。燕麦胶是燕麦中β-葡聚糖提取后的存在形式,β-葡聚糖可以增强免疫力,吞噬细胞活力,快速杀灭病菌、真菌和病原微生物,帮助远离感染性疾病[4]。可以消除体内恶性细胞,对肝癌、乳腺癌抑制率很高,没有任何副作用,有一定的防癌抗癌功效[5]。专家研究显示,患有高血压的患者每天吃3 g~4 g β-葡聚糖,能有效的降低胆固醇发病机率[6]。国际上对燕麦的营养、保健作用研究认识比较早,在食品、化妆品、药品生产上广泛的应用。我国生产的燕麦产品成本低,品质好,在国际市场上有很强的竞争力[7]。随着人们对燕麦食品营养保健作用的不断认识,燕麦食品也越来越受到世界人民的青睐,燕麦食品开发有着广阔的前景[8]。因此,从燕麦麸皮中提取纯化燕麦胶,并进行纯度测定具有重要的研究价值。
1 材料与方法
1.1 材料与试剂
裸燕麦:市售;耐热 α-淀粉酶(1 800 U/mL)、瓜儿胶:北京奥博星生物技术责任有限公司;乙醇:天津市文达稀贵试剂化工厂;苯酚:天津市北方医化制剂厂;牛血清蛋白、考马斯亮蓝G-250:联星生物制剂厂。
1.2 仪器与设备
80-2B型低速离心机:上海安亭科学仪器厂;FA1604S电子天平:上海天平仪器厂;TDA8002电子恒温水浴锅:天津市中环实验电炉有限公司;DG404真空电热干燥箱:天津市天宇实验仪器有限公司;CHNO6O型pH计:美国奥立龙公司;722E分光光度计、RE-2000旋转蒸发仪:上海亚荣生化仪器厂;SHB-Ⅲ循环水真空泵:郑州长城科工贸有限公司;SHZ-88型台式水浴恒温振荡器:江苏太仓市实验设备厂。
1.3 方法
1.3.1 燕麦预处理
取一定量的燕麦麸与75%乙醇溶液混溶,80℃下回流搅拌4 h,冷却到30℃,除去上清液,再与纯乙醇混溶搅拌15 min,过滤除去乙醇,35℃脱溶30 h,得到燕麦麸处理物,备用[9]。
1.3.2 提取得率测定
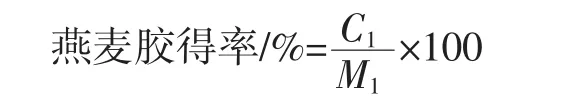
式中:C1为提取得到的β-葡聚糖质量,g;M1为燕麦原料总质量,g。
1.3.3 单因素试验
1.3.3.1 提取温度对提取效果的影响
将处理好的燕麦麸皮料液比为1∶10(质量比),分别于 30、40、50、60、70、80 ℃下提取试验,提取 3 次,时间120 min,以燕麦胶提取得率为标准,确定提取温度对提取效果的影响。
1.3.3.2 提取时间对提取效果的影响
将处理好的燕麦麸皮料液比为1∶10(质量比),温度 70 ℃,分别提取 30、60、90、120、150、180 min,提取3次,以燕麦胶提取得率为标准,确定提取时间对提取效果的影响。
1.3.3.3 料液比对提取效果的影响
将处理好的燕麦麸皮料液比分别为1∶5、1∶10、1 ∶15、1∶20、1 ∶25(质量比),温度 70 ℃,时间 120 min进行提取,提取3次,以燕麦胶提取得率为标准,确定料液比对提取效果的影响。
1.3.3.4 提取次数对提取效果的影响
将处理好的燕麦麸皮料液比为1∶10(质量比),温度 70 ℃,时间 120 min,分别提取 1、2、3、4、5 次,以燕麦胶提取得率为标准,确定提取次数对提取效果的影响。
1.3.4 正交试验设计
根据单因素试验结果,选取提取温度、料液比、提取次数为正交试验因素水平,做L9(34)正交试验,正交试验条件因素水平如表1。

表1 正交试验因素水平表Table 1 Orthogonal experiment factor level table
1.3.5 燕麦胶纯化工艺
1.3.5.1 淀粉脱除方法
用耐热α-淀粉酶去除燕麦胶中的淀粉。α-淀粉酶是耐高温酶,反应温度90℃。酶活力是1 800 U/mL,稀释100倍后是17.70 U/mL。将提取好的燕麦胶分为8份,每份 25mL。用量分别为 3、6、12、15、18、21、24U,作用时间分别为 10、20、30、40、50、60、70、80 min,以碘液与反应液作用其产生的颜色为判断标准,确定淀粉去除情况[10-11]。
1.3.5.2 蛋白质脱除方法
采用等电点法去除燕麦胶中的蛋白质。用盐酸将燕麦胶的 pH 值分别调至 3.5、4.0、4.5、5.0、5.5、6.0,4 ℃低温静置过夜,离心,沉淀为蛋白质。上清液用乙醇沉淀,加入乙醇时要少量缓慢的加入并不断搅拌,过滤离心,沉淀物干燥,计算得率(由于量较少在干燥时与滤纸一起干燥,用干燥后的总重量减去滤纸重量得到燕麦胶重量)[12]。蒸馏水溶解、定容,测定纯度,确定最佳pH值。
1.3.6 燕麦胶纯度测定
1.3.6.1 糖含量测定标准曲线
取105℃干燥恒重的葡萄糖20 mg,精密称重,溶解,定溶至 500 mL。分别取溶液 0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL 加水定容至 2 mL,加 1 mL 苯酚,摇匀后迅速加浓硫酸5 mL,放置10 min,摇匀后再放置20 min。以蒸馏水为空白样,在490 nm处测定其吸光度,分别以溶液浓度为横坐标,以吸光度为纵坐标作图得到硫酸-苯酚法标准曲线[13]。得到标准曲线的回归方程为 y=0.016x-0.025 2,R2=0.999 3。
1.3.6.2 蛋白质标准液配制
配制考马斯亮蓝G-250蛋白试剂:取100 mg考马斯亮蓝G-250,溶于50 mL乙醇(90%)中,再加入85%的磷酸100 mL,加水定容至1 000 mL。
配制蛋白质标准液:称取100 mg牛血清蛋白,溶于100 mL蒸馏水中,制成1 000 μg/mL的储备液。再按表2和表3比例配制成2套不同浓度的溶液,以备制作标准曲线[14]。

表2 蛋白质浓度为100 μg/mL~1 000 μg/mL数据表Table 2 The data sheet of protein concentration on 100 μg/mL-1 000 μg/mL

表3 蛋白质浓度为0~100 μg/mL数据表Table 3 The data sheet of protein concentration on 0-100 μg/mL
1.3.6.3 蛋白质含量的测定标准曲线
表2的数据适用于蛋白质含量为100 μg/mL~1 000 μg/mL的标准曲线。各取溶液0.1 mL加5 mL考马斯亮蓝G-250蛋白试剂,混匀,2 min后以蒸馏水为空白样,在595 nm处测其吸光度。分别以溶液浓度为横坐标,以吸光度为纵坐标作图得到考马斯亮蓝法测蛋白质含量标准曲线。得到曲线公式和R2值,要求R2值在0.990以上。
表3的数据适用于蛋白质含量为0~100 μg/mL的标准曲线。各取溶液0.5 mL加5 mL考马斯亮蓝G-250蛋白试剂,混匀,2 min后以蒸馏水为空白样,在595 nm处测其吸光度,分别以溶液浓度为横坐标,以吸光度为纵坐标作图得到考马斯亮蓝法测蛋白质含量标准曲线[13]。得到曲线公式和R2值,要求R2值在0.990以上。
1.3.6.4 糖含量计算
用硫酸-苯酚法测定糖含量。分别取不同pH值的燕麦胶2 mL加1 mL苯酚,摇匀后迅速加浓硫酸5 mL,放置10 min,摇匀后再放置20 min。以蒸馏水为空白样,在490 nm处测定其吸光度。用标准曲线得到的公式可根据吸光度算出对应溶液的浓度,即得到糖含量[14-15]。
1.3.6.5 蛋白质含量计算
用考马斯亮蓝法测定蛋白质含量。试验测定燕麦胶样品中的蛋白质含量很少,浓度范围适用于用表2数据的标准曲线。分别取不同pH值的燕麦胶0.5 mL加5 mL考马斯亮蓝G-250蛋白试剂,混匀,2 min后以蒸馏水为空白样,在595 nm处测吸光度,用标准曲线得到的公式可根据吸光度算出对应溶液的蛋白浓度,即得到蛋白质含量[14-15]。
2 结果与分析
2.1 提取温度的确定
将处理好的燕麦麸皮料液比为1∶10(质量比),分别于 30、40、50、60、70、80 ℃下提取,提取 3 次,时间120 min,燕麦胶提取得率如图1。

图1 提取温度对燕麦胶提取效果的影响Fig.1 Effect of extracting temperature on extraction of oat gum
由图1可知,随着提取温度的增加,燕麦胶提取得率逐渐增大,当达到70℃时,提取得率达到最大,再提高提取温度,提取得率逐渐减小,因此提取温度为70℃比较合适。
2.2 提取时间的确定
将处理好的燕麦麸皮料液比为1∶10(质量比),温度 70 ℃,分别提取 30、60、90、120、150、180 min,提取3次,燕麦胶提取得率如图2。
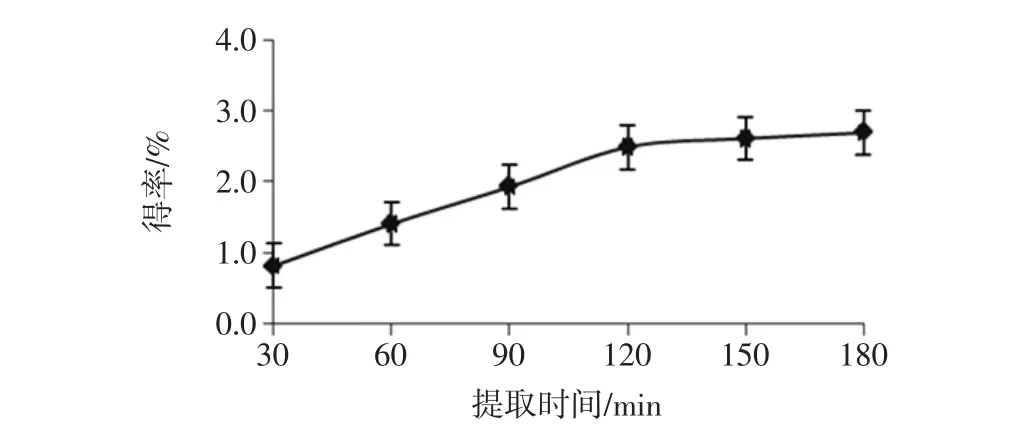
图2 提取时间对燕麦胶提取效果的影响Fig.2 Effect of extracting time on extraction of oat gum
由图2可知,随着提取时间的延长,燕麦胶提取得率逐渐提高,当提取时间达到120 min时,提取得率增加速度缓慢。提取时间越长,试验耗能越大,提取时间120 min比较合适。
2.3 料液比的确定
将处理好的燕麦麸皮料液比分别为1∶5、1∶10、1 ∶15、1∶20、1∶25(质量比),温度 70℃,时间 120 min进行提取,提取3次,燕麦胶提取得率如图3。

图3 料液比对燕麦胶提取效果的影响Fig.3 Effect of material-liquid ratio on extraction of oat gum
由图3可知,随着料液比的提高,燕麦胶提取得率也相应提高,当料液比为1∶10(质量比)时,在增加料液比,提取得率增加的缓慢,考虑到提取液浓度越小,越不利于燕麦胶的提取效果,料液比选用1∶10(质量比)比较合适。
2.4 提取次数的确定
将处理好的燕麦麸皮料液比为1∶10(质量比),温度 70 ℃,时间 120 min,分别提取 1、2、3、4、5 次,燕麦胶提取得率如图4。
由图4可知,随着提取次数的增加,燕麦胶提取得率逐渐增加,当提取次数达到3次时,再增加提取次数,提取得率增加的比较缓慢。提取次数越多,试验耗能越大,提取次数3次比较合适。

图4 提取次数对燕麦胶提取效果的影响Fig.4 Effect of extracting times on extraction of oat gum
2.5 正交试验结果
根据单因素试验结果,选取提取温度、料液比、提取次数为正交试验因素水平,做L9(34)正交试验,结果如表4,方差分析结果如表5。

表4 正交试验结果Table 4 The results of orthogonal experiments
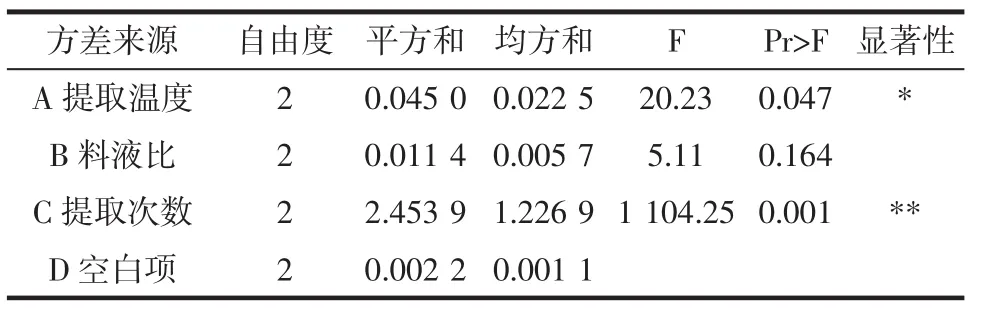
表5 方差分析结果Table 5 The results of variance analysis
由表4、表5可知,提取燕麦胶的影响因素的重要性为C>A>B,即提取次数>提取温度>料液比;C即提取次数极显著的(P<0.01)影响得率,A即提取温度显著的(P<0.05)影响得率,B即料液比影响不显著;最佳提取条件是A3B1C3,即提取温度70℃,料液比1∶10(质量比),提取次数3次。在最佳提取条件下进行验证试验,燕麦胶提取得率为4.57%。
2.6 纯化效果
2.6.1 淀粉脱除效果
用耐热α-淀粉酶去除燕麦胶中的淀粉,脱除效果试验结果如表6。

表6 淀粉脱除效果结果Table 6 The results of starch removal effect
由表6可以看出,从用量和脱除淀粉效果方面考虑,耐热α-淀粉酶的最佳用量6 U,水解反应40 min能完全脱除燕麦胶提取液中淀粉。
2.6.2 蛋白质脱除效果
将调至不同pH值的燕麦胶溶液4℃低温过夜,过滤离心,干燥后溶解,定溶到100 mL,确定最佳pH值,见表7。

表7 燕麦胶重量结果Table 7 The results of weight on oat gum
由表7可以看出,等电点沉淀法能有效脱除燕麦胶溶液中的蛋白质,溶液pH值为4.5时,得到燕麦胶质量最大,脱除蛋白质效果最佳。
2.7 纯度测定
2.7.1 糖含量测定标准曲线
硫酸-苯酚法测定燕麦胶样品中糖含量标准曲线如图5。
由图5可知,标准曲线的回归方程为y=0.016x-0.025 2,R2=0.999 3。
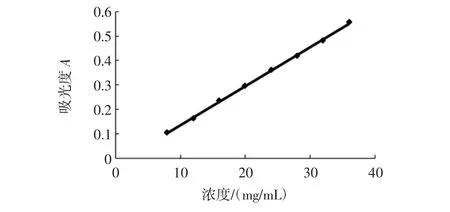
图5 测定糖含量标准曲线Fig.5 The standard curve line of determining sugar content
2.7.2 蛋白质含量测定标准曲线
考马斯亮蓝法测燕麦胶样品中蛋白质含量在100 μg/mL~1 000 μg/mL 范围的标准曲线如图 6。

图6 测定蛋白质含量标准曲线(100 μg/mL~1 000 μg/mL)Fig.6 The standard curve line of determining protein content(100 μg/mL-1 000 μg/mL)
由图6可知,标准曲线的回归方程为y=0.000 5x+0.049 2,R2=0.998 3。考马斯亮蓝法测定蛋白质含量在0~100 μg/mL范围的标准曲线如图7。
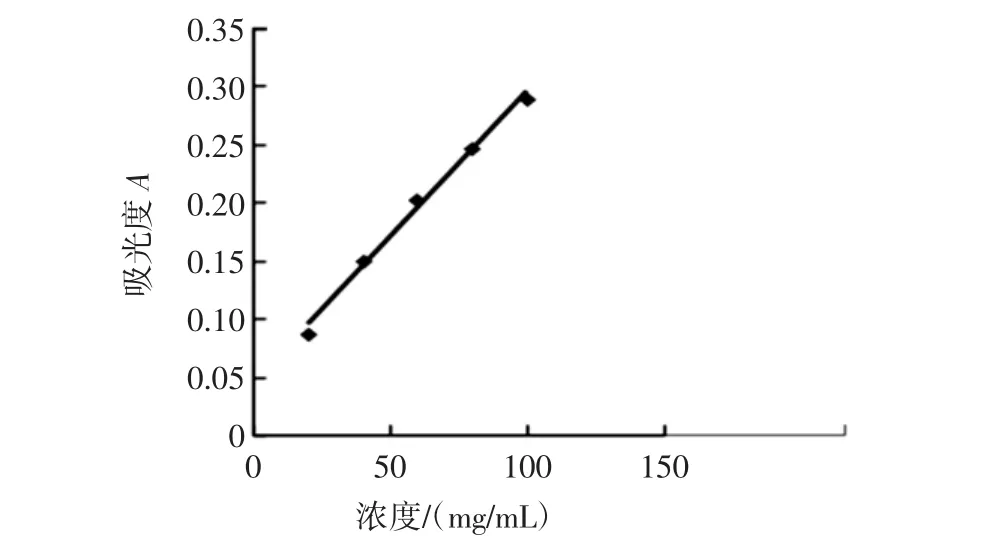
图7 测定蛋白质含量标准曲线(0~100 μg/mL)Fig.7 The standard curve line of determining protein content(0-100 μg/mL)
由图7可知,标准曲线的回归方程为y=0.002 5x+0.044 3,R2=0.993 5。
2.7.3 纯度测定结果
硫酸-苯酚法测定燕麦胶样品中糖含量结果及其吸光度数据如表8,考马斯亮蓝法测定燕麦胶样品中蛋白质含量结果及其吸光度数据如表9。

表8 硫酸-苯酚法测定糖含量结果及其吸光度数据Table 8 The result of sulphuric acid-phenol method and it’s absorbance data for determining sugar content

表9 考马斯亮蓝法测定蛋白质含量结果及其吸光度数据Table 9 The result of of coomassie brilliant blue method and it’s absorbance data for determining protein content
由表8、表9可看出测定燕麦胶样品中糖含量和残留蛋白质含量的最佳pH值是4.5;燕麦胶样品中糖含量为60.518%,残留的蛋白质含量为3.584%。
3 结论
1)由单因素试验和正交试验结果可知,燕麦胶提取的影响因素的重要性为C>A>B,即提取次数>提取温度>料液比;由方差分析结果可知,提取次数极显著的(P<0.01)影响得率,A 即提取温度显著的(P<0.05)影响得率,B即料液比影响不显著;优化提取最佳工艺条件是A3B1C3,即为提取温度70℃,料液比1∶10(质量比),提取次数3次,提取时间120 min,最优提取条件下进行验证试验,燕麦胶提取得率为4.57%。
2)耐热α-淀粉酶能有效的水解脱除提取液中的淀粉,脱除淀粉效果的最佳条件:耐热α-淀粉酶的最佳用量为6 U,水解反应40 min能完全脱除燕麦胶提取液中淀粉;等电点沉淀法能有效脱除燕麦胶溶液中的蛋白质,最佳脱除溶液pH值为4.5。
3)硫酸-苯酚法能够准确测定燕麦胶样品中糖含量,考马斯亮蓝法能准确测定麦胶样品中残留蛋白质含量,测定样品液的最佳pH值是4.5;燕麦胶样品中糖含量为60.518%,残留的蛋白质含量为3.584%。
