干扰BAG-1表达对黑素瘤B16F10细胞放射敏感性的影响
2018-12-17金德蕙王占想宋亚丽
金德蕙 王占想 宋亚丽
恶性黑素瘤(malignant melanoma)是一种高度恶性的黑素细胞肿瘤,早期手术彻底切除后预后尚可,一旦发生转移,对放疗、化疗均不敏感,5年生存率不超过14%。因此探讨如何提高黑素瘤对放疗、化疗的敏感性,成为黑素瘤研究的热点之一。
Bcl-2-associated athanogene 1(BAG-1)基因位于染色体9p12,其编码蛋白BAG-1蛋白通过与多种靶分子结合,参与调节细胞生物学的多个环节。BAG-1蛋白主要通过其C末端与热休克蛋白(HSP)70的肽结合区结合,促进细胞增殖;还可通过激活Raf-1信号通路调节细胞增殖;在细胞表面,BAG-1与酪氨酸激酶受体如干细胞生长因子HGF/血小板衍生生长因子PDGF受体结合能增强细胞对生长因子诱导的凋亡;在细胞浆内,可与Bcl-2结合以调节细胞凋亡;在细胞核内,可与多个核激素受体如维生素D3受体、维A酸受体结合而调节相应核激素的表达与活性[1-3]。
临床研究发现BAG-1蛋白在正常组织几乎不表达或低水平表达,而在乳腺癌、肺癌、前列腺癌等多种恶性肿瘤中高度表达。肿瘤细胞BAG-1基因表达上调可增强肿瘤细胞的抵抗转移能力,增加对凋亡刺激及化疗的耐药性;而下调其表达则增加肿瘤细胞对凋亡刺激、化疗的敏感性[1,2]。
一般认为黑素瘤对放疗不敏感,但在某些特殊情况下放疗仍是一项重要的治疗手段。目前尚未见有关BAG-1对黑素瘤放射治疗反应影响的相关文献报道。本研究通过体外实验探讨RNA干扰黑素瘤B16F10细胞BAG-1基因表达对放射线X线的敏感性的影响,并进行细胞凋亡率检测及相关机制探讨。
1 材料和方法
1.1 细胞培养及试剂 黑素瘤B16F10、M14细胞株购自南京凯基公司, RMPI 1640培养基为Gibco公司产品,胎牛血清为杭州四季青公司产品,LipofectamineTM2000购自Invitrogen公司; 兔抗鼠BAG-1多克隆抗体 为Santa Cruz公司产品,兔抗鼠Caspase3、8、9、PARP一抗及聚合HRP标记羊抗兔IgG二抗(货号BA1056)购自武汉博士德公司。
1.2 构建干扰质粒pGCsi-BAG-1并稳定转染黑色素瘤细胞,检测转染效率 构建干扰质粒pGCsi-BAG-1[4]。脂质体Lipo2000转染人黑素瘤细胞M14及鼠黑素瘤细胞B16F10,阴性对照组(NC-shRNA)黑素瘤细胞转染插入无关序列的干扰载体。具体操作如下:转染前一天,将人黑素瘤细胞M14及鼠黑素瘤细胞B16F10接种到6孔培养板上,接种密度(3~4)×105/mL。转染时,细胞要达到90%~95%的融合。溶液1:按照无血清RMPI 1640培养基与lipofectamine 2000按照每孔240 μL∶10 μL比例混合,温育5 min。溶液2:无血清RMPI 1640培养基与质粒按照每孔240 μL∶4 μg比例混合。将溶液1与溶液2混合,室温下置20 min。6孔培养板中的细胞用无血清RMPI 1640培养基冲洗两遍,加入2 mL无血清培养基。将溶液1与溶液2的混合液逐滴加入孔中,摇动培养板,轻轻混匀,37℃、5% CO2中保温5~6 h后更换含有血清的全培养基,培养24 h后,G418(600 μg/mL)筛选,获得BAG-1表达沉默的B16F10细胞株,G418筛选后存活细胞扩增用于后续实验,提取其RNA及蛋白,RT-PCR检测BAG-1 mRNA变化,Western blot检测BAG-1蛋白变化。
1.3 细胞放射敏感性试验
1.3.1 克隆形成实验检测细胞放射敏感性 人胚肾上皮细胞HEK293的基因表达类似于神经系统细胞,对电离辐射较敏感,是辐射机制基础研究的常用细胞株。本实验以HEK293细胞作为对照,研究M14、B16F10细胞对X射线照射的敏感性。将HEK293、M14、B16F10细胞置于含10%胎牛血清的RMPI 1640培养基、5% CO2孵箱37℃孵育,2~3 d传代1次。取指数生长期细胞株,用胰酶消化后制成单细胞悬液,培养24 h后美国Varian Trilogy医用直线加速器照射。根据不同的X射线照射剂量将细胞接种于直径为100 mm培养皿中,照射X射线0、1、2、4、6、8 Gy的每皿1000个细胞,6、8 Gy的每皿2000个细胞,每组设三个平行皿。照射24 h后细胞继续培养14 d,至有克隆形成;倒去上清培养液,用PBS洗涤2次,加入75%甲醇固定液,铺满培养皿底面,固定5 min。弃去固定液,待稍干燥后加入0.5%结晶紫(甲醇配制)染色5 min,显微镜(低倍镜)下检查染色程度,当克隆着色足够时用水洗去残余染液,以每团细胞数>50个作为一个克隆计数,计算克隆形成率(克隆形成率=生成克隆数/接种细胞数×100%) 和存活分数(SF=受照射细胞的克隆形成率/对照细胞克隆形成率×100%)。描绘出的细胞存活曲线。
1.3.2 BAG-1基因沉默后黑素瘤细胞对放射线的敏感性 将未转染的B16F10细胞(Control组)、阴性对照质粒转染细胞(NC-shRNA组) 和稳定转染BAG-1-shRNA的细胞(BAG-1-shRNA组)暴露于0、1、2、4、6、8Gy的 X 射线,于照射后24 h进行克隆形成实验,比较细胞放射敏感性差异。
1.3.3 细胞凋亡检测 流式细胞仪检测细胞凋亡:将Control组、NC-shRNA组和BAG-1-shRNA组细胞浓度调整为5×106/mL,培养24 h后收集细胞。参照Annexin V/PI双染细胞凋亡检测试剂盒操作说明,流式细胞仪分析。在Annexin V高染而PI低染区域的细胞为早期凋亡细胞。
Western blotting检测BAG-1沉默对黑素瘤细胞凋亡相关蛋白Caspase3、8、9、PARP表达的影响:提取Control组、NC-shRNA组和BAG-1-shRNA组细胞蛋白,SDS-PAGE电泳,电泳结束后按半干转膜法转膜(NC膜),5%的脱脂奶粉中封闭2 h, 1∶1000稀释一抗孵育,室温下于摇床孵育2 h,TBST洗膜3次,每次10 min,加入1∶5000稀释的二抗,室温下,摇床孵育45~60 min,TBST洗膜3次,每次10 min,用LI-COR扫膜仪扫膜,红外激光成像系统对待测蛋白进行分析。
2 结果
2.1 检测干扰BAG-1表达效率 如图1所示,与Control组相比,BAG-1-shRNA组BAG-1 mRNA和蛋白表达明显降低,分别下降了68%、71%(P<0.05)。为验证质粒的干扰效率,同时检测了黑素瘤M14细胞转染BAG-1-shRNA后BAG-1mRNA表达,显示下降程度为70%,干扰效率类似于B16F10细胞。
2.2 黑素瘤细胞放射敏感性体外试验
2.2.1 黑素瘤细胞放射敏感性检测 见图2。细胞存活曲线显示人胚肾HEK293细胞对放射线较敏感,X线 8Gy剂量照射时存活率接近0,而黑素瘤细胞M14细胞和B16F10细胞的存活率分别为1.5%和1.9%(P<0.05)。
2.2.2 BAG-1基因沉默后黑素瘤细胞对放射线的敏感性 见图3。BAG-1-shRNA组对X放射线敏感性增高,8 Gy照射存活率为0.32%,相比Control组1.9%,NC-shRNA组1.75%,存活率显著降低(P<0.05)。
2.3 黑素瘤B16F10细胞凋亡及相关蛋白表达的影响
2.3.1 细胞凋亡率测定 见图4。Control黑素瘤B16F10细胞组在X线照射后凋亡率由2.5%升高至7.1%,在转染BAG-1-shRNA联合X线照射后,BAG-1-shRNA组的凋亡率达到25.3%, NC-shRNA组9.2%,差异显著(P<0.05)。
2.3.2 细胞凋亡相关蛋白检测 见图5。黑素瘤B16F10细胞BAG-1-shRNA组的pro-PARP、pro-Caspase 3等酶原蛋白较Control组和NC-shRNA组明显下降(P<0.05),凋亡蛋白c-PARP及细胞凋亡级联蛋白c-Caspase 3、Caspase 8、Caspase 9表达均较Control组和NC-shRNA组显著增高(P<0.05),尤其以c-PARP、c-Caspase 3的改变更为显著。结果证实Caspase酶解级联反应参与了BAG-1诱导的细胞凋亡调节过程。

图1 a:黑素瘤B16F10细胞转染BAG-1-shRNA组BAG-1mRNA表达下降了68%,M14细胞转染BAG-1-shRNA组BAG-1mRNA表达下降了70%;b、c:B16F10细胞转染BAG-1-shRNA组BAG-1蛋白表达下降了71%
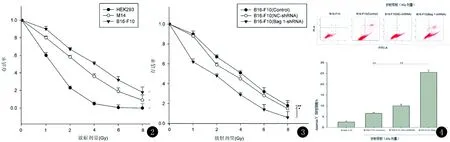
图2 不同X线照射剂量,人胚肾HEK293细胞和黑素瘤M14细胞、B16F10细胞的存活曲线图3 不同X线照射剂量,黑素瘤B16F10细胞Control组、转染NC-shRNA组、转染BAG-1-shRNA组的细胞存活曲线图4 流式细胞仪检测黑素瘤B16F10细胞Control组、转染NC-shRNA组、转染BAG-1-shRNA组X线照射前、后的细胞凋亡率

图5 Western blot法检测黑素瘤B16F10细胞Control组、转染NC-shRNA组、转染BAG-1-shRNA组细胞凋亡蛋白c-PARP、c-Caspase 3、Caspase 8、Caspase 9及其酶原pro-PARP、pro-Caspase 3的表达
3 讨论
BAG-1蛋白是一种多功能蛋白,具有多种调节功能:(1)抑制细胞凋亡和应激反应;(2)调节细胞信号传导;(3)影响转录活性;(4)参与调节蛋白质翻译后修饰-重组/降解,影响细胞黏附、侵袭、转移。干扰BAG-1表达可能通过抑制黑素瘤细胞增殖、促进黑素瘤细胞凋亡从而影响黑素瘤生物学行为及治疗反应[3]。Caspase半胱氨酸蛋白酶家族引发的级联反应是细胞凋亡过程的中心环节,BAG-1的过度表达能够抑制Caspase的激活,从而能抑制诸如化学制剂、放射等诱导的凋亡[5]。因此,干扰BAG-1表达有可能通过促进黑素瘤细胞凋亡而发挥治疗辅助效应。
黑素瘤本质上抵抗放疗这一观点最初源于细胞培养研究。临床上,黑素瘤的辅助放疗主要用于淋巴结清扫和某些头颈部黑素瘤(尤其是鼻腔)的术后补充治疗,可进一步提高局部控制率[6,7]。放射增敏是指为增强射线对肿瘤细胞的杀伤效应,提高肿瘤的控制率和治愈率,应用一些药物或物理等方法来提高肿瘤细胞对射线的敏感性的过程[8]。
本研究显示X放射线8 Gy剂量照射黑素瘤细胞M14细胞株和B16F10细胞株,其存活率分别为1.5%和1.9%,提示黑素瘤细胞对X放射线相对较抗拒。在RNA干扰BAG-1基因表达后,8 Gy剂量X线照射黑素瘤B16-F10细胞存活率为0.32%,提示RNA干扰BAG-1基因表达可显著增高黑素瘤细胞对X放射线的敏感性,即具有放射增敏功能。
流式细胞仪检测显示黑素瘤B16F10细胞在X线照射后凋亡率为7.1%, 在干扰BAG-1基因表达联合X线照射后其凋亡率则高达25.3%,差异显著。进一步研究发现RNA 干扰BAG-1基因表达可显著增高黑素瘤B16F10细胞c-PARP、c-Caspase 3、Caspase 8、Caspase 9等细胞凋亡相关蛋白的水平,提示促进细胞凋亡可能是干扰BAG-1基因表达所致放射增敏功能的机制之一。干扰黑素瘤细胞BAG-1表达促进细胞凋亡的具体机制有待进一步研究证实。
本研究提示干扰黑素瘤细胞RNA基因表达可能通过促进细胞凋亡发挥放射增敏功能,研究为临床黑素瘤治疗提供新的治疗靶位和治疗思路。
