新型离子液体亲和萃取鸡蛋清中的溶菌酶
2018-11-27,,,
, ,,
(北京工商大学食品学院,北京食品营养与人类健康高精尖创新中心,北京 100048)
溶菌酶(Lysozyme)是英国科学家Fleming于1922年在人的眼泪和唾液中发现的一种能够特异性水解微生物细胞壁的β-1,4糖苷键的酶,又称胞壁质酶、细胞壁溶解酶[1],广泛存在于鸟类、蛋清、人及其他哺乳动物的一些组织细胞中,其中对蛋清中溶菌酶的研究最为深入[2-3]。鸡蛋清中的溶菌酶是白色、呈晶体结构的粉末,易溶于水,含量占蛋清蛋白总量的3.4%~3.5%,分子量为14.3 kDa,等电点为11.0,最适pH在7.0左右。由于溶菌酶具有无毒无害、安全性高、能够溶解细胞壁等优点,并广泛应用于食品工业、畜牧饲料、医药、生物技术等领域[4-7],工业中溶菌酶主要来源于蛋清,因此蛋清中溶菌酶提取分离至关重要。
从鸡蛋清中提取溶菌酶方法已有很多[8-11],主要有直接结晶法[12]、离子交换法[13]、超滤法[14]、反胶团萃取法[15]、亲和色谱法[16]、双水相逆流色谱法[17]等。但是这些方法得到的溶菌酶纯度最高80%,酶活力从10000~17500 U/mg不等,其中结晶法最简单,但是周期长、效率低、纯度和活性低。已经工业化的离子交换法得到的酶活仅为15000 U/mg左右[18-20],亲和色谱法可以得到的酶活也仅大于17500 U/mg的酶[21]。离子液体(Ionic liquids,ILs)是一种在室温或室温附近呈液态的熔融盐,离子液体是一种很好的绿色溶剂,具有蒸气压低、良好的热稳定性与化学稳定性、可调性强、应用范围广等优点,且不同的离子液体对不同的物质溶解性不同[22-24]。但单独使用离子液体存在粘度大、萃取物质时间长,且离子液体价格昂贵等缺点,因此将离子液体与其他萃取体系相结合,既能利用离子液体绿色的优势,又能克服传统萃取体系的缺点,现已成为人们研究的热点[25-27]。辛巴蓝(Cibacron Blue F-3GA,简称CB)是一种活性染料,分子内含有三嗪环。CB结构中的生色团可以与许多蛋白质发生亲和作用,活性三聚氯氰官能团含氯原子,氯原子能够与含有羟基、氨基的物质发生取代反应,因此可以利用这个性质将辛巴蓝与多糖等载体结合形成亲和体系,用于对蛋白质的特异性结合[28-32]。
本文采用CB修饰离子液体[C4MIM]Cl,得到一种新型离子液体[C4MIM]3[CB],利用[C4MIM]3[CB]与溶菌酶的特异性结合作用,经过萃取和反萃取,将鸡蛋清中的溶菌酶与其他蛋白实现高效分离,以期分离得到高纯度和高酶活力的溶菌酶。
1 材料与方法
1.1 材料与仪器
鸡蛋 市售;溶菌酶、卵白蛋白、卵转铁蛋白、Cibacron Blue 3G-A(辛巴蓝F3GA) 美国Sigma公司;[C4MIM]Cl、[C4MIM]PF6上海成捷化学有限公司;硝酸银 国药集团化学试剂有限公司;乙腈(色谱纯)、丙酮(色谱纯)、甲醇(色谱纯) Thermo Fisher Scientific(赛默飞世尔科技公司);溶壁微球菌(E.C. 3.2.1.17) 中国科学院微生物研究所。
SpectraMax 190酶标仪 Molecular Devices公司;PowerPacTMHC电泳仪 Bio-Rad公司;其它仪器 均为常规仪器。
1.2 实验方法
1.2.1 [C4MIM]3CB的合成 称取1 g CB、2.0179 g AgNO3于30 mL去离子水中溶解,室温下磁力搅拌24 h。离心(3400×g,5 min)移除上清液,蓝色银盐沉淀用10 mL的冰水洗涤3次,沉淀用真空干燥(40 ℃)去除水分。将干燥物溶于10 mL乙腈中,加入3倍当量的[C4MIM]Cl,40 ℃下搅拌72 h。反应液在3400×g下离心5 min,得到含[C4MIM]3CB的乙腈溶液以及AgCl沉淀,将上清液离心浓缩,真空干燥去除乙腈后用丙酮溶解,离心(3400×g,5 min),以除去未参加反应的Ag3CB,得到的上清液经离心浓缩、真空干燥,得到目标物[C4MIM]3CB。
1.2.2 [C4MIM]3CB的[C4MIM]PF6溶液的配制 离子液体的阴离子会影响其在水相溶液中的溶解度。在以[C4MIM]3CB的[C4MIM]PF6溶液为萃取剂,从水溶液萃取蛋白质时,由于二者在水中有一定的溶解度,会导致[C4MIM]3CB的流失和蛋白质的损失。因此,在将离子液体相用于萃取蛋白之前,用等体积的去离子水洗5次使其处于水饱和状态,以保证更好的蛋白萃取率。
1.2.3 鸡蛋清样品的处理 取新鲜鸡蛋,破壳分离蛋清,以不起泡沫为宜,磁力搅拌30 min,使蛋清稠度均匀,用2层脱脂纱布将搅拌均匀的蛋清过滤于较大的培养皿中,冷冻干燥(-75 ℃,24 h)得到蛋清粉(100 mL蛋清液得到12 g蛋清粉,得率为12%),置于-20 ℃冰箱中保存备用。
1.2.4 蛋清粉样品中溶菌酶含量的测定 采用国标GB/T 25879-2010的方法测定鸡蛋清样品中溶菌酶的含量[32]。
1.2.4.1 溶菌酶标准曲线的绘制 将已配制好的0.5 mg/mL溶菌酶溶液(0.9%氯化钠溶液溶解),用0.9%氯化钠溶液稀释成不同浓度。以0.9%氯化钠溶液为参比溶液,在280 nm下测定吸光度,以溶菌酶标准溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到标准曲线方程,线性方程为Y=0.8531X+0.0513,相关系数R2=0.9991,线性关系良好。
1.2.4.2 蛋清粉样品中溶菌酶含量的测定 用0.9%氯化钠溶液溶解蛋清粉样品配置成一定浓度的溶液,离心取上清液,按照实验方法在280 nm下测定吸光度,平行测定三次,通过标准曲线得到鸡蛋清粉样品中溶菌酶的含量为24 mg/g。
1.2.5 蛋白质溶液的萃取过程 5 mg/mL的蛋白质溶液(0.9%氯化钠溶液溶解)的萃取分为两个部分,萃取和反萃取,操作流程图如图1所示。取50 mL蛋白溶液和50 mL离子液体相([C4MIM]3CB的[C4MIM]PF6溶液)充分混合振荡,完成萃取过程;离心(5000 r/min,10 min)得到的离子液体相,加入50 mL KCl溶液(1 mol/L),进行反萃取操作,离心取出水相溶液在280 nm下测定蛋白浓度,并脱盐(透析12 h)、浓缩(超滤管浓缩)、冷冻干燥(-75 ℃,24 h),得到12.5 mg产品。

图1 蛋白质溶液萃取实验的基本流程Fig.2 Basic process of proteins extraction experiment
1.2.5.1 蛋白质溶液pH对蛋白质萃取率的影响 用不同pH(3、5、7、9、11)的醋酸-醋酸钠缓冲液分别溶解3种标准蛋白质,配制成1 mg/mL的溶菌酶、卵白蛋白、卵转铁蛋白溶液,取0.5 mL蛋白标准溶液加入0.5 mL的4 mg/mL[C4MIM]3CB的离子液体相,涡旋振荡15 min,离心得到离子液体相;在离子液体相中加入0.5 mL pH为7.0、浓度为1.5 mol/L 的KCl溶液进行反萃取,振荡离心取水相,在280 nm下测蛋白浓度。
1.2.5.2 离子液体相中[C4MIM]3CB浓度对蛋白质萃取率的影响 用去离子水溶解溶菌酶(1、2 mg/mL)、卵白蛋白(1 mg/mL)、卵转铁蛋白(1 mg/mL),取0.5 mL蛋白质溶液加入0.5 mL不同浓度的[C4MIM]3CB(0、0.5、1、2、4、8、12 mg/mL)离子液体相,涡旋振荡15 min,离心得到离子液体相;在离子液体相中加入0.5 mL pH为7.0、浓度为1.5 mol/L的KCl溶液进行反萃取,振荡离心取水相,在280 nm下测蛋白浓度。
1.2.5.3 振荡时间对蛋白质萃取率的影响 取0.5 mL 2 mg/mL的溶菌酶水溶液,加入0.5 mL的8 mg/mL[C4MIM]3CB离子液体相,涡旋振荡0.5、1、5、10、15、30 min,离心得到离子液体相;在离子液体相中加入0.5 mL pH为7.0、浓度为1.5 mol/L 的KCl溶液进行反萃取,振荡离心取水相,在280 nm下测蛋白浓度。
1.2.5.4 KCl浓度对蛋白质萃取率的影响 取0.5 mL的2 mg/mL溶菌酶水溶液,加入0.5 mL的8 mg/mL[C4MIM]3CB离子液体相,涡旋振荡15 min,离心得到离子液体相;在离子液体相中加入pH为7.0、浓度分别为0、0.25、0.5、0.75、1、1.5、2 mol/L 的KCl溶液进行反萃取,振荡离心取水相,在280 nm下测蛋白浓度。
1.2.5.5 反萃取溶液pH对蛋白质萃取率的影响 取0.5 mL的2 mg/mL溶菌酶水溶液,加入0.5 mL的8 mg/mL[C4MIM]3CB离子液体相,涡旋振荡15 min,离心得到离子液体相;在离子液体相中加入浓度为1.5 mol/L、pH分别为1、3、5、7、9、11的KCl溶液进行反萃取,振荡离心取水相,在280 nm下测蛋白浓度。
1.2.6 蛋白质萃取率的测定 通过萃取和反萃取,得到的蛋白质溶液的萃取率按公式计算。
式(1)
式中:Ce为萃取后水相中蛋白质溶液的浓度(mg/mL);C为萃取前加入的蛋白质的浓度(mg/mL)。其中蛋白质溶液浓度由酶标仪在波长280 nm下测得。
1.2.7 蛋清粉溶菌酶含量的测定 配制一系列浓度的溶菌酶标准溶液(0.25、0.5、0.75、1、1.25、1.5、1.75、2 mg/mL),按照优化好的实验方法进行萃取和反萃取,以溶菌酶浓度为横坐标,反萃取得到的水相中溶菌酶的吸光度值为纵坐标,绘制标准曲线。
取5 mg/mL蛋清粉样品水溶液,按照优化的实验方法,进行萃取和反萃取,通过反萃取得到的水相中溶菌酶的吸光度值和标准曲线,计算蛋清粉溶菌酶的含量。
1.2.8 蛋清粉样品的放大分离实验 取5 mL的50 mg/mL的蛋清粉样品,加入5 mL的8 mg/mL[C4MIM]3CB的离子液体相,经过萃取与反萃取,平行两次,对萃取后的上清液除盐、浓缩,并进行浓度、纯度以及活性测定。
1.2.9 溶菌酶纯度的测定 利用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行蛋白纯度的测定。配制12%分离胶和4%的浓缩胶。吸取30 μL样品溶液,加入10 μL 4×蛋白上样缓冲液,混合均匀取10 μL作为电泳样品。在1×Tris缓冲液中进行分离。用考马斯亮蓝染液R250染色、脱色液脱色,在凝胶成像系统中观察。
1.2.10 溶菌酶活性的测定 溶菌酶活性的测定采用比浊法[33]。用0.1 mol/L NaOH溶液调液体培养基的pH至7.0,高压蒸汽灭菌(121 ℃,20 min)。将100 μL溶壁微球菌菌液接种于液体培养基中,在37 ℃恒温摇床中250 r/min培养12 h。将培养好的溶壁微球菌的菌悬液在6000 r/min下离心10 min,弃上清液。用pH6.24的磷酸盐缓冲液溶解菌体沉淀,在450 nm下测定吸光度,吸光度落在0.7~0.8为宜。向比色皿中加入0.02 mL样品溶液、2.98 mL菌液,在450 nm下每min记录读数,平行3次。
溶菌酶活力单位的规定:在450 nm下,每分钟使溶壁微球菌菌液吸光度降低0.001的酶量,称为1个酶活力单位。同时计算比活力、酶活回收率和纯化倍数。计算公式如下。
活力(U/mL)=(ΔA/min)/(0.001/min×0.02 mL)。
比活力(U/mg)=U(U/mL)·M(mg/mL)
式中,M代表蛋白质浓度,ΔA代表450 nm下吸光度变化值。
酶活回收率(%)=(反萃取后水相中溶菌酶活力/萃取前蛋白溶液溶菌酶活力)×100;
纯化倍数=反萃取后水相中溶菌酶的比活力/萃取前蛋白稀释液溶菌酶比活力。
1.3 数据统计分析
使用AutoDock Vina软件计算[C4MIM]3CB中[C4MIM]+和CB部分与溶菌酶、卵白蛋白、卵转铁蛋白的结合能。
2 结果与分析
2.1 蛋白质溶液pH对蛋白质萃取率的影响
由于不同的蛋白质具有不同的等电点,因此,pH对蛋白质的萃取有很大影响。在鸡蛋清中,卵白蛋白的等电点为4.8,卵转铁蛋白的等电点6.5,溶菌酶的等电点为11.0[35],三种蛋白的等电点有较大差异,因此实验考察了不同pH对三种蛋白质萃取率的影响,结果如图2所示。结果表明,在所研究的pH范围内,溶菌酶的萃取率明显高于卵白蛋白和卵转铁蛋白的萃取率,说明[C4MIM]3CB与溶菌酶、卵白蛋白和卵转铁蛋白的结合有明显差异。

图2 蛋白质溶液的pH对溶菌酶萃取率的影响Fig.2 Effect of pH of proteins solution on the extraction efficiency of lysozyme
在pH3~11范围内,对于卵白蛋白和卵转铁蛋白,高于两者等电点时,带负电荷,与带负电荷的CB部分有排斥作用,但结果表明两者与[C4MIM]3CB有一定结合;低于等电点时,带正电荷,与CB有静电相互作用,但结合不强,可能是由于其结合静电相互作用并不是关键因素[36]。对于溶菌酶,所研究的pH低于溶菌酶的等电点,溶菌酶带正电荷,而离子液体[C4MIM]3CB与溶菌酶有亲和作用的染料CB部分带负电荷,与溶菌酶有静电相互作用,且CB有疏水性的芳环结构,与溶菌酶的疏水部分有疏水相互作用,因此,在静电相互作用与疏水相互作用下,溶菌酶与[C4MIM]3CB能够结合在一起。由图3可知,随着pH的增大,溶菌酶经过萃取和反萃取之后所得的萃取率增加,在pH达到7左右,溶菌酶被完全萃取出来。pH低于5时,溶菌酶与[C4MIM]3CB、[C4MIM]PF6可能发生强静电相互作用形成缔合体,导致溶菌酶变性,影响其溶解度,造成萃取率降低[34]。综合考虑,选择pH7.0作为蛋白质溶液的pH。为操作方便,选用去离子水(pH=6.8)作为溶解蛋白的溶剂,对溶菌酶、卵白蛋白和卵转铁蛋白的萃取率分别为98.7%、0.21%、1.74%,能够达到将溶菌酶与卵白蛋白和卵转铁蛋白分离的目的。

图3 [C4MIM]3CB在[C4MIM]PF6中的浓度对溶菌酶萃取率的影响Fig.3 Effect of concentration of[C4MIM]3CB in[C4MIM]PF6 on the extraction efficiency of lysozyme
2.2 [C4MIM]3CB浓度对蛋白质萃取率的影响
由图3可知,溶菌酶的萃取率远高于卵白蛋白和卵转铁蛋白的萃取率。对于同一浓度的溶菌酶,随着[C4MIM]3CB的浓度增加,溶菌酶的萃取率逐渐增加,当浓度不低于8 mg/mL时,萃取率高于98%。对于卵白蛋白和卵转铁蛋白,由于[C4MIM]3CB与卵白蛋白和卵转铁蛋白没有亲和作用,在萃取的过程中,这两种蛋白仍留在水溶液中,从而与溶菌酶分开。综合考虑,选择8 mg/mL的离子液体相、2 mg/mL的溶菌酶作为后续的研究。由于在萃取过程中,卵白蛋白和卵转铁蛋白留在水相中,因此后续的实验仅需研究对溶菌酶的萃取效果。
2.3 振荡时间对溶菌酶萃取率的影响
由图4可知,随着萃取时间的增加,溶菌酶的萃取率增加,这是由于时间越长,溶菌酶和[C4MIM]3CB的结合就越完全,在5 min达到了96.5%,15 min溶菌酶萃取完全,因此选择15 min作为蛋白质标准溶液和蛋白样品的前萃取时间。

图4 振荡时间对溶菌酶萃取率的影响Fig.4 Effect of extraction time on the extraction efficiency of lysozyme
2.4 KCl浓度对溶菌酶萃取率的影响
溶液的离子强度会影响蛋白的双电层厚度。双电层厚度会随着离子强度即盐溶液浓度的增大而降低,从而使静电相互作用降低,减弱蛋白质与[C4MIM]3CB的结合作用。因此,可以通过增加溶液的盐浓度的方式实现溶菌酶从离子液体相到水相的反萃取。实验选用不同浓度的KCl溶液对萃取后得到的离子液体相进行反萃取,结果如图5所示。由图5可知,随着KCl浓度的增加,将离子液体相中溶菌酶萃取出的量增多,当浓度达到1.5 mol/L时,溶菌酶被完全萃取出来,这是由于随着KCl浓度的增加,溶液中离子强度增加,蛋白质的双电层厚度变低,与[C4MIM]3CB的CB部分结合越弱,就越容易萃取到KCl溶液中[36]。因此,选择KCl浓度为1.5 mol/L作为后萃取的盐浓度。

图5 KCl浓度对溶菌酶萃取率的影响Fig.5 Effect of concentration of KCl on the extraction efficiency of lysozyme
2.5 反萃取溶液pH对溶菌酶萃取率的影响
pH是影响萃取率的重要因素,因此,需要对反萃取的KCl溶液的pH进行优化,结果如图6所示。由图6可知,随着pH的增加,溶菌酶的萃取率逐渐增加,在pH7.0时达到最大,当溶液呈碱性时,溶菌酶的萃取率下降,这可能是由于溶菌酶的等电点为11.0,在接近等电点的附近,溶菌酶的溶解性降低。因此,选择pH7.0作为反萃取溶液的pH。
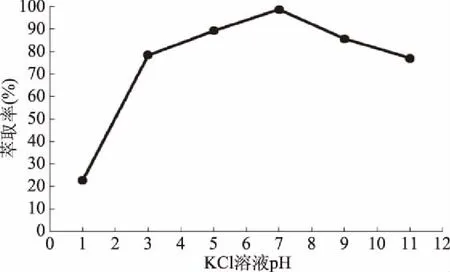
图6 KCl溶液pH对溶菌酶萃取率的影响Fig.6 Effect of pH of KCl on the extraction efficiency of lysozyme
2.6 蛋清粉样品的放大分离实验
结果见表1所示。由表1可知,5 mL 50 mg/mL的鸡蛋清粉经过萃取与反萃取,所得蛋白质溶液脱盐、浓缩、冷冻干燥后,得到了12.3 mg、纯度为97.56%的溶菌酶样品,回收率为92.31%,且经过萃取、反萃取之后,所得溶菌酶的比活力能够达到35000 U/mg,与蛋清粉的比活力936 U/mg相比,纯化倍数达到37.39倍,酶活回收率为89.74%。经过萃取、反萃取之后的水相蛋白质溶液的电泳图如图7所示。通过电泳图可以得出,采用上述萃取方法,在优化的萃取条件下,经过萃取步骤后,卵白蛋白和卵转铁蛋白等其他蛋白被完全去除,经反萃取之后能够得到高纯度的溶菌酶。说明此方法可以用于蛋清中溶菌酶的分离,分离彻底且能够保持较高的酶活。

表1 鸡蛋清样品放大萃取结果Table 1 The amplified extraction results of egg white
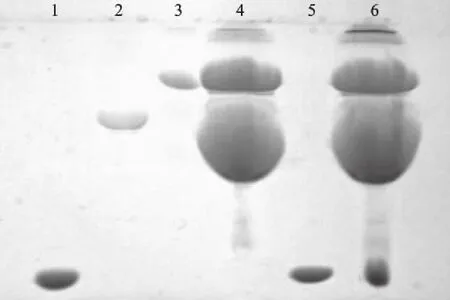
图7 鸡蛋清萃取得到的溶液SDS-PAGE电泳图Fig.7 SDS-PAGE electrophoretic diagram of solution extracted from the egg white 注:1.溶菌酶标品;2.卵白蛋白标品; 3.卵转铁蛋白标品;4.萃取后剩余的蛋白质溶液; 5.反萃取得到的溶菌酶溶液;6.蛋清样品。
2.7 AutoDock Vina分析[C4MIM]3CB与蛋白的结合能

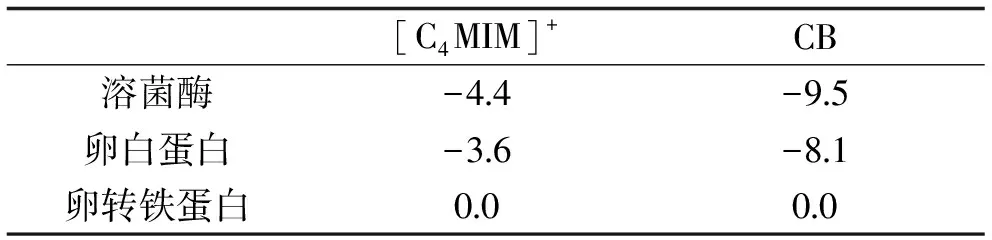
表2 [C4MIM]+和CB分别与溶菌酶、卵白蛋白、卵转铁蛋白结合能Table 2 The binding energies of[C4MIM]+and CB respectively bindto lysozyme, ovalbumin and ovotransferrin respectively

图8 溶菌酶与[C4MIM]3CB结合图Fig.8 Conmbination graph of lysozyme and[C4MIM]3CB

图9 卵白蛋白与[C4MIM]3CB结合图Fig.9 Conmbination graph of albumin and[C4MIM]3CB
3 结论
本实验建立并优化了一种利用CB修饰的新型离子液体[C4MIM]3CB高效萃取鸡蛋清中溶菌酶的方法,并利用蛋白结构模型,计算其与[C4MIM]3CB的结合能,对其可能的分离机理进行了探讨。优化的最佳萃取分离条件为:蛋清粉溶液pH7,新型离子液体中[C4MIM]3[CB]浓度为8 mg/mL,反应震荡时间为15 min,反萃取KCl溶液pH7.0,浓度为1.5 mol/L,最终250 mg蛋清粉可得12.3 mg溶菌酶产品。该方法经过萃取和反萃取两步过程,实现了溶菌酶与蛋清中其他蛋白的完全分离,得到高纯度(97.56%)、高活性(35000 U/mg)的溶菌酶。与其它已有的萃取分离方法相比(其溶菌酶最高纯度80%,最高活性17500 U/mg),此法具有选择性高、操作简便、产品纯度高等特点,为蛋清中溶菌酶的提取分离提供了一条新的、高效的途径。
