布鲁氏菌LPS及VirB2缺失株对巨噬细胞SUMO-1表达及Ubc-9转录水平的影响
2018-11-23童志霞李天森李启峰丁金花陈创夫
童志霞,李天森,李启峰,丁金花,张 辉,陈创夫
(石河子大学动物科技学院,石河子 832000)
布鲁氏菌是引起家畜和野生动物感染的胞内革兰氏阴性细菌病原体,其中B.abortus、B.melitensis和B.suis对人类健康影响最为显著,近年来发病率呈上升趋势,尤其是在发展中国家[1]。布鲁氏菌在宿主细胞中的存活及繁殖机理与几种毒力因子密切相关:外膜蛋白、脂多糖(lipopolysaccharide,LPS)、Ⅳ型分泌系统(T4SS)等[2]。布鲁氏菌不具备经典的LPS结构,LPS通过改变细胞凋亡、细胞因子分泌、吞噬作用以及抗原递呈,使布鲁氏菌在宿主细胞内得以长期存活和复制[3]。通过构建基因缺失株证明,VirB蛋白是Ⅳ型分泌系统中重要的毒力因子,在侵入宿主巨噬细胞和胞内复制过程中发挥重要作用[4-5]。其中,VirB2和VirB5构成的表面结构与布鲁氏菌的毒力及胞内生存密切相关[6-7]。目前,对于布鲁氏菌如何逃避机体免疫系统,以及布鲁氏菌侵入宿主细胞后如何改变细胞内环境达到利于自身生存的研究,一直是国内外布鲁氏菌致病机制研究的热点。
SUMO化修饰和泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是细胞蛋白酶抑制的关键调节因子,并且涉及减数分裂前期的各个方面[8]。与泛素途径相类似,SUMO途径也是由3个酶(E1、E2和E3)相继参与完成[9]。在生物体中只发现1种E2结合酶:Ubc-9,它在SUMO化修饰介导的细胞通路中行使着重要功能[10]。有研究表明,Ubc-9对细胞增殖有显著影响,如果Ubc-9功能缺失,就能抑制肿瘤细胞的增殖[11-12]。SUMO化系统可能有助于抵御微生物攻击的内在防御机制,但目前对于Brucella与SUMO化之间的关系尚不明确。
本研究以布鲁氏菌LPS、Ⅳ型分泌系统VirB2缺失株侵染细胞,检测细胞中类泛素SUMO-1的表达水平和偶联酶Ubc-9的mRNA 的转录水平,初步探讨布鲁氏菌感染宿主细胞后影响类泛素表达的分子机制。
1 材料与方法
1.1 材料
1.1.1 细胞和菌株 布鲁氏菌16M强毒株、小鼠巨噬细胞RAW264.7由石河子大学人畜共患病实验室保存;布鲁氏菌16M△VirB2缺失株由本实验室构建。
1.1.2 试剂 SYBR Green荧光染料和八连管均购自Roche公司;SuperRT cDNA第一链合成试剂盒、RNA提取试剂盒均购自北京康为世纪生物公司公司;DMEM培养基、胎牛血清均购自Gibco公司;其他常用试剂为国产分析纯;兔抗SUMO-1单抗购自Abcam公司;鼠抗兔HRP-IgG二抗购自Bio-world公司。
1.1.3 主要仪器设备 常规离心机为Thermo公司;全自动高压灭菌锅为SANYO公司;高速冷冻离心机(centrifuge-5415D)为德国Eppendorf公司;实时定量PCR仪为德国Roche公司;超净工作台(BHC-1300A/B3);恒温摇床(HWY-100B)。
1.2 方法
1.2.1 布鲁氏菌16M强毒株、布鲁氏菌16M△VirB2缺失株的培养 在生物安全柜中以1:1000的体积比接种布鲁氏菌16M强毒株以及布鲁氏菌16M△VirB2缺失株,于180 r/min、37℃恒温摇床培养至对数生长期,用接种环分别划线接种至布鲁氏菌固体培养基上,封口,37℃恒温培养箱中倒置培养3~5 d。挑取单个菌落接种于20 mL布鲁氏菌液体培养基中,于37℃、180 r/min摇床培养1~2 d,细菌达到对数生长期时收菌。
1.2.2 布鲁氏菌LPS的提取 85℃金属浴灭活30 min,室温收集2~5 mL,16 000×g离心2 min;加入1 mL细胞裂解液,充分涡旋混匀使之成为悬浊液,加入200 μL氯仿,剧烈涡旋10~20 s后室温孵育5 min;用低温离心机在4℃、16 000×g离心15 min,转移400 μL上清液于新的1.5 mL离心管中;加入800 μL purification buffer充分混匀,于-20℃孵育10 min;4℃、16 000×g离心15 min,弃上清后获得LPS颗粒;加入1 mL70%乙醇翻转2~3次清洗LPS颗粒,再次4℃、16 000×g离心3 min,弃去乙醇溶液,室温晾干残留的LPS颗粒。加入30~50 μL10 mmol/L的Tris-HCl buffer(pH= 8.0)涡旋溶解LPS颗粒,100℃中煮沸2 min完全溶解LPS颗粒,瞬时离心,即得到纯化的LPS。用微量紫外分光光度计检测LPS的浓度,将其保存于-20℃冰箱中。
1.2.3 小鼠巨噬细胞RAW264.7的培养 将在液氮中冻存的小鼠巨噬细胞RAW264.7取出,37℃恒温水浴条件下迅速晃动冻存管,直至细胞与冻存液变为液体;在超净工作台中将液体转移至15 mL离心管中,加入4 mL DMEM培养液,封口后71×g离心5 min;弃上清,加入2 mL DMEM细胞培养液重悬细胞,转移至6 cm培养板中,在5%CO2、37℃恒温培养箱中培养1~2 d;当细胞汇合度达到80%~100%时传代至10 cm培养板中继续培养。
1.2.4 布鲁氏菌16 M脂多糖LPS对小鼠巨噬细胞中类泛素SUMO-1和偶联酶 Ubc-9 表达的影响 将小鼠巨噬细胞以5×105细胞/孔重新铺板于六孔板中,37℃、5% CO2培养箱中培养;待细胞汇合度达到80%,向六孔板中分别加入浓度为0.1、1、10 ng/mL的布鲁氏菌16 M脂多糖LPS,每个浓度做3个重复孔,8字摇匀后于37℃、5% CO2培养箱中培养;分别在30 min、1 h、3 h时收集细胞,向六孔板中加入200 μL含有蛋白酶抑制剂的细胞裂解液,使用移液枪反复吹打,直至细胞脱落;转移液体至1.5 mL 无菌EP 管中,冰上裂解10 min,4℃、138 000×g离心10 min,收集上清,-80℃保存备用。同时,其余六孔板用移液枪吸弃细胞培养液,PBS轻轻洗涤2~3遍,然后向每孔中加入1 ml Trizol,移液枪反复吹打,充分裂解细胞,转移液体于1.5 mL RNase-Free EP 管中,按照康为世纪超纯RNA提取试剂盒说明书获得细胞 RNA。
1.2.5 布鲁氏菌16M强毒株、布鲁氏菌16M△VirB2缺失株侵染小鼠巨噬细胞RAW264.7 布鲁氏菌16M、布鲁氏菌16M△VirB2缺失株以侵染复数MOI=100:1进行侵染实验:将收集的16M及16M△VirB2缺失株菌液用PBS洗涤2~3次后重悬混匀,与麦氏比浊管比浊至所需浓度,每孔加入1 mL比浊后的菌液轻摇混匀,于5%CO2、37℃恒温培养箱中孵育1 h;每孔加入2.5 μL硫酸庆大霉素孵育45 min以杀死胞外细菌,PBS清洗3次后更换为无抗性的DMEM完全培养液继续培养。分别在侵染后1、3、5 h收集细胞(每个时间点做3次重复独立实验)。
1.2.6 qRT-PCR检测类泛素SUMO-1/2/3和偶联酶Ubc-9 mRNA的转录水平 根据康为超纯RNA提取试剂盒说明提取细胞总RNA,用NanoDrop-2000c核酸蛋白微量定量仪检测浓度和纯度,利用HiFiScript cDNA第一链合成试剂盒进行反转录合成cDNA,于-20℃长期保存。采用Roche LightCycler480®荧光实时定量PCR仪,以不同时间段收集的细胞的cDNA为模板,β-actin为内参基因,检测类泛素SUMO-1/2/3和偶联酶Ubc-9m RNA表达量,引物见表1。qRT-PCR反应体系(10 μL):SYBR Green Realtime PCR Master Mix 5 μL,目的基因类泛素SUMO-1/2/3和偶联酶Ubc-9上、下游引物或内参基因β、下游引物或上、下游引物各0.2 μL,ddH2O 3.6 μL,cDNA模板1 μL。反应条件:95℃预变性30 s;95℃变性5 s、60 ℃退火10 s、72℃延伸15 s,40个循环。用2-ΔΔCt法进行相对定量分析。在同样的条件下进行3个实验重复。
1.2.7 Western blot检测类泛素SUMO-1蛋白表达量分别在细胞感染1、3、5 h时,吸弃培养液,PBS洗涤后,每孔加入200 μL细胞裂解液和2 μL蛋白酶抑制剂PMSF,冰上裂解15 min;细胞刮刮取细胞重复孔合为1管,4℃、13 000×g离心10 min,将上清转移至新的离心管中,以最小浓度为标准稀释为统一浓度,加入5×蛋白示踪上样缓冲液100℃煮沸10 min,冷却至室温后取20 μL变性蛋白液于12%SDS-PAGE胶进行垂直电泳检测;将蛋白转印至NC膜上,以兔抗类泛素SUMO-1为一抗(用TBST按照1:2500稀释),37℃孵育1 h;鼠抗兔HRP-IgG为二抗(用TBST按照1:5000稀释),37℃孵育1.5 h,进行Western blot检测,DAB避光显色后利用Quantity one 4.6.2软件分析灰度值,目的蛋白与内参蛋白灰度值之比作为结果进行比较。
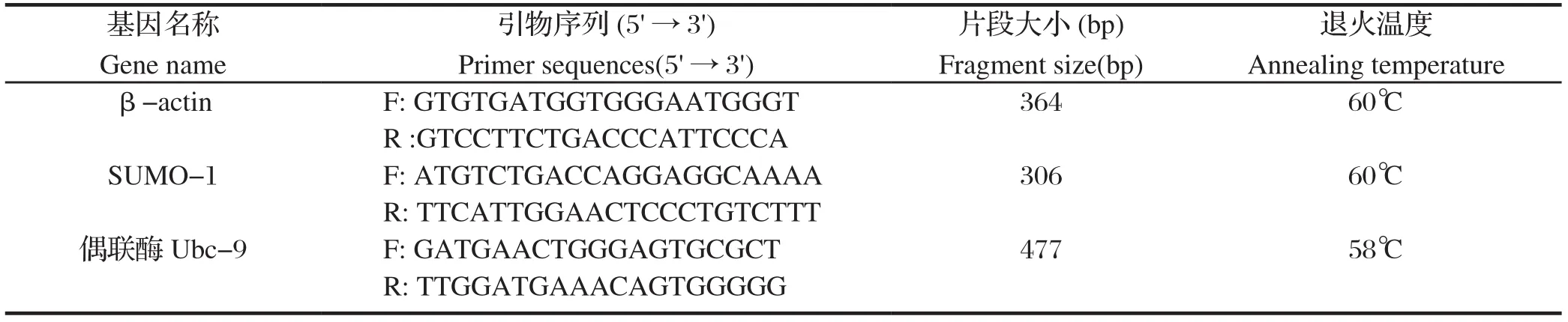
表 1 实时定量PCR引物Table 1 Primers for real-time quantitative PCR
1.2.8 统计学分析 使用SPSS17.0软件对qRT-PCR数据以及Quantity one 4.6.2软件分析所得灰度值进行单因素方差分析(ANOVA),数据用平均数±标准差(±s)表示,并用GraphPad Prism 5软件作图。
2 结果
2.1 布鲁氏菌LPS对小鼠巨噬细胞类泛素SUMO-1表达水平的影响吸取1 μL提纯的脂多糖 LPS,NanoDrop 2000c 检测脂多糖 LPS 的浓度,然后用无菌PBS稀释成实验所需浓度进行后续实验。Western blot检测结果见图1A,布鲁氏菌16M脂多糖LPS在任一浓度都并未引起小鼠巨噬细胞中SUMO-1表达的变化(图1B)。
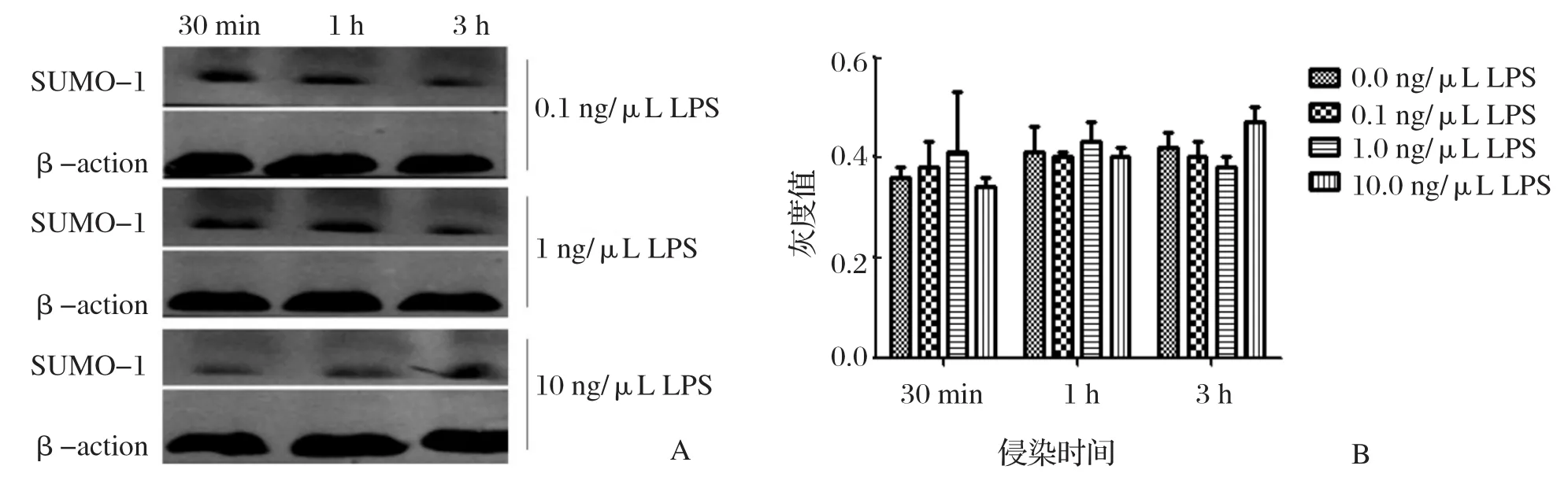
图1 巨噬细胞中类泛素 SUMO-1 蛋白在不同浓度LPS刺激下不同时间点的表达水平Fig.1 The expression levels of SUMO-1 protein in macrophages stimulated by different concentrations of LPS at different time
2.2 LPS刺激对小鼠巨噬细胞中Ubc-9 mRNA转录水平的影响qRT-PCR检测结果显示,各LPS刺激组与对照组相比,小鼠巨噬细胞中 Ubc-9 mRNA的转录水平差异均不具备显著统计学意义(P>0.5)(图2)。
2.3 布鲁氏菌16M△VirB2缺失株对小鼠巨噬细胞SUMO-1蛋白表达水平的影响通过 Western blot检测细胞中 SUMO-1蛋白的表达水平,结果显示,布鲁氏菌 16M△VirB2缺失株能够改变细胞中 SUMO-1蛋白的表达(图3A),与对照组相比,缺失株侵染组细胞中 SUMO-1 表达量显著增加(图3B),差异具有极显著统计学意义(P<0.01)。
2.4 布鲁氏菌16M△VirB2缺失株对小鼠巨噬细胞偶联酶Ubc-9 mRNA转录水平的影响qRT-PCR检测结果显示,与布鲁氏菌16M强毒株相比,布鲁氏菌16M△VirB2缺失株组中Ubc-9 mRNA转录水平显著增加,差异具有极显著统计学意义(P<0.01)(图4)。
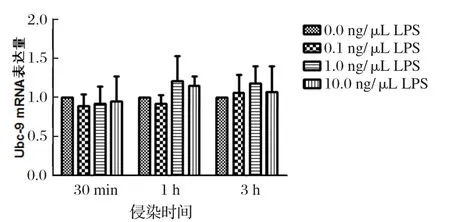
图2 巨噬细胞中Ubc-9 mRNA在不同浓度LPS刺激下不同时间点的转录水平Fig 2 The transcription level of Ubc-9 mRNA in macrophages stimulated by different concentration of LPS at different time

图 3 巨噬细胞中SUMO-V蛋白在16M、16M△VirB2缺失株侵染后不同时间点的表达水平Fig.3 The expression levels of SUMO-1 protein in Brucella 16M or 16M △VirB2-infected macrophages at different time
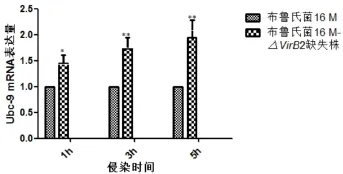
图4 巨噬细胞中Ubc-9 mRNA在16M、16M△VirB2缺失株侵染不同时间点的转录水平Fig.4 The transcription level of Ubc-9 mRNA in Brucella 16M or 16M△VirB2-infected macrophages at different time
3 讨论
毒力布鲁氏菌可以通过抑制巨噬细胞凋亡,建立有利于其在宿主细胞内长期存活和复制的环境[13]。脂多糖对革兰氏阴性细菌外膜的结构和功能的完整性是至关重要的[14]。布鲁杆菌LPS表现出与其他LPS不同的性质。与经典肠杆菌LPS相比,布鲁杆菌LPS比大肠杆菌LPS活性低几百倍且毒性小,在布鲁氏菌的胞内生存和复制中发挥重要作用[15]。研究表明,缺失布鲁氏菌LPS的某一组分,布鲁氏菌在宿主细胞内的生存能力明显减弱[14-15]。在细菌感染宿主细胞的致病机制研究中发现,致病菌会干扰类泛素化修饰过程中的某一环节,如李斯特杆菌的毒力因子融细胞素(Listeriolysin O,LLO),能够降解关键偶联酶 Ubc-9,从而干扰类泛素化修饰[16]。在志贺氏菌感染的情况下,一些被类泛素修饰的蛋白的定位发生了变化,且蛋白类泛素化修饰水平降低[17]。之前的研究同样证实了布鲁氏菌强毒株侵染细胞,可影响宿主细胞中类泛素化修饰相关蛋白表达的变化[18]。本研究通过不同浓度的布鲁氏菌 16M 脂多糖 LPS 侵染小鼠巨噬细胞后,观察到细胞中类泛素SUMO-1的表达水平和偶联酶Ubc-9的mRNA 的转录水平均未发生明显变化。因此,我们认为布鲁氏菌毒力因子LPS对宿主类泛素化修饰相关蛋白表达的影响不显著,布鲁氏菌感染宿主细胞后影响类泛素表达的分子机制还需进一步探究。
布鲁氏菌的Ⅳ型分泌系统是一种由VirB1~VirB12编码的多种蛋白复合物,主要向宿主细胞分泌毒力因子,与细菌在宿主细胞内存活和复制有关[4]。在布鲁氏菌众多的VirB操纵子中,VirB2是表面蛋白,通过对VirB2进行基因缺失研究发现,致病菌对实验小鼠的持续感染能力显著降低[19]。Hashemifar等[20]研究表明,VirB2和VirB5蛋白构成布鲁氏菌Ⅳ型分泌系统菌毛的重要组分,能够通过结合特异性受体调节宿主细胞信号传导途径,并且可以降解肽聚糖,在细胞壁上打孔并允许蛋白进入宿主细胞。本研究通过缺失株布鲁氏菌 16M△VirB2侵染小鼠巨噬细胞,不同侵染时间段检测其对细胞中类泛素SUMO-1的表达水平和偶联酶Ubc-9的mRNA 的转录水平的影响。分析结果发现,布鲁氏菌VirB2缺失株侵染后的巨噬细胞SUMO-1表达及Ubc-9转录水平显著增强,与VirB2蛋白功能的研究结果一致。因此,本研究初步确定,布鲁氏菌感染细胞过程中可能通过Ⅳ型分泌系统向宿主细胞中分泌效应蛋白,或者是Ⅳ型分泌系统的组分蛋白直接与细胞中类泛素化修饰相关蛋白相互作用,从而干扰类泛素化修饰。
本研究初步确定布鲁氏菌16M 脂多糖 LPS 对类泛素化修饰没有影响,可能是通过布鲁氏菌的Ⅳ型分泌系统或其自身组分蛋白影响类泛素SUMO-1的表达水平和偶联酶Ubc-9的mRNA 的转录水平,从而在胞内稳定繁殖。
