糖原合酶激酶-3介导β-catenin抑制猪流行性腹泻病毒的增殖
2018-11-23左叶雯李智丽焦亚娟孙大格李丽薇虞凌雪童光志单同领
左叶雯,孔 宁,李智丽,童 武,焦亚娟 ,王 桦 ,郑 浩,高 飞,孙大格 ,于 海 ,李丽薇,虞凌雪,童光志,单同领
(1.中国农业科学院上海兽医研究所,上海 200241;2.河南科技大学,洛阳 471023)
猪流行性腹泻病毒(Porcine epidemic diarrhoea virus,PEDV)为有囊膜单股正链RNA(singlestranded,ssRNA)病毒,属于尼多病毒目、冠状病毒科、α-冠状病毒属。PEDV主要引起猪的厌食、呕吐、腹泻、消化道粘膜发炎和糜烂等症状。近年来,变异型PEDV对养猪业造成了巨大的影响,7日龄以内仔猪感染后的发病率和死亡率高达100%。PEDV常和猪传染性胃肠炎病毒、轮状病毒等其他肠道病毒混合感染,对养猪业危害极大[1]。
病毒感染细胞后会引起细胞内多种信号通路的变化,其中PI3K/AKT信号通路是调控病毒复制增殖的重要信号通路之一。糖原合成酶激酶-3(glycogen synthase kinase-3,GSK-3)是PI3K/AKT信号通路下游的一种丝氨酸/苏氨酸蛋白激酶,具有GSK-3α和GSK-3β两种亚基[2]。GSK-3广泛存在于哺乳动物细胞内,它能够通过磷酸化多种蛋白质底物从而发挥各种不同的生物学功能。同时GSK-3 在 Wnt 、Hedgehog 等多种信号通路中均发挥调节作用,调控细胞的生长、代谢及细胞分化等[3]。在细胞未受到外界刺激时,基础状态下的GSK-3具有激酶活性。当细胞受到病毒感染等应激后,能够上调GSK-3的磷酸化水平,其中当GSK-3α的Ser-21位点和GSK-3β的Ser-9位点的氨基酸残基被磷酸化后,GSK-3的激酶活性被抑制;而GSK-3α的Tyr-279位点和GSK-3β的Tyr-216位点被磷酸化后,GSK-3的激酶活性维持并增强[4-5]。
β-catenin是GSK-3的下游底物,在胚胎发育、细胞迁移和维持遗传稳定性等过程中均发挥着重要的调节作用。激活状态下的GSK-3能够将β-catenin的Thr41、Ser37、Ser33位点依次磷酸化,磷酸化的β-catenin最后被细胞内泛素化蛋白酶体系统所降解[6]。
目前对PEDV致病的分子机制尚缺乏深入研究,故只有进一步深入探究PEDV与宿主之间的相互关系,才能对PEDV的致病机制有一个更深入的了解,从而为PEDV的防治与调控提供更好的策略,进而减轻PED对猪群造成的危害。本研究主要通过探究GSK-3及β-catenin对PEDV复制的影响,挖掘二者之间的内在联系,为进一步揭示PEDV的致病机制和宿主的抗病毒研究提供理论依据。
1 材料与方法
1.1 毒株和细胞变异PEDV强毒株JS-2013、Marc-145细胞均由中国农业科学院上海兽医研究所猪病毒性繁殖障碍综合征团队(本实验室)保存。
1.2 主要试剂DMEM培养基、Opti-MEM培养基、胰酶、胎牛血清(FBS)均购自Gibco公司;蛋白酶抑制剂购自Biotool公司;CellTiter 96® AQueous One Solution Cell Proliferation Assay试剂盒购自普洛麦格生物技术有限公司;5×蛋白上样缓冲液购自碧云天生物技术有限公司;RIPA细胞裂解液、SuperSignal West Pico化学发光底物购自Thermo Fisher公司;硝酸纤维素膜(NC膜)购自Whatman公司;DMSO、脱脂奶粉购自 Sigma-Aldrich 公司;QIAamp® Viral RNA 提取试剂盒购自Qiagen公司;RT-PCR反转录试剂盒及SYBR Premix Ex Taq™购自TaKaRa Bio公司;Salinomycin购自Selleckchem公司;P-GSK-3α/β(Tyr216/279)抗体、β-catenin抗体购自Abcam公司;P-GSK-3α/β(Ser21/9)抗体购自Cell Signaling Technology公司;PEDV N蛋白单克隆抗体由本实验室保存。
1.3 PEDV感染Marc-145细胞培养于6孔细胞培养板中,待细胞长满至单层后弃掉培养液,用磷酸盐缓冲液(PBS,pH 7.2)漂洗细胞3次,吸净残余液体,加入1 MOI的 JS-2013 PEDV病毒液1 mL(含有一定浓度胰酶),以不接种病毒的细胞作为对照,在37℃细胞培养箱中孵育1 h(30 min左右时将细胞培养板晃匀1次)。用PBS漂洗细胞2次,吸净残余液体,加入含有胰酶的无血清的DMEM培养基2 mL,放入37℃细胞培养箱中继续培养。
1.4 抑制剂毒性检测使用CellTiter 96® AQueous One Solution Cell Proliferation Assay分别检测抑制剂CHIR-99021、Salinomycin对Marc-145细胞的毒性。将Marc-145细胞铺至96孔板,当细胞长满至单层后弃掉培养基,用PBS 洗涤2遍,每孔加入已用DMEM稀释成不同浓度的抑制剂100 μL;同时以含有细胞、不加抑制剂的孔为细胞对照,并设置含有培养基但没有细胞、不加抑制剂的孔为空白对照。每个样品设置8个重复。将细胞培养板放入37℃、5%CO2细胞培养箱中,培养至所需时间,每孔加入20 μL的CellTiter 96® AQueous One Solution试剂,培养箱中孵育1~4 h。酶标仪测定OD490值,根据如下公式计算细胞活力:
细胞活力=(抑制剂处理组OD490值-空白对照组OD490值)/(细胞对照组OD490值-空白对照组OD490值)×100%
1.5 细胞抑制试验用PBS漂洗Marc-145细胞2遍,加入CHIR-99021或Salinomycin的DMEM培养基,放入37℃、5%CO2细胞培养箱内孵育1 h,用PEDV感染Marc-145细胞(具体方法见1.3),感染过程中加入同剂量的抑制剂。1 h后弃去病毒液,用PBS洗涤细胞2次后加入新鲜无血清培养基(含抑制剂及胰酶),同时用含相同浓度DMSO的无血清培养基作为阴性对照,培养至所需时间后分别收取细胞及上清。
1.6 实时荧光定量分析不同时间点收集细胞培养基上清,提取病毒RNA,具体操作步骤参考QIAamp®Viral RNA Mini Kit说明书进行。用核酸蛋白浓度测定仪检测所提RNA浓度。参照RT-PCR反转录试剂盒说明书,取1 μg RNA为模板反转录合成cDNA。以反转录后所得到的cDNA为模板,按照SYBR Premix Ex Taq™试剂盒配置荧光定量检测体系,使用ABI 7500实时荧光定量仪进行real-time PCR反应,每组试验做3个重复。采用Comparative delta-delta Ct法计算不同基因的mRNA表达量差异。
1.7 Western blot检测将Marc-145细胞培养于6孔细胞培养板中,接种PEDV(参照1.3)。弃去细胞上清,用预冷的PBS洗涤细胞2次,加入提前配置好的含有蛋白酶抑制剂的RIPA细胞裂解液,冰上静置5~10 min;用细胞刮将细胞从细胞培养板中刮下,收集到1.5 mL离心管中,用BCA Protein Assay Kit测定蛋白浓度;加入5×蛋白上样缓冲液,在沸水中煮样10 min使蛋白变性,保存于-20℃。根据TaKaRa Bio公司产品说明书配置10% 的SDS-PAGE凝胶,上样时加入20 μg的总蛋白进行凝胶电泳,待凝胶电泳结束后采用半干转的方法,恒定电压15 V,1 h将蛋白转印至NC膜上。转膜完成后将NC膜放入5% 脱脂乳(脱脂奶粉溶解于TBST缓冲液)中室温封闭1 h;用TBST缓冲液洗涤1次,加入一抗室温孵育1 h;TBST 缓冲液漂洗3次,每次10 min,再加入HRP标记的二抗室温孵育1 h;TBST 缓冲液漂洗3次,每次10 min,避光加入SuperSignal West Pico化学发光底物5 min后在暗室中进行曝光显影,显影后将胶片晾干扫描并保存。
1.8 TCID50测定 将Vero细胞培养于96孔板中,待细胞长满后,用PBS洗涤3次,每孔加入10倍梯度稀释的病毒液100 μL(每个梯度8孔重复),置于37℃培养箱中继续培养,24 h后补含有胰酶的无血清培养基100 μL。观察并记录阳性孔数,直至出现细胞病变的孔数不再增加为止。根据Reed-Muench算法计算半数组织感染量(median tissue culture infective dose,TCID50)。
2 结果
2.1 抑制剂对细胞活性的影响为确定抑制剂的适宜浓度,采用CellTiter 96® AQueous One Solution试剂盒分别检测2种不同抑制剂处理后Marc-145细胞的活性。使用的GSK-3特异性抑制剂CHIR-99021的终浓度分别为:0、5、10 μmol/L;Wnt经典通路的特异性抑制剂Salinomycin的终浓度分别为:0、1、5、10 μmol/L。如图1所示,随着抑制剂浓度的升高,对细胞的毒性越来越大,抑制剂CHIR-99021终浓度为5 μmol/L时细胞活力为0.91,而终浓度为10 μmol/L时为0.81;Salinomycin的终浓度为1 μmol/L时细胞活力为0.98,5 μmol/L时为0.92,而10 μmol/L时细胞活力为0.85。我们最终选取CHIR-99021终浓度为5 μmol/L,Salinomycin终浓度为1 μmol/L进行后续试验。
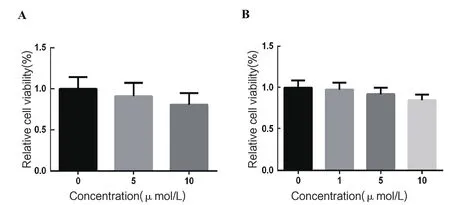
图1 抑制剂CHIR-99021(A)和Salinomycin(B)对Marc-145细胞活性的影响Fig. 1 The effection of inhibitors CHIR-99021(A) and Salinomycin(B) on the cell viability of Marc-145 cells
2.2 GSK-3活性抑制后能够抑制PEDV的增殖用5 μmol/L GSK-3特异性抑制剂CHIR-99021处理1 h后感染1 MOI的PEDV,观察PEDV在Marc-145细胞内的增殖情况。利用Western blot检测细胞内的病毒含量发现,加入CHIR-99021抑制GSK-3活性后,细胞内的病毒含量比不加抑制剂样品中病毒含量低(图2A)。这一结果与real-time PCR检测细胞上清内的病毒含量结果相一致(图2B)。分别检测12、16 h时的病毒TCID50的变化也与上述结果相一致(图2C)。结果表明,GSK-3活性降低后能够抑制PEDV的复制。
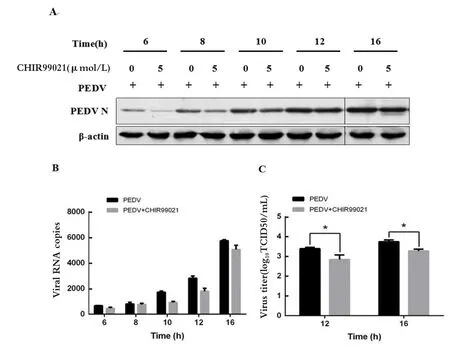
图2 GSK-3活性抑制后能够抑制PEDV在Marc-145细胞中的增殖Fig.2 Inhibition of PEDV replication in Marc-145 cells through inhibition of GSK-3 activity
2.3 病毒感染及GSK-3活性抑制后相关蛋白水平变化情况PEDV感染Marc-145细胞后,GSK-3-α/β在Ser21/9位点磷酸化水平增加,β-catenin含量增加,表明GSK-3活性降低,在12 h不明显,16 h明显(图3)。用终浓度5 μmol/L的抑制剂CHIR-99021在Marc-145细胞上抑制GSK-3活性1 h后感染PEDV,检测结果显示,用抑制剂CHIR-99021抑制GSK-3的活性后,GSK-3-α/β在Tyr279/216位点磷酸化水平明显降低,而在Ser21/9位点磷酸化水平变化不明显,β-catenin的蛋白含量增加,且PEDV的含量降低(图3)。研究结果表明,在Marc-145细胞上抑制GSK-3的活性后,β-catenin含量增加。
2.4 抑制Wnt/β-catenin通路后对PEDV复制的影响β-catenin是Wnt经典通路中重要的转录调节因子,用特异性抑制剂Salinomycin 抑制Wnt/β-catenin通路1 h后接种PEDV,16 h后收取上清及细胞样品。Western blot检测细胞内的病毒含量发现,加入Salinomycin 后,β-catenin含量降低,细胞内的病毒含量比不加抑制剂样品中病毒含量低(图4A)。这一结果与real-time PCR及TCID50检测细胞上清中病毒含量的结果相一致(图4B、4C)。
3 讨论
近年来,变异型PEDV传播速度快,范围广,各年龄段猪均易感,对小猪的影响尤其严重,7日龄仔猪感染后的死亡率达到100%,给世界各国的养猪业均造成了严重的经济损失。进一步探究PEDV与宿主之间的相互关系,可以更深入了解PEDV的致病机制。GSK-3是广泛存在于真核细胞内的蛋白激酶,除了具有调节细胞内糖代谢,细胞运动、凋亡,细胞分化、增殖和胚胎发育等生物学功能外,同时在病毒复制过程中也发挥着重要的调节作用。Khan等[7]研究发现,用仙台病毒感染成纤维细胞后,细胞内GSK-3被激活,进而调节下游分子β-catenin 在S33/S37/T41位点发生磷酸化,从而激活IRF3调节基因的表达,在抗病毒天然免疫中发挥重要作用。Lei等[8]研究表明,GSK-3β能够促进TBK1发生二聚化或低聚化及Ser172位点的自磷酸化,进而激活转录因子IRF3,诱导IFN-β的产生,发挥抗病毒效应。GSK-3在调节冠状病毒N蛋白磷酸化方面也发挥重要作用。Wu等[9]研究发现,用抑制剂抑制GSK-3磷酸化后,可降低严重急性呼吸综合征病毒(Severe acute respiratory syndrome coronavirus,SCoV)N蛋白的磷酸化,进而抑制病毒在Vero E6 细胞上的复制。
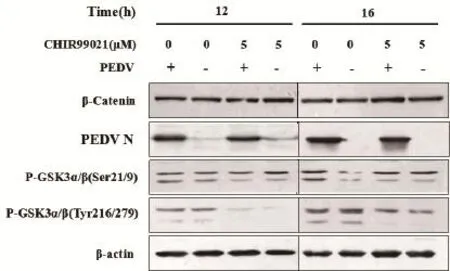
图3 PEDV感染Marc-145细胞及抑制GSK-3活性后GSK-3磷酸化及β-catenin的变化情况Fig. 3 The variation of phosphorylation of GSK-3 and β-catenin after PEDV infection and treated with CHIR-99021 in Marc-145 cells

图4 抑制β-catenin可促进PEDV在Marc-145细胞上的增殖Fig.4 Promotion of PEDV replication in Marc-145 cells through inhibition of β-catenin
β-catenin是GSK-3信号通路下游的一个重要转录调节因子。Lu等[10]2011年研究发现Salinomycin能够通过阻断Wnt辅助性受体LRP6(lipoprotein receptor related protein 6)的磷酸化,促使LRP6蛋白降解从而阻断Wnt信号通路的转导,抑制下游LEF1、cyclin D1、fibronectin等基因的表达,诱导CLL细胞(chronic lymphocytic leukemia cells)的凋亡。此外,许多研究发现,病毒在感染宿主细胞后能激活Wnt/β-catenin信号通路,使β-catenin的含量增加,从而对病毒的复制增殖过程产生影响。Zhu等[11]研究发现,用小分子抑制剂(ICRT 14)抑制 β-catenin的含量后,可显著降低牛疱疹I型病毒(Bovine herpesvirus type 1,BoHV-1)在产毒期的病毒水平,表明 β-catenin能够促进BoHV-1在非神经元细胞上的复制。Harmon等[12]研究发现,Wnt信号通路激活后能够促进裂谷热病毒(Rift valley fever virus, RVFV)在细胞上的复制。而在甲型流感病毒感染肺泡上皮细胞后,β-catenin能够通过增强病毒依赖IFNB1基因和干扰素刺激基因的表达,抑制甲型流感病毒在肺泡上皮细胞上的复制,从而抑制病毒复制;同时流感病毒RNA通过调控细胞内的RIG-I/NF-κB信号通路来抑制β-catenin依赖的转录,抵消β-catenin的抗病毒效果[13]。Hao等[14]的研究结果表明,LiCl 能够通过激活Wnt/β-catenin通路和抑制促炎症反应,抑制猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)在Marc-145 和PAM-CD163 细胞上的复制。
为探究GSK-3能否对PEDV的复制过程产生影响,本研究在Marc-145细胞上感染PEDV,采用Western blot方法检测相关蛋白水平的变化。检测结果显示,PEDV感染Marc-145细胞后,GSK-3α/β(Ser21/9)磷酸化蛋白水平增加,同时,β-catenin含量增加,表明GSK-3的活性受到抑制。通过在Marc-145细胞上抑制GSK-3的活性后感染PEDV,研究发现,GSK-3活性被抑制后,β-catenin含量的增加抑制了PEDV的增殖。β-catenin是GSK-3的底物之一,同时是Wnt经典通路中重要的转录调控因子,它在病毒的复制增殖过程中也发挥重要的调节作用。为探究GSK-3是否通过调控下游β-catenin的变化影响PEDV的增殖,试验进一步在Marc-145细胞上抑制Wnt/β-catenin通路后感染PEDV。检测结果表明,β-catenin含量降低后促进了PEDV的增殖。上述结果表明,PEDV感染Marc-145细胞后,细胞内GSK-3的活性降低,β-catenin的表达量增加能够抑制PEDV的增殖。本研究结果为后期深入探索PEDV的致病机制与宿主的抗病毒反应提供了一定理论基础。
