非洲猪瘟病毒DP96R蛋白的原核表达及多克隆抗体的制备
2018-11-23王西西吴映彤陈鸿军郭晓宇朱鸿飞
王西西,吴映彤,吴 竞,2,陈鸿军,郭晓宇,朱鸿飞
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.比利时列日大学让布鲁农学院,列日 4000;3. 中国农业科学院上海兽医研究所,上海 200241)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染引起的一种急性、烈性、高度接触性的传染病,可导致不同品种、不同年龄段家猪的高致死性出血性疾病[1],是世界动物卫生组织(Office international des épizooties,OIE)法定报告的烈性传染病之一。与家猪不同,非洲疣猪(warthogs)或丛林猪(bushpigs)感染ASFV后通常无症状,病毒血症滴度低,可造成持续感染[2]。ASFV是唯一已知的虫媒DNA病毒,可通过节肢动物尤其是乳突钝缘蜱传播[2-3],持续感染的野猪和软蜱是家猪感染ASF的重要传染源[4]。
1921年,肯尼亚首次报道发现ASF[5],随后该病在非洲大陆广泛传播,现主要在撒哈拉以南的非洲国家流行。1957年ASFV从非洲传入欧洲南部国家并迅速蔓延,葡萄牙、西班牙、意大利等国家采取了扑杀和严格防控等综合措施将其扑灭(撒丁岛除外)[6]。ASF于2007年传入高加索地区以及俄罗斯等国家,并于2014年传入欧盟的东部国家地区[7-8]。2018年8月3号,中国动物卫生与流行病学中心诊断首次报道我国出现非洲猪瘟病例,确诊沈阳市沈北新区发生非洲猪瘟疫情,疫点内913头生猪被扑杀和无害化处理[9]。
ASFV是在细胞质内复制的双股大DNA病毒,为非洲病毒科、非洲病毒属的唯一成员[10-11]。ASFV基因组长度约为170~190 kb,表达150多个开放阅读框,编码150~200种蛋白[10]。ASFV基因组结构主要包含约125 kb的中央保守区、38~47 kb的左侧可变区和13~16 kb的右侧可变区[12]。ASFV Georgia 2007/1分离株(ASFV-G)属于基因II型,基因组大小189 344 bp,表达166个开放阅读框[13]。UK(DP96R)基因位于右侧可变区,在不同病毒毒株基因组中序列高度保守,属于病毒毒力基因,是导致家猪发病重要因素之一[14]。已有研究表明,ASFV E70 毒株缺失UK基因后,病毒毒力减弱;ASFV-G毒株双缺失9GL和UK基因后,可导致病毒毒力下降,免疫基因缺失毒株2周后即可提供部分针对母本强毒株病毒的免疫保护力[14-15]。DP96R蛋白是ASFV早期表达蛋白,在病毒感染巨噬细胞后2 h即可以检测到DP96R蛋白的表达[14]。本研究通过合成ASFV UK基因,构建重组原核表达质粒并进行原核表达,对重组蛋白进行纯化及其多克隆抗体的制备,为后续DP96R蛋白的血清学诊断技术及其生物学功能研究奠定基础。
1 材料和方法
1.1 细胞、质粒和实验动物pET-28a、pEGFP-N1、pEGFP-N1-UK(UK基因序列已进行密码子优化)及 HEK293T细胞均由北京畜牧兽医研究所兽医公共卫生创新与管理团队保存;根据ASFV Georgia 2007/1 的UK(DP96R)(GenBank登录号:FR682468.1)基因序列,由南京金斯瑞生物有限公司合成UK基因并克隆入载体pUC57-simple;1.6~1.8 kg普通级新西兰大白兔购自北京维通利华实验动物技术有限公司。
1.2 主要试剂DMEM、PBS、fetal bovine serum和胰酶购自Gibco公司;BamH I/Xho I限制性内切酶、T4连接酶、2×PrimeSTAR® HS DNA Polymerase、RNA提取试剂盒、反转录试剂盒均购于TaKaRa生物公司;转染试剂Polyplus jet PRIME kit购于达科为公司;弗氏完全佐剂、弗氏不完全佐剂和IPTG购自Sigma公司;EGFP-tag和Anti-rabbit IgG (Alexa Fluor® 594 Conjugate)抗体购自Cell Signaling 公司;His-Tag、HRP-conjugated goat Anti-rabbit和抗体HRP-conjugated goat anti-mouse购自Protech公司;HisTrap FF crude预装柱购自GE公司;SDS-PAGE Gel Kit和超敏ECL化学发光试剂盒购自碧云天生物技术有限公司;DAB显色试剂盒购自TIANGEN公司;其余试剂均为国产分析纯。
1.3 UK基因的合成与重组质粒的构建根据ASFV Georgia 2007/1 株 UK基因序列(GenBank登录号:FR682468.1)合成UK全基因,并连入pUC57-simple载体。利用Primer Premier5.0软件设计扩增引物,UK-F:5'-CGGGATCCATGTCTACACATGATTGT TCTCT-3',UK-R:5'-CCGCTCGAGATTATTCTT CTGGATGGAGCG-3'。上游引物含BamH I酶切位点、下游引物含Xho I酶切位点。引物由金唯智生物科技有限公司合成。
以合成的pUC57-UK质粒为模板,UK-F/UK-R为引物,进行UK基因的扩增。PCR扩增体系50 μL:2×PrimeSTAR® HS DNA Polymerase 25 μL、上下游引物各2 μL、DNA模板50 ng,ddH2O补至50 μL。PCR反应条件:98℃预变性2 min;98℃变性10 s,60℃退火15 s,72℃延伸20 s,共33个循环;72℃延伸5 min。1%琼脂糖凝胶电泳后回收并纯化目的片段。目的片段和pET-28a(+)空载体分别经BamH I/Xho I双酶切,纯化回收相应目的片段,T4连接酶16℃过夜连接。连接产物转化感受态DH5α,并涂布于相应LB平板,37℃倒置培养。菌液PCR鉴定正确后,送至北京金唯智公司测序。测序正确的重组质粒按照小提质粒试剂盒说明书提取质粒,命名为pET-28aUK,-20℃保存。
1.4 DP96R蛋白的表达形式分析将原核表达质粒pET-28a-UK转化大肠杆菌BL21(DE3)感受态细胞,挑取单菌落接种于卡那抗性的LB液体培养基中,37℃、220 r/min培养OD600至0.6~0.8时,加入终浓度为0.4 mmol/L IPTG,分别在37℃培养5 h或在16℃培养10 h后,4℃、12 000×g离心10 min,收集菌体沉淀。沉淀经PBS洗涤后,冰浴条件下进行超声破碎(功率28%,超声3 s,间隔5 s,共破碎60次),12 000×g离心10 min后分别取上清和沉淀,进行SDS-PAGE分析。
1.5 DP96R蛋白纯化与Western blot鉴定将重组pET-28a-UK接种至2 L卡那抗性LB液体培养基中,37℃、220 r/min培养OD600至0.6;加入终浓度为0.4 mmol/L IPTG,16℃诱导10 h;4℃、12 000×g离心10 min,收集菌体,以PBS洗涤沉淀后再次重悬,冰浴条件下进行超声波破碎至溶液澄清。收集上清液经Ni亲和层析预装柱纯化,首先用含30 mmol/L 咪唑的缓冲液洗脱杂质蛋白,然后使用含500 mmol/L咪唑的洗脱缓冲液洗脱目的蛋白。将纯化后的蛋白进行SDS-PAGE、Western blot分析,并进行蛋白定量。
1.6 兔多抗血清的制备与鉴定将400 μg DP96R重组蛋白与等体积的弗氏完全佐剂混匀后,在新西兰大白兔大腿内侧肌肉和背部皮下多点注射进行首免,同时对照组接种等量体积的PBS。首免后2周和4周,分别将DP96R蛋白与等体积的弗氏不完全佐剂混匀后进行加强免疫并采集血清。三免后10 d心脏采血,收集血清。
采用方阵滴定法,将纯化的DP96R蛋白进行倍比稀释后包被酶标板,4℃包被过夜;用PBST洗涤4次,每次2~3 min,以5%脱脂乳粉37℃封闭2 h;PBST洗涤,DP96R蛋白一免、二免、三免后获得的抗血清用5%脱脂乳粉进行倍比稀释,分别加入对应蛋白孔,37℃孵育1 h,同时设阴性对照;PBST洗涤,加入用5%脱脂乳粉稀释的HRP标记二抗(稀释比为1∶4000),37℃孵育1 h;PBST洗涤,每孔加入50 μL TMB显色液,避光显色20 min后加入2 mol/L H2SO4终止反应并检测OD450值。
1.7 Wstern blot及间接免疫荧光检测将pEGFP-N1-UK与pEGFP-N1空载体质粒分别转染293T细胞,24 h后收获细胞,用含1 mmol/L PMSF的细胞裂解液充分裂解细胞,离心取上清,进行SDS-PAGE电泳,然后湿转至硝酸纤维素膜(NC膜)。将NC膜用含5%脱脂乳粉的TBST溶液37℃封闭2 h,分别用含5%BSA的TBST溶液将EGFP标签单抗和抗DP96R蛋白多抗以1:4000稀释后作为一抗,37℃作用1 h,洗涤,孵育相应二抗,洗涤后进行ECL发光显色。
此外,将pEGFP-N1-UK和空载体质粒分别转染96孔293T细胞,24 h后使用4%多聚甲醛室温固定细胞30 min;PBS洗涤3次后,每孔加入200 μL含0.3%Triton 100的1%BSA溶液封闭1 h;PBS洗涤后,将 DP96R蛋白多抗以1:1000稀释后加入对应细胞孔中,4℃过夜孵育;PBS洗涤后,添加相应荧光二抗在37℃避光孵育1 h,洗涤后进行DAPI染色,置于荧光显微镜下观察结果。
2 结果
2.1 UK基因重组质粒的构建PCR扩增产物经1%琼脂糖凝胶电泳,在250~500 bp之间可见单一扩增条带(图1),条带大小与预期相符(UK:291 bp)。将PCR产物进行回收,经双酶切后与载体质粒pET-28a(+)连接并转化DH5Hα,挑取菌落进行菌液PCR鉴定后测序验证,测序正确后将重组质粒分别命名为pET-28a-UK、pEGFP-N1-UK。

图1 ASFV UK基因的PCR扩增Fig. 1 PCR amplication of ASFV-UK gene
2.2 DP96R蛋白的表达形式分析SDS-PAGE结果表明,IPTG浓度为0.4 mmol/L时,在16℃诱导10 h或37℃诱导5 h后,pET-28a-UK样品中均出现1条明显的蛋白条带,大小约15 kDa,与预测的11 kDa相差较大。这种差异可能与串联重复序列的存在而导致的异常凝胶迁移率有关,蛋白以可溶性表达为主,空载体pET-28a对照组及未诱导的pET-28a-UK菌液样品中均未出现对应条带(图2)。
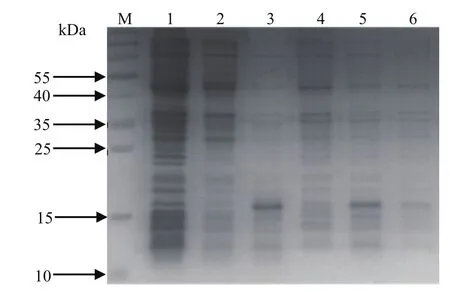
图2 DP96R蛋白 SDS-PAGE分析Fig. 2 SDS-PAGE analysis of DP96R protein
2.3 DP96R蛋白纯化的SDS-PAGE分析及Western blot验证利用HisTrap FF crude预装柱纯化重组DP96R蛋白,SDS-PAGE和Western blot结果表明,纯化后的DP96R蛋白条带较为单一(图3A、3B)。蛋白纯度达到90%以上,BCA法定量蛋白浓度为600 μg/mL,满足后期免疫要求。
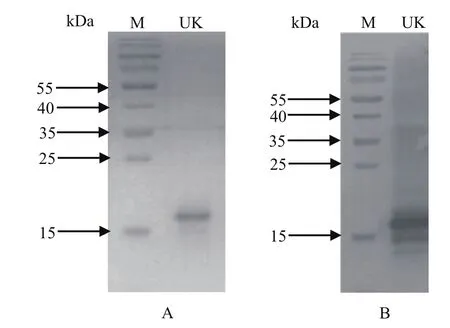
图3 纯化重组蛋白DP96R的SDS-PAGE(A)及Western blot(B)鉴定Fig. 3 SDS-PAGE(A) and Western blot(B) analysis of puri fied DP96R proteins
2.4 DP96R蛋白多克隆抗体的制备与鉴定利用纯化的DP96R重组蛋白免疫新西兰大白兔,分别在14、28、38 d采血,收集血清并进行间接ELISA检测。结果如图4所示,DP96R蛋白首次免疫后2周,抗体水平开始上升,加强免疫后2周抗体水平有显著提高,3次免疫后抗体维持在较高水平,而对照组3次免疫血清抗体检测均为阴性(OD450<0.10)。
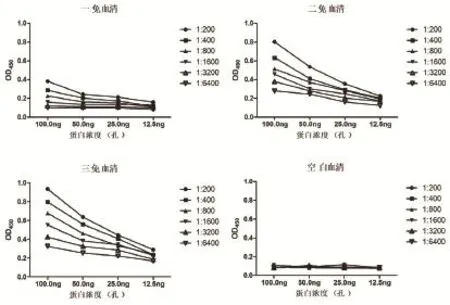
图4 抗DP96R蛋白多克隆抗体的制备与鉴定Fig. 4 Preparation and identi fication of anti-DP96R protein polyclonal antibodies
2.5 DP96R蛋白多克隆抗体特异性分析与鉴定为验证多克隆抗体的特异性,将pEGFP-N1-UK质粒和pEGFP-N1空载体分别转染293T细胞,进行免疫荧光检测(immunofluorescence assay,IFA)和Western blot分析。IFA结果显示,DP96R蛋白多克隆抗体可特异性识别293T细胞中表达的DP96R蛋白,而与空白对照没有反应(图5)。DP96R蛋白多抗与EGFP抗体均可识别蛋白分子量大小约为40 kDa的特异性蛋白条带(图6)。结果表明制备的抗DP96R蛋白的多克隆抗体具较好的反应性和特异性。
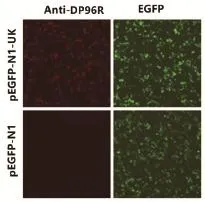
图5 DP96R蛋白免疫荧光检测Fig. 5 Immuno fl uorescence assay analysis of DP96R protein
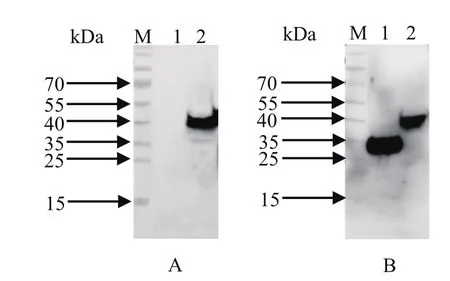
图6 DP96R 蛋白的Western blot检测Fig. 6 Western blot analysis of DP96R protein
3 讨论
ASF为OIE法定报告的烈性传染病之一,给全球养殖业造成巨大的经济损失。我国将其列为动物一类传染病,至今仍无有效的商品化疫苗问世。现有ASF的防控方法主要包括流行病学监测、划定疫区以及扑杀受感染动物等[16-17]。目前,在ASF的疫苗研究中,缺失活病毒疫苗是研究的重点[18-20]。UK基因是ASFV的毒力基因之一,UK基因位于基因组右侧毒力相关基因NL-S的上游。已有研究表明,UK基因对ASFV在体外巨噬细胞内的增殖是非必需基因,但却是影响病毒毒力和对家猪致病力的重要因素之一[14]。ASFV E70缺失UK基因,ASFV Georgia 2007毒株同时缺失9GL和UK基因后,病毒毒力均明显下降,且免疫后能提供一定的保护力[15]。
对欧洲、非洲等来源的ASFV毒株UK基因进行序列比对,发现UK基因表达的DP96R蛋白氨基酸序列高度保守,遗传数据库未发现与UK基因具有显著相似性的其他已知基因。ASFV Georgia 2007毒株中UK基因开放阅读框共有291 bp,表达96个氨基酸,其中包含4个连续重复序列,每个序列包含10个氨基酸(EKXXXXXXXX)[14],这些串联重复序列的存在导致异常凝胶迁移率,因此重组原核DP96R蛋白的分子量在15 kDa左右。
本研究针对ASFV Georgia 2007/1的UK基因,构建了含有His标签的重组原核表达质粒。在原核表达系统中,低温诱导时,DP96R蛋白主要呈可溶性表达,经纯化获得纯度>90%的重组蛋白。Western blot和ELISA结果表明DP96R蛋白具有较好的反应原性,制备的多抗可用于Western blot检测和IFA检测,为进一步研究蛋白的生物学功能以及建立ASFV UK基因缺失毒株鉴别诊断方法奠定了基础。
