拉莫三嗪对酸敏感离子通道1a的调控作用☆
2018-11-07李雯魏东
李雯 魏东
近年来研究发现ASIC1a在癫痫的发生及发展中起到了一定的作用,并且发现细胞内、外的酸化能够抑制癫痫活动,提示ASIC1a可能是抗癫痫治疗的靶点之一[1-4]。目前临床上应用的很多药物都对ASIC1a具有调控作用[5-7]。门控离子通道作为最为关键的抗癫痫药物的作用靶点,因其能够直接影响神经元最终的电活动,而后者是神经系统生理和病理过程的基础[8]。那么,拉莫三嗪(lamotrigine,LTG)作为电压敏感性钠离子通道的阻滞剂,是否能通过对ASIC1a的调节而发挥抗癫痫作用尚无研究报道。为此,我们采用全细胞记录膜片钳及免疫印迹方法检测LTG对ASIC1a同聚体通道介导的内向电流及其蛋白表达的影响,来探讨ASIC1a是否是拉莫三嗪抗癫痫治疗的作用靶点。
1 材料与方法
1.1 细胞系的培养及传代CHO细胞培养(上海交大医学院徐天乐老师惠赠)在37℃恒温湿润的5%CO2细胞培养箱内,采用F12培养基加入1 mM L型谷氨酰胺、50 μg/mL的链霉素、50 U/mL的青霉素和10%的胎牛血清,根据细胞生长情况,每2~3 d半量更换细胞培养基。无菌情况下传代,先吸弃原有培养基,PBS洗3遍后加入0.125%的胰蛋白酶消化2~3 min,然后加入含血清的F12培养基(美国GIBCO公司)终止消化,将贴壁细胞轻柔吹打脱落,吹散后以1000转/min离心5 min,弃上清后再加入适量培养基,充分吹打重悬,计数后进行接种备用(1×105细胞/35 mm 培养皿,5×105细胞/60 mm培养皿)。
1.2 大鼠皮层神经元原代培养经空军军医大学(原第四军医大学)动物伦理委员会批准,将怀孕16~17 d的雌性SD大鼠(空军军医大学动物中心)进行乙醚气体麻醉后,无菌情况下操作,剪开腹壁暴露子宫,取6~8个胚胎置于玻璃皿中,所有操作尽可能减少实验动物痛苦。从子宫中剖取胎鼠后夹取头部置于预冷过的解剖液(含50 μg/mL链霉素和50 U/mL青霉素的高糖DMEM溶液)中,体视镜下在冰上剖取大脑,留取软脑膜及大脑皮层。将其剪碎后转移至离心管中并加入0.05%胰蛋白酶于37℃恒温细胞培养箱中消化约5 min,加入接种培养基 (含1 mM L型谷氨酰胺、10%的胎牛血清及10%的F12培养液的高糖DMEM溶液)终止消化,充分吹打后过滤、离心(1000 转/min,5 min),弃上清后加入适量接种培养基充分吹打重悬,计数后进行接种 (1×105细胞/35 mm 培养皿,5×105细胞/60 mm培养皿),如果接种于玻片上,则所用玻片提前一天包被多聚赖氨酸。次日更换半量维持培养基(含2%的B27及1 mM L型谷氨酰胺的Neural basal培养液),以后根据细胞生长情况约2~3 d半量更换培养基。
1.3 细胞转染培养的CHO细胞融合至70%~80%时, 分别转染了 ASIC1a、ASIC2a、ASIC1a+ASIC2a和ASIC3质粒(上海交大医学院徐天乐老师惠赠),得到 ASIC1a同聚体、ASIC2a同聚体、ASIC1a/ASIC2a异聚体和ASIC3同聚体通道,实验方案根据HilyMax liposome transfection reagent(日本 Dojindo Laboratiories公司)所提供的操作方法进行。在无菌情况下操作,每个60 mm培养皿加入约7~9 μg质粒,每个35 mm培养皿加入约3~4 μg质粒,转染4 h后吸弃含脂质体的培养基,PBS洗1次后更换为维持培养基,转染后的24~48 h内进行蛋白质提取以及电生理实验。当进行两种不同的质粒共转染时,采用相同的质粒量进行配比混合。
1.4 电生理记录本实验电生理采用电压钳条件下的全细胞记录模式。配置电极内液及细胞外液的玻璃微电极采用 2步垂直拉制方法,使其入水电阻约为3.5~5.5 MΩ。灌流给药采用“Y”管系统依靠重力实现[9]。实验时首先给予玻璃电极内施加正压,通过步进式微操仪将玻璃电极尖端轻压在细胞表面,撤除正压,使细胞膜吸附于电极尖端,给予串联电阻的自动补偿,逐渐给予负压吸引,施加-60 mV钳制电压,待形成超过GΩ级别的巨阻抗后用负压将细胞膜吸破,使细胞内液与电极内液互通而形成全细胞记录。所记录信号通过放大器采集后通过数模转换器输入计算机,使用pCLAMP 9.0软件进行数据采集、设置调整,使用Clampex 9.0进行数据分析。
1.5 免疫印迹
1.5.1 药物准备 将拉莫三嗪预先用细胞培养液配置成 10 μM、30 μM 和 100 μM 三种浓度,并以不含药物的细胞培养液为阴性对照。
1.5.2 样本制备 将神经元接种于60 mm培养皿中,待培养6~7 d细胞铺满培养皿80%底面积后,给于不同浓度拉莫三嗪及阴性对照细胞培养液孵育24 h,吸弃培养基,使用4℃的PBS清洗3遍(冰上操作),尽量将残留的PBS吸净,加入RIPA裂解液,冰上刮取细胞后进行冰上裂解15 min,收集裂解液置入EP管中,进行4℃低温离心(13000转/min)20 min,收集上清,加入 SDS 上样缓冲液,金属浴(95℃)煮沸 5 min,置于-80℃保存。
1.5.3 电泳、转模及免疫显色检测 首先制备SDS PAGE胶进行电泳,结束后用半干转膜法将蛋白样品从分离胶中转移至PVDF膜上,将PVDF膜在20%脱脂奶粉PBST溶液中室温封闭1 h,然后加入抗体稀释液配制的一抗,4℃条件下旋转孵育过夜,加入稀释配制的二抗,室温下孵育2 h,最后在暗室中进行ECL显色,使用X光胶片显影,胶片扫描后使用Image Pro Plus 6.1软件进行图像分析和数据采集。
1.6 统计学方法用SPSS21.0进行统计,结果用平均值±标准误(mean±SEM)表示,最终结果采用 t检验或单因素方差分析(One-way ANOVA)统计学进行分析方法,设定当P<0.05时为存在统计学显著性差异。检验水准α=0.05。
2 结果
2.1 LTG对不同ASIC亚单位的调控作用根据神经系统ASICs的表达模式,我们在CHO细胞系上分别转染了 ASIC1a、ASIC2a、ASIC1a+ASIC2a和ASIC3质粒,得到ASIC1a同聚体、ASIC2a同聚体、ASIC1a/ASIC2a异聚体和 ASIC3同聚体通道。分别对这4种组合进行电生理记录并给予LTG(100 μM)(见图 1), 发现不同亚单位组成的离子通道其所通透的内向电流曲线对LTG的反应不同,LTG仅对ASIC1a亚单位组成的同聚体通道有抑制性调控作用,而对另外三种通道均无明显的影响。

图1 拉莫三嗪对不同ASICs通道内向电流的调控作用。A显示了CHO细胞上表达的不同亚单位组成的离子通道,其所通透的内向电流曲线对LTG(100μM)的反应不同,B中的统计结果提示LTG仅对ASIC1a亚单位组成的同聚体通道有抑制性调控作用。n>6,NS表示无统计学差异,*表示与给药前相比P<0.05
2.2 LTG对ASIC1a同聚体通道调节作用我们进一步检测了LTG对ASIC1a同聚体通道调节作用的具体模式。当给于不同浓度的LTG时,可见这种抑制效应呈现剂量依赖的特性,随着浓度的增大,抑制的强度也逐渐增大,最大可有近45%的抑制效应,其半数有效剂量约为44.5 μM (图2A)。考虑到体内环境酸碱度很难达到pH 6.0的水平,又给予了pH 6.8的酸来进行了实验,发现LTG仍然能够产生抑制效应,只是这种效应有了一定程度的减弱,100 μM的LTG能够抑制20%左右pH 6.8诱导的峰电流强度,而能抑制40%左右pH 6.0诱导的峰电流强电流(图2B)。随后我们采取了四种不同的LTG给药方式:短时间预给10 s、短时间预给10 s联合与酸共给、仅与酸联合共给和长时间预给10 min,发现必须在与酸共给的情况下才具有抑制效应,而两种仅预给的方式都不能产生抑制效应,这就提示LTG的作用具有通道状态依赖的特性,只有通道被打开后才能发挥作用(图 2C、D)。
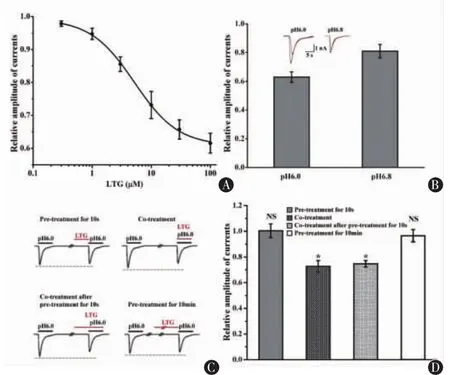
图2 拉莫三嗪对ASIC1a同聚体通道内向电流的调控作用。n>6,NS表示无统计学差异,*表示与给药前相比P<0.05
2.3 LTG对ASIC1a蛋白的表达作用为了明确LTG对ASIC1a除了直接调控其功能外是否还改变其蛋白表达的水平,我们给于原代培养的神经元不同浓度的LTG作用24 h,然后提取蛋白样品进行western blot检测,发现LTG并不影响ASIC1a的蛋白表达(图3)。
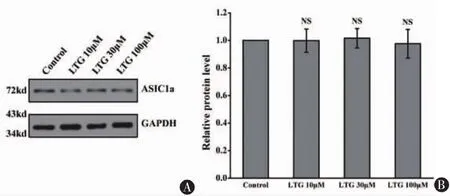
图3 拉莫三嗪对ASIC1a的蛋白表达的影响。A显示了不同浓度拉莫三嗪作用24 h后神经元上ASIC1a蛋白的表达,B显示拉莫三嗪并不改变神经元上ASIC1a的蛋白表达。n=4,NS表示无统计学差异
3 讨论
ASIC1a因其在中枢神经系统中广泛表达,激活阈值较低,并且能通透钙离子而受到研究者的重视[10]。众多的研究表明ASIC1a参与了诸如缺血损伤、癫痫发作、神经痛的中枢敏化、多发性硬化等疾病的病理机制[11-15],目前发现临床上应用的很多药物都对ASIC1a具有调控作用[16-18]。拉莫三嗪作为电压敏感性钠离子通道的阻滞剂,在抗癫痫治疗的过程中是否也能通过对ASIC1a的功能的调节而发挥作用尚无研究报道。本实验中给予CHO细胞转染分别转染了 ASIC1a、ASIC2a、ASIC1a+ASIC2a和ASIC3质粒,得到ASIC1a同聚体、ASIC2a同聚体、ASIC1a/ASIC2a异聚体和ASIC3同聚体通道,在通过全细胞记录膜片钳技术研究发现LTG对ASIC1a同聚体通道产生的内向电流与另外三种通道相比抑制作用显著增加(P<0.05),这种抑制效应与胞外氢离子浓度相关呈剂量依赖性,PH值越低抑制的强度越大;并且必须与酸共给的情况下才能对ASIC1a发挥抑制效应;给予原代培养的神经元不同浓度的LTG作用24 h,然后提取蛋白样品进行western blot检测,发现LTG并不影响ASIC1a的蛋白表达(P>0.05)。说明LTG对ASIC1a同聚体通道产生的内向电流具有直接抑制作用,这可能是其治疗癫痫发作的作用机制之一。
既往研究发现当大脑皮层和海马神经元中asic1基因被敲除后,原来酸所激活的电流几乎被全部去除[19-21],提示ASIC1a是中枢系统神经元中主要的功能性亚单位,进一步的表明这些神经元中的酸激活电流绝大部分是由ASIC1a同聚体和ASIC1a/ASIC2a异聚体通道所介导的。其中ASIC1a决定了电流幅度的大小,而ASIC2a则主要在脱敏、脱敏的恢复以及通道的pH敏感性方面起作用,而对电流幅度的影响不大[20]。本研究结果表明,LTG仅仅对ASIC1a同聚体通道产生的内向电流具有抑制效应,而对另外三种通道均无明显的影响,并且这种抑制效应呈现剂量依赖的特性,随着浓度的增大,抑制的强度也逐渐增大,这些结论与前期的研究结果具有一致性,说明在ASICs家族中ASIC1a同聚体在癫痫的治疗中可能发挥了重要作用。
早在1929年LENNOX就发现高碳酸血症所致酸化能够终止癫痫病人的发作[23],这一发现在后来的研究中也得到了验证[24]。XIONG等[1-2]研究发现急性的细胞外和细胞内酸化都能够抑制癫痫活动,那这就提示ASICs可能在癫痫发作终止的控制上起作用。我们通过发现LTG对ASIC1a同聚体通道产生的内向电流具有抑制,提示 ASIC1a可能是癫痫治疗的药物靶点,与之前的实验结果仍然具有一致性。 然而在匹罗卡品诱导的颞叶癫痫大鼠海马中,ASIC2b和ASIC1a的mRNA的表达水平下降[3]。这提示ASICs可能参与了癫痫发作和癫痫发生。ZIEMANN等[4]的研究发现酸化反应通过激活ASIC1a同聚体通道参与了癫痫发作的终止机制,这种机制可能是由于海马中间神经元上ASICs的电流要强于兴奋性神经细胞而产生的,这得到了WENG等[25]所做的另外一项研究的支持。这种看似矛盾的现象可能是由于不同研究所采用的动物模型以及观察的指标不同所导致,并且临床上大量的患者都是慢性癫痫患者,那么急性动物模型所得到结论就不能推广至慢性癫痫发生的病理过程之中。因此我们还不能准确的得出ASIC1a在慢性癫痫发生过程中所扮演的角色,需要进一步的针对慢性癫痫发生的实验研究来明确ASIC1a的真正功能,接下来我们也将在后续的实验中进行更深入的探索。
