石蒜碱及其衍生物的药理作用研究进展
2018-10-26果婷婷王辉强李玉环于莲
果婷婷,王辉强,李玉环,于莲
石蒜碱及其衍生物的药理作用研究进展
果婷婷,王辉强,李玉环,于莲
154007 黑龙江,佳木斯大学药学院药学系(果婷婷、于莲);100050 北京,中国医学科学院北京协和医学院医药生物技术研究所病毒室(王辉强、李玉环)
石蒜碱(lycorine)是存在于石蒜科植物石蒜鳞茎内含量较高的异喹啉类生物碱,分子式为 C16H17NO4,相对分子量为 287.313,无色棱柱状晶体,熔点 275 ~ 280 ℃,有右旋光性。近年来国内外报道了很多石蒜碱衍生物(表 1),如盐酸石蒜碱(lycorine hydrochloride)、二氢石蒜碱(dihydrolycorine)、伪石蒜碱(pseudolycorine)等。随着研究的深入,石蒜碱及其衍生物的药理作用研究有了很大进展,本文对此进行综述。
1 抗肿瘤作用
根据文献报道石蒜碱及其衍生物(盐酸石蒜碱、伪石蒜碱、氧化石蒜碱)对白血病(K562、HL-60、L-1210)、膀胱癌(T24)、前列腺癌(PC-3、DU145、LNCa P、22RV1、CRPC)、卵巢癌(Hey1B)、肺癌(A549、H460)、食管癌(Eca-109)、多发性骨髓瘤(KM3、ARH-77)、胃癌(hGCC)、肝癌(HCC)、肾癌(786-0)等恶性肿瘤均有不同程度的抑制作用[1-8],其抗肿瘤机制包括:细胞周期阻滞、诱导细胞凋亡、诱导细胞自噬和抑制肿瘤侵袭转移等。
1.1 细胞周期阻滞
细胞周期蛋白(cyclins)和细胞周期蛋白依赖性激酶(CDK)是调节细胞周期最为重要的两类分子,可以调节细胞的增殖。p21 蛋白是CDK 抑制剂家族中的重要成员,通过抑制CDK 复合物的活性来调节细胞周期,从而抑制肿瘤细胞的增殖。盐酸石蒜碱通过下调 cyclin D3,上调 p21 和CDK6,使 Hey1B 细胞周期阻滞在 G2/M 期,通过下调 cyclin D1 使 Eca-109 细胞周期阻滞在 G1 期(图 1)。石蒜碱通过上调 p21,下调 cyclinE-CDK2 或cyclin D1,使 HL-60、PU3和 DU145 细胞周期阻滞在 G2/M 期(图 1)[9]。此外,石蒜碱阻滞KM3、ARH-77 和 K562 细胞周期在 G0/G1 的过程中 p21 表达量上升,下游 cyclin D1 表达量下降,并且在 K562 细胞中cyclinE-CDK2、CDK2 和 CDK4 表达量均下降(图 1)。
1.2 诱导细胞凋亡
细胞凋亡是发生在多细胞生物体内,以维持细胞内环境稳定,由特定基因调控的细胞自主有序的死亡[10-11]。细胞色素 C 建立起来的线粒体凋亡诱导通道(MAC)是细胞凋亡的关键步骤[12-13]。MAC 主要依赖于 Bcl-2 家族蛋白的调控,Bcl-2 家族的成员很多,包括促进细胞凋亡蛋白(Bax 和 Bak 等)、抑制细胞凋亡蛋白(Bcl-2 和 Bcl-xL 等)和直接作用并激活 Bax 或 Bak 的蛋白(Bid 和 Bad 等)[14-15]。研究发现石蒜碱及其衍生物(盐酸石蒜碱)处理不同肿瘤细胞(HL-60、PC-3M、DU145、T24、KM3、A549、Eca-109和 786-0)后,主要通过上调 p53 和 Bax,下调 Bcl-2,诱导 caspase-9、caspase-8、caspase-3 活化,从而诱导细胞凋亡,并且 Bax 与线粒体电压依赖离子通道相互作用并增加其开放,降低了膜电位,导致细胞色素 C 释放(图 2)。此外,石蒜碱可能通过抑制 Survivin 的表达,增加细胞色素 C 的释放而激活线粒体凋亡途径(图 2)。
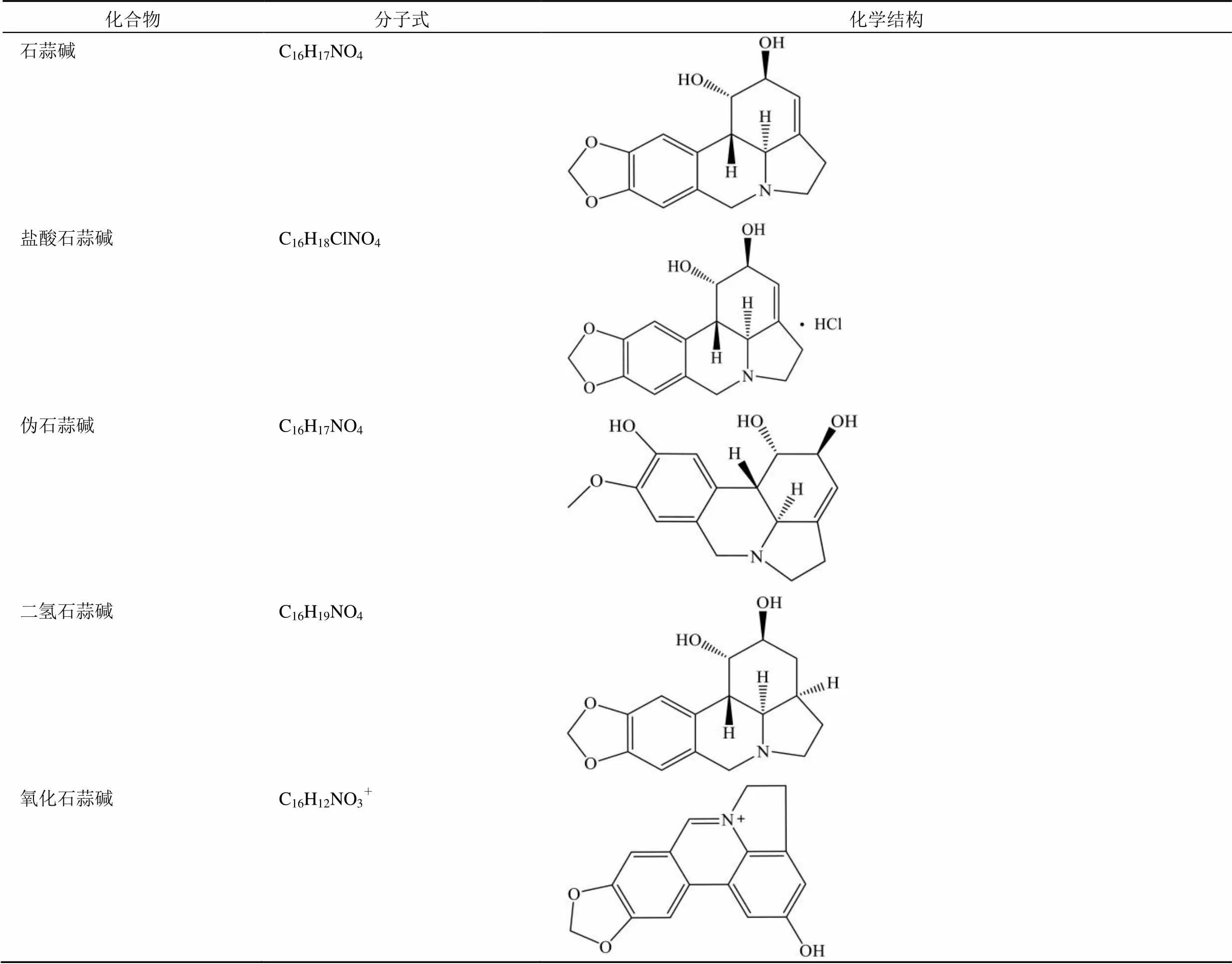
表 1 石蒜碱及其衍生物化学结构

图 1 石蒜碱及盐酸石蒜碱阻滞细胞周期

图 2 石蒜碱诱导细胞凋亡
1.3 诱导细胞自噬
自噬既是细胞的一种正常生理活动,也是细胞遭受各种刺激(缺氧、缺营养、微生物入侵等)时发生的应激反应[16]。自噬具有维持细胞调节和促进细胞生存的作用,但过度活跃的自噬可能引起细胞死亡。高迁移率族蛋白 1(HMGB1)是一种重要的自噬调节因子。HMGB1 的高表达与多发性骨髓瘤预后不良有关,在人骨髓 CD138+原代骨髓瘤细胞和多发性骨髓瘤细胞系中进一步证实了这种相关性。石蒜碱通过对 HMGB1 的蛋白酶降解抑制 MEK/ERK 的激活,从而降低 Bcl-2 的磷酸化,导致 Bcl-2 与 Beclin-1 结合[17]。此外,石蒜碱通过 TCRP1/Akt/mTOR 通路促进肝癌细胞(HCC)凋亡和自噬[18]。
1.4 抑制肿瘤侵袭转移
肿瘤侵袭是恶性肿瘤细胞从其起源部位沿组织间隙向周围正常组织扩张性增生的过程。肿瘤转移是恶性肿瘤细胞从原发部位,经淋巴或血管等途径,到达其他部位继续生长的过程。肿瘤的侵袭和转移两者相辅相成。
NF-κB 信号通路是目前研究较为透彻的细胞信号通路之一,几乎参与了肿瘤发生的所有生理过程(细胞增殖、凋亡、血管生成等),已经成为多种恶性肿瘤治疗和靶点药物研发的热点[19]。石蒜碱抑制 NF-κB 信号通路关键蛋白 P-p65 和 P-IκBα,并且抑制 TNF-α 诱导的p65 核转位。
Akt 和 Erk 1/2 信号通路的过度激活在许多肿瘤的血管形成、生长、侵袭和转移过程中均有参与。盐酸石蒜碱降低磷酸化 Akt 和 Erk l/2 酶活性,从而抑制黑色素瘤细胞主导的毛细样小管及体内肿瘤的血管形成。石蒜碱抑制乳腺癌细胞的迁移和侵袭是通过阻断 Src/FAK 相关信号通路[20]。此外,石蒜碱通过 STAT 3 介导 Twist 减少,而逆转上皮细胞间质化,这是石蒜碱抑制肿瘤转移的新机制。
总之,石蒜碱既可以通过不同的作用机制对一种肿瘤产生抗肿瘤作用,也可以通过一种机制对不同的肿瘤产生抗肿瘤作用。进一步深入地探究石蒜碱的抗肿瘤机制将更加深刻地揭示石蒜碱的抗肿瘤本质。
2 抗病毒作用
根据文献报道,石蒜碱对多种病毒存在很好的体外抑制作用,如 SARS 冠状病毒(SARS-COV)[21]、登革热病毒(DENV)[22]、黄热病毒(YFV)[23]和禽流感病毒 H5N1[24]等,石蒜碱对这些病毒具有很强的体外抑制活性,使西尼罗河病毒(WNV)、YFV 和 DENV 的病毒效价下降 2 ~ 4 个数量级[25]。石蒜碱也对反转录病毒 HIV[26]和日本脑炎病毒[27]等有体外抑制活性,但选择性指数较低。此外,石蒜碱通过干扰病毒 DNA 合成和抑制 DNA 聚合酶活性表现出较好的抗带状疱疹病毒(HSV-1)活性[28],并且通过抑制 TNF-α 的产生抑制脊髓灰质炎病毒(PV)复制[29]。
石蒜碱具有良好的体内外抗肠道病毒 71 型的活性,选择性指数(SI)> 100[30]。体外实验证明,石蒜碱可以明显改善 EV71 感染后小鼠的发病症状,提高小鼠的存活率。体内实验发现,石蒜碱对 EV71 病毒蛋白的 C 端蛋白合成抑制作用比 N 端蛋白的抑制作用更显著,阻断 EV71 病毒蛋白的合成,从而抑制 EV71 的复制。石蒜碱通过抑制Hsc70 在宿主细胞的表达从而抑制丙型肝炎病毒(HCV)的复制[31]。Hsc70 是 Hsp70 家族的成员,是一种含有 646 个氨基酸的细胞质三磷酸腺苷结合蛋白。病毒学研究表明,Hsc70 可能在调控病毒粒衣壳组装中发挥作用。当 Hsc70 下调时,病毒 RNA 的脱衣壳将被抑制,导致复制能力下降。Hsc70 可以被包装进入 HCV 的病毒颗粒中,帮助病毒复制,石蒜碱治疗后可以显著下调 HCV 感染的宿主细胞中 Hsc70 的水平,降低子代 HCV 病毒颗粒中的 Hsc70 水平,并因此在下一次感染周期中抑制 HCV 复制。
伪石蒜碱对于大鼠感染 Rauscher 病毒引起的白血病有较好的疗效,也有抗日本乙型脑炎病毒作用。伪石蒜碱可以降低颅内接种淋巴细胞绒毛脑膜炎病毒及脑心肌炎病毒的小鼠死亡率。
国内外的研究表明石蒜碱及衍生物(伪石蒜碱)具有广谱抗病毒活性,但对其抗病毒机制研究较少,进一步探究其抗病毒机制,对新的机制或靶点的发现及抗病毒药物的研发具有重要意义。
3 抗炎作用
石蒜碱具有消炎、抗感染活性。已有研究表明石蒜碱对家兔甲醛性关节炎及大鼠蛋白性关节炎模型、角叉莱胶所致的大鼠足部水肿模型[32]和内毒素休克模型[33]都有明确的防治作用。
石蒜碱抑制炎症相关诱导酶的合成。研究发现,石蒜碱能够显著降低 LPS诱导的 RAW264.7 细胞内环氧合酶(COX-2)的蛋白水平和一氧化氮合酶(iNOS)的蛋白水平及 mRNA 水平,但不影响 COX-2 的mRNA 水平[34]。石蒜碱抑制炎症发生过程中多种炎症介质的释放。研究发现,石蒜碱抑制被 LPS 激活的巨噬细胞产生 TNF-α[35]、一氧化氮[34]、前列腺素和IL-6[33]。
探究石蒜碱对 LPS 激活的多条信号转导通路的影响发现,石蒜碱特异性地抑制 LPS 诱导的 p38、STAT1 和 STAT3 的活化,但对 STAT1 和 STAT3 的本底蛋白无影响,不影响 JNK、ERK、IκB-α 和 IKK-α 的活化。这表明,石蒜碱抑制 LPS 激活的 MAPK 和 STATs 通路,不影响 NF-κB 信号通路[33]。
综上所述,石蒜碱具有良好的抗炎作用,但目前其抗炎机制研究较少。深入研究石蒜碱抗炎机制,将更好地揭示石蒜碱的抗炎本质。
4 其他作用
石蒜碱具有镇痛、解热、抗疟疾、抑制乙酰胆碱酯酶(AChE)活性以及对已孕或经产家兔和豚鼠子宫有兴奋作用。石蒜碱通过扩张外周血管和抑制心脏对麻醉兔、猫、大鼠及犬均有降压作用。此外,石蒜碱抑制动植物维生素 C 的合成,从而抑制植物的正常生长,是植物生长抑制剂[36]。
二氢石蒜碱具有抗阿米巴痢疾、改善小鼠缺氧所致记忆和学习障碍的作用[37]。此外,二氢石蒜碱通过阻断外周 α、β 受体来保护脑缺血损伤和减弱肾上腺素的升压作用,并且对乳鼠心肌细胞缺氧再给氧损伤和异丙肾上腺素所致小鼠心肌缺血具有保护作用[38-39]。
5 结语
石蒜科植物种类约有 20 多种,在我国有 16 种,石蒜碱等生物碱类化合物是其主要成分,是新药研发中值得重视的资源。石蒜科植物的生物医药学研究在我国已有悠久的历史,随着科学的发展,石蒜碱及其衍生物的种类及药理作用已逐渐丰富,但仍不够完善,有待进一步研究。未来的研究应充分发挥我国资源优势,继续深入研究其药理作用及作用机制,发挥其医用价值,推动我国医药发展!
[1] Hu M, Peng S, He Y, et al. Lycorine is a novel inhibitor of the growth and metastasis of hormone-refractory prostate cancer. Oncotarget, 2015, 6(17):15348-15361.
[2] Cao Z, Yu D, Fu S, et al. Lycorine hydrochloride selectively inhibits human ovarian cancer cell proliferation and tumor neovascularization with very low toxicity. Toxicol Lett, 2013, 218(2):174-185.
[3] Guo Y, Liu X, Sun X, et al. Mannosylated lipid nano-emulsions loaded with lycorine-oleic acid ionic complex for tumor cell-specific delivery. Theranstics, 2012, 2(11):1104-1114.
[4] Hayden RE, Pratt G, Drayson MT, et al.Lycorine sensitizes CD40 ligand-protected chronic lymphocytic leukemia cells to bezafibrate- and medroxyprogesterone acetate-induced apoptosis but dasatanib does not overcome reported CD40-mediated drug resistance. Haematologica, 2010, 95(11):1889-1896.
[5] Liu J, Hu WX, He LF, et al. Effects of lycorine on HL-60 cells via arresting cell cycle and inducing apoptosis. FEBS Lett, 2004, 578(3): 245-250.
[6] Liu XS, Jiang J, Jiao XY, et al. Lycorine induces apoptosis and
down-regulation of Mcl-1 in human leuckemia cell. Cancer Lett, 2009, 274(1):16-24.
[7] Liu R, Cao Z, Tu J, et al. Lycorine hydrochloride inhibits metastatic melanoma cell-dominant vasculogenic mimicry. Pigment Cell Melanoma Res, 2012, 25(5):630-638.
[8] Liu XY, He XY, Wang FM, et al. The influence of lycorisradiata alkali on the proliferation of human gastric cancer cells cultured in vitro.J Xinyang Normal Univ, 2015, 28(2):173-176. (in Chinese)
刘希宇, 贺小英, 王凤梅, 等. 石蒜碱对人胃癌细胞体外增殖的影响. 信阳师范学院学报, 2015, 28(2):173-176.
[9] He Y. The primary study on the molecular mechanism of cell cycle arrest by lycorine in leukemia cells via up-regulating p21 expression. Changsha: Central South University, 2010. (in Chinese)
何艳. Lycorine通过上调P21阻滞白血病细胞周期的分子机制初步研究. 长沙: 中南大学, 2010.
[10] Lo AC, Woo TT, Wong RL, et al. Apoptosis and other cell death mechanisms after retinal detachment: implications for photoreceptor rescue. Ophthalmologica, 2011, 226 Suppl 1:10-17.
[11] Green DR. Cancer and apoptosis: who is built to last? Cancer Cell, 2017, 31(1):2-4.
[12] Hu W, Kavanagh JJ. Anticancer therapy targeting the apoptotic pathway. Lancet Oncol, 2003, 4(12):721-729.
[13] Thompson CB. Apoptosis in the pathogaenesis and treatment of disease. Science, 1995, 267(5203):1456-1462.
[14] Kvansakui M, Hinds MG. The Bcl-2 family: structures, interactions and Targets for drug discovery. Apoptosis, 2015, 20(2):136-150.
[15] García-Sáez AJ. The secrets of the Bcl-2 family. Cell Death Differ, 2012, 19(11):1733-1740.
[16] Rabinowitz JD, White E. Autophagy and metabolism. Science, 2010, 330(6009):1344-1348.
[17] Roy M, Liang L, Xiao XJ, et al. Lycorine downregulates HMGB1 to inhibit autophagy and enhances bortezomib activity in multiple myeloma. Theranostics, 2016, 6(12):2209-2224.
[18] Yu HY, Qiu YL, Pang X, et al. Lycorine promotes autophagy and apoptosis via TCRP1/Akt/mTOR axis inactivation in human hepatocellular carcinoma. Mol Cancer Ther, 2017, 16(12):2711-2723.
[19] Zhou C. Exploring the anti-tumor effect of Lycorine targeting NF-κB signaling pathway. Lanzhou: Lanzhou University, 2016. (in Chinese)
周程. 基于NF-κB信号通路探索石蒜碱抗前列腺癌机理. 兰州: 兰州大学, 2016.
[20] Ying X, Huang A, Xing Y, et al. Lycorine inhibits breast cancer growth and metastasis via inducing apoptosis and blocking Src/FAK-involved pathway. Sci China Life Sci, 2017, 60(4):417-428.
[21] Li SY, Chen C, Zhang HQ, et al. Identification of natural compounds with antiv-iral activities against SARS-associated coronavirus. Antiviral Research, 2005, 67(1):18-23.
[22] Wang P, Li LF, Wang QY, et al. Anti-dengue-virus activity andstructure-activity relationship studies of lycorine derivatives. ChemMedChem, 2014, 9 (7):1522-1533.
[23] Zou G, Puig-Basagoiti F, Zhang B, et al. A single-amino acid substitution in West Nile virus 2K peptide between NS4A and NS4B confers resistance to lycorine, a flavivirus inhibitor. Virology, 2009, 384(1):242-252.
[24] He J, Qi WB, Wang L, et al. Amaryllidaceae alkaloids inhibit nuclear-to-cytoplasmic export of ribonucleoprotein (RNP) complex of highly pathogenic avian influenza virus H5N1. Influenza Other Respir Viruses, 2013, 7(6):922-931.
[25] Shen LY, Yang YJ, Pan XD. Research progress of anti-virus of Lycorine and its derivatives. J Med Res, 2015, 44(4):159-162. (in Chinese)
沈珑瑛, 杨亚军, 潘显道. 石蒜碱及其衍生物抗病毒研究进展. 医学研究杂志, 2015, 44(4):159-162.
[26] Szlávik L, Gyuris A, Minárovits J, et al. Alkaloids from Leucojum vernum and antiretroviral activity of Amaryllidaceae alkaloids. Planta Med, 2004, 70(9):871-873.
[27] Gabrielsen B, Monath TP, Huggins JW, et al. Antiviral (RNA) activity of selected Amaryllidaceae isoquinoline constituents and synthesis of related substances. J Nat Prod, 1992, 55(11):1569-1581.
[28] Renard-Nozaki J, Kim T, Imakura Y, et al. Effect of alkaloids isolated from amaryllida-ceae on herpes simples virus. Res Virol, 1989, 140(2): 115-128.
[29] Vrijsen R, Vanden Berghe DA, Vlietinck AJ, et al. Lycorine: a eukaryotic termination inhibitor? J Biol Chem, 1986, 261(2):505-507.
[30] Liu J, Yang Y, Xu Y, et al. Lycorine reduced mortality of human enterovirus 71-infected mice by inhibiting virus replication. Virol J, 2011, 8(1):483-491.
[31] Chen DZ, Jiang JD, Zhang KQ, et al. Evaluation of anti-HCV activity and SAR study of (+)-lycoricidine through targeting of host heat-stress cognate 70 (Hsc70). Bioorg Med Chem Lett, 2013, 23(9): 2679-2682.
[32] Çitoğlu G, Tanker M, Gümüşel B. Antiinflammatory effects of lycorine and haemanthidine. Phytother Res, 1998, 12 (3):205-206.
[33] Kang J, Zhang Y, Cao X, et al. Lycorine inhibits lipopolysaccharide-induced iNOS and COX-2 up-regulation in RAW264.7 cells through suppressing P38 and STATs activation and increasesthe survival rate of mice after LPS challenge. Int Immunopharmacol, 2012, 12(1):249-256.
[34] Kang JJ, Wang H. Progress in researches for lycorine in anti-inflammatory. Chin Wild Plant Resources, 2013, 32(6):1-3. (in Chinese)
抗晶晶, 王辉. 石蒜碱抗炎作用研究进展. 中国野生植物资源, 2013, 32(6):1-3.
[35] Yamazaki Y1, Kawano Y. Inhibitory effects of herbal alkaloids on the tumor necrosis factor-α and nitric oxide production in lipopolysaccharide-stimulated RAW264 macrophages. Chem Pharm Bull (Tokyo), 2011, 59(3):388-391.
[36] Iqbal Z, Nasir H, Hiradate S, et al. Plant growth inhibitory activity of Lycoris radiata Herb. and the possible involvement of lycorine as an allelochemical. Weed Biol Manag, 2006, 6(4):221-227.
[37] Deng CJ, Zhao GJ, Ren SL, et al. Effects of dihydrolitherine and galantamine on learning and memory deficits in rats. J Yunyang Med Coll, 1996, 15(2):61-63. (in Chinese)
邓春江, 赵国举, 任世兰, 等. 二氢石蒜碱与加兰他敏对小鼠学习记忆损害的影响. 郧阳医学院学报, 1996, 15(2):61-63.
[38] Qin KM, Li X, Xu Z, et al. A Survey of the studies on pharmacological effects of lycorine and its derivatives. J Beijing Union Univ (Nat Sci), 2009, 23(1):6-10. (in Chinese)
秦昆明, 李笑, 徐昭, 等. 石蒜碱及其衍生物的药理作用研究概况. 北京联合大学学报(自然科学版), 2009, 23(1):6-10.
[39] Zhang QF, Gong YX, Yu LS, et al. Effects of dihydrolycorine on the central noradrenergic system. Traditional Chin Drug Res Clin Pharmacol, 2005, 16(2):97-99. (in Chinese)
张秋芳, 龚应霞, 于龙顺, 等. 二氢石蒜碱对中枢去甲肾上腺素系统的影响. 中药新药与临床药理, 2005, 16(2):97-99.
国家自然科学基金(81503118、81274101);中国医学科学院医学与健康科技创新工程(2017-I2M-3-010);“重大新药创制”国家科技重大专项(2018ZX09711003-005-004)
于莲,Email:jdyulian@163.com
2018-05-14
10.3969/j.issn.1673-713X.2018.05.014
