一种高效制备人β2微球蛋白标准物质的方法和应用
2018-10-26邹丽辉王萌黄薇张恩毅肖飞王玉梅
邹丽辉,王萌,黄薇,张恩毅,肖飞,王玉梅
一种高效制备人β2微球蛋白标准物质的方法和应用
邹丽辉,王萌,黄薇,张恩毅,肖飞,王玉梅
100730 北京,北京医院/国家老年医学中心/卫生部老年医学重点实验室(邹丽辉、黄薇、张恩毅、肖飞),检验科(王萌);100050 北京,中国食品药品检定研究院生物材料室(王玉梅)
构建重组人 β2 微球蛋白表达体系,高效快速获取 β2 微球蛋白,为临床实验室检测参考物质的制备奠定基础。
优化人 β2 微球蛋白序列,人工合成优化序列片段并与麦芽糖结合蛋白(MBP)分别克隆至pRSF-Duet 载体以构建重组人 β2 微球蛋白表达质粒。使用大肠杆菌BL21(DE3) 对重组质粒进行诱导表达,TEV 蛋白酶切除 MBP,全自动生化仪测定 β2 微球蛋白浓度。对重组蛋白在 4 ℃和–20 ℃储存条件下的稳定性进行检测,对 β2 微球蛋白纯品与校准品的互通性进行分析。
成功构建重组人 β2 微球蛋白表达质粒,异丙基硫代半乳糖苷(IPTG)成功诱导重组蛋白表达,MBP-β2 微球蛋白(MBP-β2-MG)浓度可达 100 mg/L,β2 微球蛋白浓度可达 185 mg/L。在 4 ℃和 –20 ℃储存条件下监测 64 周,β2 微球蛋白稳定存在。β2 微球蛋白纯品与 RANDOX 生化校准品互通性良好。
通过密码子优化,成功构建了重组 β2 微球蛋白的高效表达系统,β2 微球蛋白可溶性高,稳定性好,与国际通用校准品互通性好,可充分满足该产品诊断试剂制备的需求。
β2微球蛋白; 重组蛋白质类; 参考物质
β2 微球蛋白是由淋巴细胞、血小板和其他大多数有核细胞产生的一种低分子量血清蛋白质,其分子质量为11 800,是由 99 个氨基酸组成的单链多肽。β2 微球蛋白广泛存在于血浆、尿液、脑脊液、唾液以及初乳中。正常人 β2 微球蛋白的合成率及从细胞膜上的释放量相当恒定,并且极易通过肾小球滤过膜,滤过的 β2 微球蛋白 99.9% 被近曲小管细胞重吸收和降解,不再返流入血。当肾小球或肾小管滤过功能受损,尿液和血清中的 β2 微球蛋白增高[1-2]。β2 微球蛋白的调控异常可直接参与癌细胞的发育,被认为是多种恶性肿瘤的预后指标[3-4]。临床上检测血或尿中的β2 微球蛋白浓度为临床肾功能测定、肾移植成活、糖尿病肾病、重金属镉、汞中毒以及某些恶性肿瘤的临床诊断提供较早、可靠和灵敏的指标。脑脊液中β2 微球蛋白的浓度检测对脑膜白血病也有提示作用。
目前临床上测定β2 微球蛋白的方法有放射免疫分析法(RIA)、酶联免疫吸附法(ELISA)、时间分辨荧光免疫分析法等[5]。临床实验室使用的β2 微球蛋白参考物质多从人血清中提取,成本高,产率低,有时特异性和稳定性较差。此外,大多数血清β2 微球蛋白高的血清样本来自患有自身免疫性疾病或肿瘤患者。因此,从大肠杆菌中表达和纯化更高浓度的可溶性 β2 微球蛋白,可为临床实验室提供更优质、更廉价的标准物质。
本研究利用原核表达的方法,构建原核表达质粒 pMBP-β2-MG pRSF,在大肠杆菌中表达。大肠杆菌是一种应用广泛的表达载体,它以简单、快速和经济的方式生长,可高效、快速地获取高纯度人 β2 微球蛋白。同时,因为亲和标记在重组表达中的应用也越来越广泛,His 和 MBP 标记蛋白的纯化和检测能有效地分离所需的蛋白质,最终获得完整的、具有生物活性的β2 微球蛋白,并且大部分产物以可溶形式存在。重组完整β2 微球蛋白经纯化后,浓度为 185 mg/L。储存 64 周后,分别检测不同温度和不同时间点储存的β2 微球蛋白的浓度,证明β2 微球蛋白在一段较长的储存期内均能保持其最初的浓度和功能。
1 材料与方法
1.1 材料
1.1.1 实验材料JM109 菌株及BL21(DE3) 均购自 Takara 公司;质粒 pRSF-Duet 为作者实验室保存。
1.1.2 试剂 核酸内切酶I、HI和RI、T4 连接酶购自 NEB 公司;TEV 酶为实验室自制;质粒提取试剂盒和凝胶回收试剂盒均购自 Axygen Scientific 公司;LB 培养基、TB 培养基、卡那抗生素、IPTG、聚丙烯酰胺、Tris-HCl、NaCl、咪唑均为上海生工生物工程股份有限公司产品。
1.1.3 仪器设备 37 ℃恒温摇床购自苏州市培英实验设备有限公司;DNA 电泳仪和蛋白电泳仪购自 Bio-Rad 公司;Ni-NTA 镍离子亲和树脂及镍离子亲和层析柱购自上海生工生物工程股份有限公司;超声细胞粉碎仪购自宁波新芝生物科技股份有限公司;7100 生化仪购自日本日立公司。
1.1.4 培养基 TB 培养液:酪蛋白水解物 12 g/L,酵母提取物 24 g/L,磷酸氢二钾 9.4 g/L,磷酸二氢钾2.2 g/L;固体 TB 培养基额外加入琼脂15 g/L。以上培养基均加入 100 μg/ml 卡那霉素。
1.2 方法
1.2.1 密码子优化与新基因合成 从 NCBI 数据库检索β2 微球蛋白基因转录本 1 的 CDS 序列,替换稀有密码子,在其 N 端增加HI酶切位点和 TEV 蛋白酶酶切位点,C 端增加RI酶切位点,将完成改造的基因序列委托北京金唯智公司合成。
1.2.2 高效表达菌株的构建 将 MBP 蛋白序列的I和HI双酶切片段插入pRSF-Duet 载体,再将合成的 β2-MG 的HI和R I双酶切片段插入到 MBP 序列 C 端,连接产物转入JM109 菌株(Kan+),对阳性单克隆进行筛选,得到 pMBP-β2-MG pRSF 质粒,测序鉴定序列。
1.2.3 重组 MBP-β2-MG pRSF 的表达与纯化 将构建好的 pMBP-β2-MG pRSF 转入BL21(DE3),挑取单菌落于 5 ml LB 培养基培养过夜。以 1:500 比例将菌液转接至 500 ml TB 培养基,恒温在 37 ℃,230 r/min 培养至600= 0.4 ~ 0.6,向培养基中加入终浓度为 0.5 mmol/L 的 IPTG,25 ℃诱导表达 16 h。取 500 ml 培养液 3000 r/min 离心分离 10 min 后收集菌体,菌体重悬于 30 ml 蛋白提取缓冲液中(50 mmol/L Na3PO4,pH 8.0,500 mmol/L NaCl,10 mmol/L 咪唑),在冰浴条件下,使用超声细胞粉碎仪超声 15 min 破碎菌体,裂解物 12 000 r/min,4 ℃离心20 min,上清液与 Ni-NTA 冰上孵育 1 h,用 250 mmol/L的咪唑洗脱重组 MBP-β2-MG pRSF 蛋白。纯化的重组 MBP-β2-MG 蛋白用 TEV 酶切处理,去除多余的蛋白标签。再次将酶切体系与镍离子亲和树脂(Ni-NTA)4 ℃结合 1 h,收集流出液,即β2 微球蛋白。
1.2.4 β2 微球蛋白浓度检测及存储稳定性检测 使用生化仪检测 MBP-β2-MG 蛋白浓度。将纯化的β2 微球蛋白分别于 4 ℃和–20 ℃分装保存,于 1、2、4、8、16、32、64 周后取样测定蛋白浓度。
在检核思考时,教师也要提醒学生注意方法的可行性,有的实验方案不能随意调整。例如,在“探究pH对过氧化氢酶的影响”实验中,教师可以引导学生思考能否探究pH对其他酶的影响,如唾液淀粉酶等,让学生选择相应的检测指标并设计实验方案。学生根据所学过的知识可能会想到用本尼迪特试剂来检测淀粉水解的产物还原糖,或用碘-碘化钾溶液来检测淀粉剩余的量。从理论上看似乎是可行的,但是实际操作起来却发现存在问题。因为碘-碘化钾溶液在碱性环境下不能起作用,本尼迪特试剂本身也会受到酸性环境的影响。这样的拓展实验尝试可以帮助学生理解为何教材中选用过氧化氢酶,而不选用唾液淀粉酶来进行这项实验。
1.2.5 β2 微球蛋白纯品与校准品的互通性分析 收集 β2 微球蛋白纯品与 β2 微球蛋白校准品(RANDOX,BM1362),用不同浓度的血清稀释。采用 β2 微球蛋白试剂盒测定其浓度,测量值进行回归曲线分析。
2 结果
2.1 β2 微球蛋白基因密码子优化
β2 微球蛋白基因含有 99 个氨基酸,其中17 个氨基酸(17%)由大肠杆菌中罕见的密码子编码。其中,AGA、GGA 和 CCC 密码子可能与大肠杆菌异源蛋白表达的有害作用有关。另外,AGA 被认为是大肠杆菌中使用最少的密码子,将导致目标蛋白表达水平的显著降低(表 1)。为了尽量减少罕见的密码子对大肠杆菌中 β2 微球蛋白基因表达的潜在不利影响,罕见密码子被常用密码子替代(http://www.faculty.ucr.edu/~mmaduro/codonusage/ usage.htm),并根据新的序列合成 β2微球蛋白基因。
2.2 高效表达载体的获得
图 1A 为所用 pMBP-β2-MG pRSF 载体结构图。β2-MG 基因由 T7 启动子控制,在 N 端加入 MBP 标记,以促进靶蛋白的纯化。经抗生素筛选的质粒经双酶切,获得大小约 300 bp 的片段,与预期 β2-MG 片段大小一致(图 1B),送质粒测序,经过 VectorNTI 软件对比,质粒测序结果与预期的质粒图谱完全一致,表明 pMBP-β2-MG pRSF 质粒构建成功。
2.3 pMBP-β2-MG pRSF 的表达分析
将所构建的表达载体pMBP-β2-MG pRSF 转化BL21(DE3)。经 TB 培养基培养及 IPTG 诱导表达后,将菌体离心、破碎,上清与镍柱亲和层析,咪唑洗脱的蛋白液经 SDS-PAGE 电泳。如图 2 所示,在BL21 中可见约 55 kD 电泳条带,大小与预期的 MBP-β2-MG 融合蛋白相符,纯度达到 95% 以上,表明MBP-β2-MG 融合蛋白已成功表达。用自制的 TEV 蛋白酶对 MBP 的切除效率很高,MBP 切除比较完全。

表 1 β2 微球蛋白基因罕见密码子和优化密码子的比较

图 1 构建和验证重组表达载体 pMBP-β2-MG pRSF(A:pMBP-β2-MG pRSF 载体结构图;B:pMBP-β2-MG pRSF 经过BamH I 和EcoR I 酶切后的琼脂糖电泳结果;1:pMBP-β2-MG pRSF 经过BamHI 和EcoR I 酶切结果;M:DNA marker)
Figure 1 Construction and verification of the recombinant expression plasmid pMBP-β2-MG pRSF (A: Schematic diagram of the recombinant expression plasmid pMBP-β2-MG pRSF; B: Agarose electrophoresis of pMBP-β2-MG pRSF digested byHI andRI;1: pMBP-β2-MG pRSF digested byHI andR I; M: DNA marker)
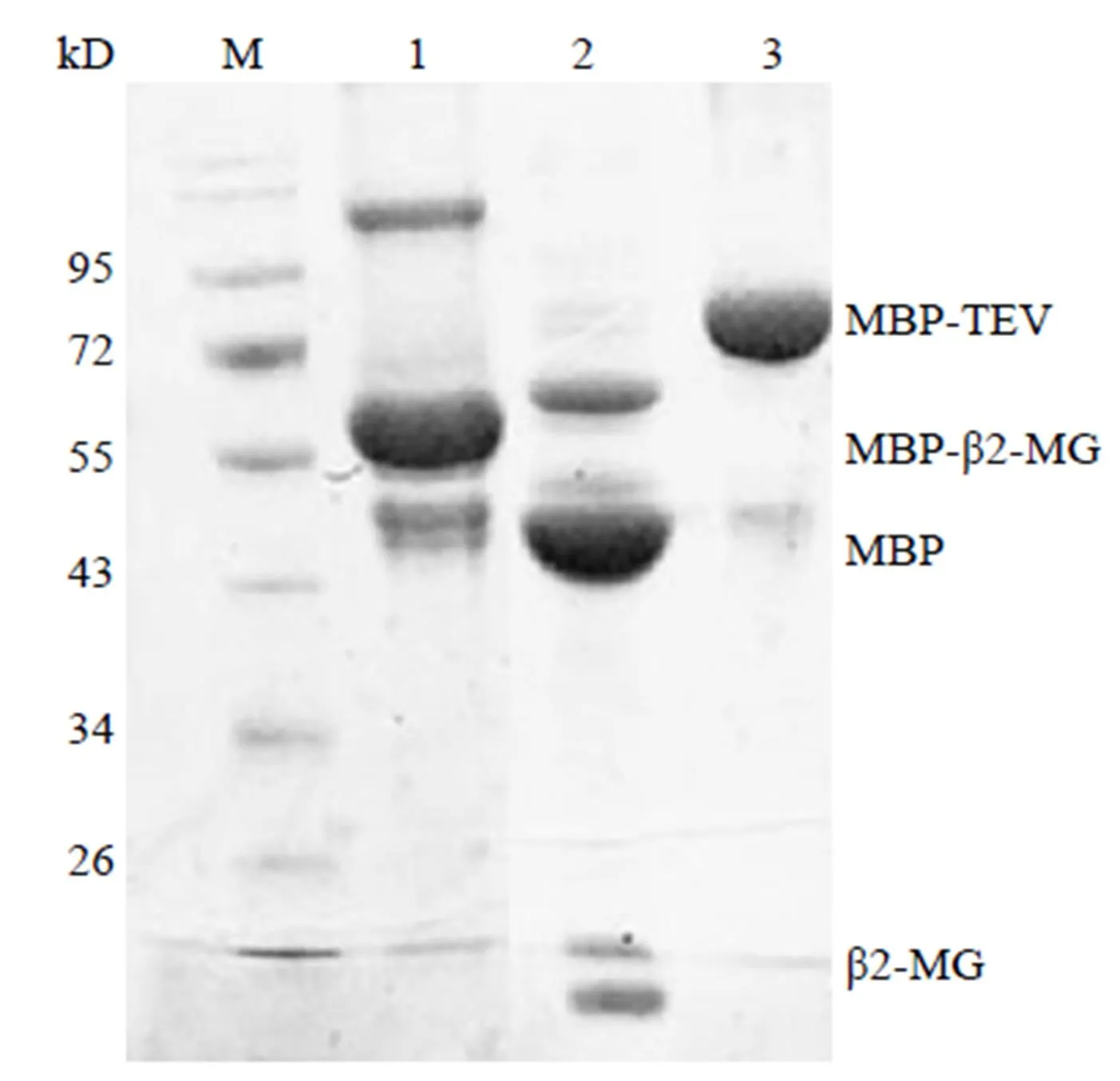
M:Marker;1:纯化的 MBP-β2-MG 蛋白;2:MBP-β2-MG 蛋白以 MBP-TEV蛋白酶消化,MBP 与 β2-MG 蛋白分离;3:MBP-TEV 蛋白
Figure 2 SDS-PAGE analysis of purified MBP-β2-MG protein
为了进一步证实 β2-MG 表达的正确性,切割 β2-MG 蛋白条带,经胰蛋白酶酶切后进行质谱分析,得到靶蛋白的氨基酸序列信息(图 3A)。肽段检测结果如图 3B 所示,得分最高的三个蛋白都为 β2 微球蛋白,且有 8 个肽段都与 β2 微球蛋白的氨基酸序列吻合,结果表明表达蛋白的确为 β2-MG。
2.4 β2 微球蛋白浓度测定及稳定性分析
蛋白质的功能与其蛋白浓度密切相关,以 Bradford 蛋白检测法进一步检测了 β2 微球蛋白的浓度。MBP-β2-MG 融合蛋白经生化仪测定浓度为 100 mg/L,用 TEV 蛋白酶切除 MBP、组氨酸标签,剩余的 β2 微球蛋白纯品浓度可达185 mg/L。纯化蛋白通常需要保存很长一段时间,储存“保质期”取决于蛋白质的性质和储存条件。为了研究在 4 ℃和–20 ℃下,50% 甘油溶液中保存的β2 微球蛋白的稳定性,分别测定了不同时间点(0、1、2、4、8、16、32 和 64 周)的蛋白浓度。如图 4 所示,β2 微球蛋白在 4 ℃和–20 ℃保存条件下均很稳定,半衰期较长,64 周后 4 ℃条件下浓度水平下降不到 7%,–20 ℃条件下浓度水平下降不到 5%。结果表明,重组β2 微球蛋白的稳定性良好,适合低温长时间保存。

图 3 质谱鉴定蛋白序列(A:与 β2 微球蛋白匹配的肽段,匹配可信度绿色> 黄色> 红色;B:匹配蛋白具体信息)
Figure 3 Identification of protein sequence by mass spectrometry (A: Peptides that match β2 microglobulin. Match credibility: green > yellow > red; B: Detail information of matching proteins)

图4 β2 微球蛋白稳定性分析
Figure 4 Stability analysis of β2 microglobulin
2.5 β2 微球蛋白纯品与校准品的互通性分析
分别测定血清稀释后的不同浓度 β2 微球蛋白纯品与英国 RANDOX 生化校准品,然后进行线性回归分析,相关系数为 0.9995(图 5)。证明本研究获得的 β2 微球蛋白纯品与 RANDOX 生化校准品互通性良好。

图 5 β2 微球蛋白与 RANDOX 校准品的互通性分析
Figure 5 Commutability between the purified β2 microglobulin and the β2 microglobulin from RANDOX
3 讨论
近年 β2 微球蛋白作为免疫性疾病标志物和肿瘤标志物在临床检验中广泛应用。随着对其研究的深入,β2 微球蛋白还参与形成主要组织相容性复合体(MHC I或 MHC II)或类似的异二聚体[4]。获取 β2 微球蛋白纯品不仅可以制备相关质控品,也为 β2 微球蛋白的临床和实验室研究奠定基础。因为编码氨基酸的密码子具有简并性,而每种生物对同义密码子的选择都有自己偏好性[6]。大肠杆菌作为一个原核表达系统,经常被用来表达外源蛋白。而密码子使用的物种特异性变异与大肠杆菌中的基因表达水平密切相关。β2 微球蛋白cDNAs 中有许多密码子在大肠杆菌表达系统中不属于大肠杆菌偏好密码子。稀有密码子的存在,可以降低翻译率,导致翻译错误。因此,为实现 β2 微球蛋白在大肠杆菌中的高效表达,进一步利用密码子优化技术,合成了 β2 微球蛋白全长密码子优化基因,以克服这一问题。而不经过密码子优化的 β2 微球蛋白野生型编码序列,经大肠杆菌原核表达系统未诱导出任何可见条带。
虽然真核表达系统表达的外源蛋白具有天然构象,同时具有蛋白活性高的特点,但也存在表达量低,需要耗费大量时间和精力的缺点。谈春荣等[7]利用酵母系统表达 β2 微球蛋白,虽能克服胞外水解酶的问题,但蛋白浓度只可达到 73 mg/L。原核表达系统作为目前应用最为广泛的蛋白表达体系,优点在于能够在较短时间内获得基因表达产物,而且所需的成本相对比较低廉。本室采用原核系统表达 β2 微球蛋白,在融合蛋白N 端提供 6-His 标签,His 标记促进了融合蛋白的纯化。在 IPTG 作用下表达 6His-融合蛋白后,25% 以上的大肠杆菌表达蛋白都为MBP-β2-MG 融合蛋白。本研究还采用 β2 微球蛋白与助溶蛋白 MBP 共表达的方式,克服了常见的包涵体问题。同时调整培养基配方以及通过实验室自制的 TEV 蛋白酶切除 MBP,使 β2 微球蛋白 N 端充分暴露,β2 微球蛋白浓度由 28 mg/L 提高至 185 mg/L,大大提高了 β2 微球蛋白的表达效率和产量。
近年来,临床实验室中用于质量控制的参考物质通常来源于人、猪或其他动物的血清样品,这一过程既昂贵又复杂,并且使用人血清有传播传染病的潜在风险[8]。采取大肠杆菌这一简单高效的表达系统,不仅获得大量高浓度、高稳定性以及与国际通用校准品互通性良好的β2 微球蛋白,并以较低的成本大大提高其在临床生化实验室中的应用。该重组β2 微球蛋白有望成为临床实验室常规β2 微球蛋白检测的质控品。
志谢 特别感谢中国科学院动物研究所膜生物学国家重点实验室公共仪器平台对 β2 微球蛋白质谱鉴定工作的大力支持和帮助!
[1] Real de Asúa D, Puchades R, García-Polo I, et al. Study on the relationship between serum Beta 2-microglobulin levels, underlying chronic kidney disease, and peripheral arterial disease in high-vascular-risk patients. Int Cardiovasc Res J, 2012, 6(4):107-112.
[2] Argyropoulos CP, Chen SS, Ng YH, et al. Rediscovering beta-2 microglobulin as a biomarker across the spectrum of kidney diseases. Front Med (Lausanne), 2017, 4:73.
[3] Yılmaz B, Köklü S, Yüksel O, et al. Serum beta 2-microglobulin as a biomarker in inflammatory bowel disease. World J Gastroenterol, 2014, 20(31):10916-10920.
[4] Li L, Dong M, Wang XG. The implication and significance of beta 2 microglobulin: a conservative multifunctional regulator. Chin Med
J (Engl), 2016, 129(4):448-455.
[5] Terrier N, Bonardet A, Descomps B, et al. Determination of beta2-microglobulin in biological samples using an immunoenzymometric assay (chemiluminescence detection) or an immunoturbidimetric assay: comparison with a radioimmunoassay. Clin Lab, 2004, 50(11-12):675-683.
[6] Fuglsang A. Estimating the "effective number of codons": the wright way of determining codon homozygosity leads to superior estimates. Genetics, 2006, 172(2):1301-1307.
[7] Tan CR, Xu GB, Xia TA. Secreted expression and purification of recombinant human o1-microglobulin in Pichia pastoris. Chin J Lab Med, 2006, 29(8):736-739. (in Chinese)
谈春荣, 徐国宾, 夏铁安. 重组人α1-微球蛋白在毕赤酵母中的高效分泌性表达. 中华检验医学杂志, 2006, 29(8):736-739.
[8] Conry-Cantilena C, VanRaden M, Gibble J, et al. Routes of infection, viremia, and liver disease in blood donors found to have hepatitis C virus infection. N Engl J Med, 1996, 334(26):1691-1696.
An efficient method for the preparation of human β2-microglobulin reference material and its application prospects
ZOU Li-hui, WANG Meng, HUANG Wei, ZHANG En-yi, XIAO Fei, WANG Yu-mei
The MOH Key Laboratory of Geriatrics (ZOU Li-hui, HUANG Wei, ZHANG En-yi, XIAO Fei), Department of Laboratory Medicine (WANG Meng), Beijing Hospital, National Center of Gerontology, Beijing 100730, China; Department of Biomaterials, National Institute for Food and Drug Control, Beijing 100050, China (WANG Yu-mei)
To construct optimized human β2-microglobulin prokaryotic expression system, and obtain recombinant β2-microglobulin efficiently and rapidly which is expected to provide basis for the preparation of reference materials and application in quality control in clinical laboratories.
The optimized human β2-microglobulin gene was synthesized and cloned into pRSF-Duet vector with maltose binding protein (MBP) to generate MBP-β2-MG pRSF expression vector. Recombinant human β2-MG protein was expressed inBL21(DE3) and its concentration was analyzed by Hitachi analysis system after MBP was cut by TEV protease. The stability of β2-MG proteinwas detected during long-term storage at 4 ℃ and –20 ℃. The compatibility of the purified β2 microglobulin and the β2 microglobulin from RANDOX was analyzed.
The prokaryotic expression vector MBP-β2-MG pRSF was successfully constructed. When expressed inBL21(DE3), the concentration of soluble MBP-β2-MG was about 100 mg/L, and the concentration of β2-MG protein could reach 185 mg/L. β2-MG proteinwas stable after 64 weeks at 4 ℃ and –20 ℃. The purified β2 microglobulin had good compatibility with the β2 microglobulin from RANDOX.
The recombinant MBP- β2-MG protein is soluble and the concentration of β2-MG can reach 185 mg/L, which can fully meet the requirement of the preparation of diagnostic reagent.
Beat2-microglobulin; Recombinant proteins; Reference material
WANG Yu-mei, Email: wangyumei@nifdc.org.cn
10.3969/j.issn.1673-713X.2018.05.004
北京市自然科学基金(7172193);“重大新药创制”国家科技重大专项(2017ZX09304026);国家自然科学基金(81571384)
王玉梅,Email:wangyumei@nifdc.org.cn
2018-05-16
