布氏菌疫苗效力评价小鼠模型的建立
2018-10-26魏东李天柱陈成尤明强王国治
魏东,李天柱,陈成,尤明强,王国治
布氏菌疫苗效力评价小鼠模型的建立
魏东,李天柱,陈成,尤明强,王国治
100050 北京,中国食品药品检定研究院结核病疫苗室/卫生部生物技术检定方法及其标准化重点实验室(魏东、陈成、王国治);730046 兰州生物制品研究所有限责任公司菌苗室二室(李天柱、尤明强)
建立布氏菌疫苗效力评价小鼠模型,为布氏菌疫苗有效性评价奠定基础。
测定感染布氏菌株动物的脾脏细菌数,比较菌株毒力,筛选出布氏菌疫苗效力评价用布氏菌株。通过最小感染剂量的测定为效力评价的感染剂量提供基础数据。检测动物体内布氏菌增殖情况,确定动物解剖时间。将不同剂量的布氏菌活疫苗免疫小鼠,4 周后用布氏菌强毒菌株皮下感染,感染 4 周后将动物解剖测定脾脏细菌数,分析疫苗保护效果。
筛选出布氏菌疫苗效力评价感染用布氏菌株,该菌株的皮下最小感染剂量为 300 CFU,感染后 4 周动物脾脏细菌数达到较高且稳定水平。布氏菌活疫苗免疫小鼠后能产生较好的保护效果,免疫剂量与保护力水平之间有较好的量效关系。
建立了布氏菌疫苗效力评价小鼠模型,为新型布氏菌疫苗的研制奠定了基础。
布鲁杆菌菌苗; 最小感染量; 效力
布鲁氏菌病(简称布病)是由布鲁氏菌(简称布氏菌)属引起的一类人畜共患疾病,是《中华人民共和国传染病防治法》中规定报告的乙类传染病。布病在世界范围内广泛流行,是全球特别是发展中国家面临的主要公共卫生问题[1-2]。20 世纪末以来,人布病在世界范围内的发病率呈上升态势,每年新发病例数超过 50 万例,已成为重要的国际性公共卫生问题[3]。中国是布病的历史疫区,近年来布病流行较为严重,且发病率逐年递增,2017 年发病率为 2.79/10 万,已经连续 9 年发病人数超过 3 万。
目前,接种疫苗是世界公认的能够降低布病发生和传播最有效的、最经济的方法[4-5]。我国现人用布氏菌活疫苗采用皮上划痕接种[6],该方法操作复杂,不能准确定量。改进疫苗的免疫途径是布氏菌疫苗研究的热点,而有效性评价是新疫苗研发的重要内容。为此,本研究建立了布氏菌疫苗效力评价小鼠模型,为布氏菌疫苗有效性评价奠定了基础。
1 材料与方法
1.1 主要材料
1.1.1 动物 SPF 级 BALB/c 小鼠,18 ~ 22 g,雌性,由中国食品药品检定研究院(中检院)实验动物中心提供,饲养在复旦大学上海医学院生物安全三级实验室。
1.1.2 菌种 羊种布氏菌菌株编号分别为:CMCC55313(GH12)、CMCC55314(GH18)、CMCC55315(GH21)、CMCC55316(GH23)、CMCC55317(GH24)、CMCC55318(XJ91-60)、CMCC55210(16M),均由中检院结核病疫苗室提供。
1.1.3 疫苗 布氏菌活疫苗(104M株)由中检院结核病疫苗室制备。
1.1.4 试剂和仪器 胰蛋白大豆琼脂培养基购自美国 BD 公司;生物安全柜为美国 NuAire LabGard 公司产品;恒温培养箱为美国 NuAire IR Autoflow 公司产品。
1.2 方法
1.2.1 布氏菌毒力比较 分别用 7 株羊种布氏菌感染小鼠,每株菌感染 5 只小鼠,感染用菌液浓度均为 5.0 × 105CFU/ml,每只小鼠后肢皮下注射 0.2 ml 菌液,感染后 2 周解剖,无菌取动物脾脏,通过脾脏活菌数分析,比较各菌株的毒力,筛选出毒力最强的菌株。
1.2.2 最小感染量的测定 将 18 只BALB/c 小鼠随机分成 6 组,每组 3 只动物,后肢皮下感染不同剂量的羊种布氏菌 XJ91-60 株,感染剂量分别为1 × 101CFU/只、3 × 101CFU/只、1 ×102CFU/只、3 × 102CFU/只、1 × 103CFU/只、3 × 103CFU/只,感染后 4 周,将小鼠解剖,无菌取脾,测定脾脏细菌数,组内全部动物出现脾脏感染的最小感染剂量即为最小感染量(minimum infection dose,MID)。
1.2.3 感染动物解剖时间的确定 将羊种布氏菌 XJ91-60 株后肢皮下感染15 只BALB/c 小鼠,感染用菌液浓度为 5.0 × 105CFU/ml,每只小鼠注射 0.2 ml,分别在感染后 2 周、4 周、12 周各解剖5 只动物,通过脾脏活菌数分析,研究布氏菌在感染动物体内的增殖情况,为解剖时间的确定提供依据。
1.2.4 布氏菌疫苗效力评价研究 将25 只BALB/c 小鼠随机分成 5 组,每组 5 只,免疫组 1(1 × 104/只)、免疫组 2(1 × 105/只)、免疫组 3(1 × 106/只)、免疫组 4(1 × 107/只)、生理盐水对照组,注射途径为后肢皮内。免疫后 4 周,经皮下感染羊种布氏菌 XJ91-60 株1000 个 MID(3 × 105CFU)。感染后4 周将动物解剖,无菌取脾,测定脾脏感染菌的活菌数。
1.3 统计学处理
采用 Minitab 16 统计软件,将脾脏活菌数取以 10 为底的对数后进行检验,如脾脏无细菌生长,按活菌数为 1 进行统计分析,结果以< 0.05 表示差异有统计学意义。
2 结果
2.1 布氏菌株毒力比较
7 株羊种布氏菌株皮下感染小鼠后,通过脾脏活菌数分析,毒力最强的菌株为 XJ91-60 株,以该菌株作为效力评价感染用菌,结果见表 1。
2.2 最小感染量的测定
小鼠经皮下分别感染系列浓度的羊种布氏菌XJ91-60 株,感染 4 周后的脾脏活菌数测定结果见表 2。感染剂量为 3 × 101CFU 时,即可出现动物的脾脏感染;感染剂量为 3 × 102CFU 时,组内全部动物出现脾脏感染。因此,羊种布氏菌 XJ 91-60 株的小鼠皮下最小感染量为 3 × 102CFU。

表 1 布氏菌感染动物脾脏活菌数测定结果
2.3 感染动物解剖时间的确定
将羊种布氏菌 XJ91-60 株感染小鼠,各检测时间点脾脏感染率均为 100%,感染后 2 周脾菌数的对数值为 3.53 ± 0.34,感染后 4 周脾菌数的对数值为 5.50 ± 1.19,感染后 12 周脾菌数的对数值为 5.83 ± 1.10,感染后 4 周脾菌数达到较高且稳定水平,感染后 4 周与感染后 12 周脾菌数差异无统计学意义(= 0.44,> 0.05),结果见图 1。
2.4 布氏菌疫苗效力评价研究
小鼠经不同剂量布氏菌疫苗免疫后 4 周用羊种布氏菌 XJ91-60 株进行皮下感染,感染后 4 周脾脏细菌分离情况见图 2。其中,生理盐水对照组动物的脾脏细菌分离数的对数值为 5.29 ± 0.34,免疫组 1(1 × 104/只)的脾脏细菌分离数的对数值为 2.85 ± 0.56,免疫组 2(1 × 105/只)的脾脏细菌分离数的对数值为 0.47 ± 0.94,免疫组 3(1 ×106/只)及免疫组 4(1 × 107/只)均未分离到感染菌。免疫组 1 及免疫组 2 的脾脏细菌分离数均低于生理盐水对照组,差异均有统计学意义(= 7.42,< 0.01;= 9.95,< 0.01)。免疫组 1 的脾脏细菌分离数高于免疫组 2,差异具有统计学意义(= 4.33,< 0.01)。免疫剂量与脾菌数的相关性系数为–0.963,呈强相关。该结果表明,布氏菌疫苗能对小鼠提供较好的保护效果,该评价模型可用于布氏菌疫苗的效力评价研究。

表 2 最小感染量测定结果
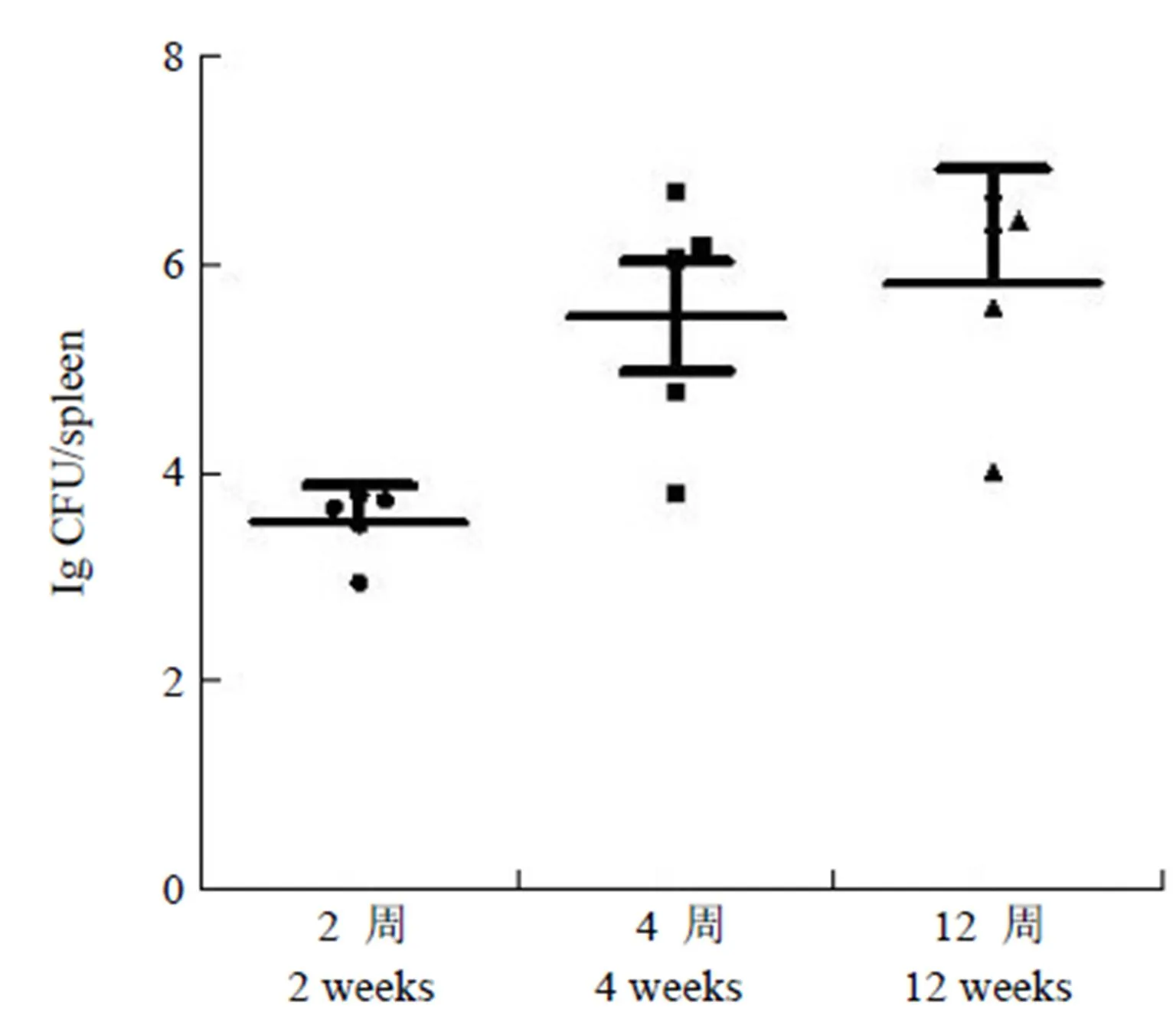
图 1 感染动物体内布氏菌XJ91-60 株增殖结果
Figure 1 Results of proliferation ofXJ91-60 strainin infected animals
3 讨论
布病不仅影响畜牧业和相关产业的发展,造成社会经济损失,并且对人类的健康构成重大威胁[7],美国疾病预防控制中心将布氏菌列为潜在的生物恐怖战剂[8-9]。鉴于布病造成的严重损失,世界上许多国家和地区制定了相应的防控和根除计划,研制新型疫苗在此过程中具有重要意义。动物模型上的有效性评价是新疫苗研制过程中一项重要研究内容。
疫苗效力评价的动物感染模型研究需要确定敏感模型动物,挑选毒力最强的菌株用于动物感染,确定菌株的最小感染剂量,通过检测脾脏感染细菌达到较高且稳定水平的时间来确定感染动物的解剖时机,并通过参考疫苗考核效力评价体系的适用性。
小鼠和豚鼠都是布氏菌的易感动物,由于小鼠便于操作,它是国内外布氏菌疫苗研究常用的动物模型[10]。布氏菌属经典分类为 6 个种:羊种布氏菌()、牛种布氏菌()、猪种布氏菌()、犬种布氏菌()、绵羊附睾布氏菌()以及沙林鼠种布氏菌(),其中对人致病的主要是牛种、羊种和猪种布氏菌[11]。当前,从我国布病患者分离的感染菌主要是羊种布氏菌[12-13]。所以,本研究从羊种布氏菌株中筛选效力评价感染用细菌[14],经比较,毒力最强的菌株为 XJ91-60 株。将不同剂量布氏菌 XJ91-60 株感染小鼠,感染剂量为 3 ×101CFU 时即可出现动物感染,小鼠皮下注射的最小感染量为 3 × 102CFU,说明该菌株毒力较强。布氏菌 XJ91-60 株皮下感染小鼠 1 个月后,脾脏细菌分离数达到较高且稳定水平,所以确定感染动物的解剖时间为感染后 1 个月。以布氏菌活疫苗为参考疫苗考核该效力评价体系,设置了 4 个免疫剂量,免疫后小鼠皮下感染1000 个 MID 羊种布氏菌 XJ91-60 株,对照组动物均能够分离到大量感染菌,疫苗免疫小鼠能有效抵抗布氏菌强毒株的感染,具有较好的保护效果,随免疫剂量增加脾脏细菌分离数明显降低,免疫剂量与保护力水平之间有较好的量效关系。本研究建立了布氏菌疫苗效力评价的小鼠模型,为新型布氏菌疫苗有效性评价奠定了基础。

图 2 布氏菌疫苗效力评价结果
Figure 2 Results of efficacy evaluation of brucellosis vaccine
[1] Pappas G, Papadimitriou P, Akritidis N, et al. The new global map of human brucellosis. Lancet Infect Dis, 2006, 6(2):91-99.
[2] Qiu YH, Wang J, He SY. Research progress on the epidemic, detection and prevention of human brucellosis. Chin J Clin Patholosis, 2015, 7(3):187-188, 172. (in Chinese)
邱宇鹤, 王锦, 何淑云. 人布鲁氏菌病的流行、检测与防治研究进展. 实用检验医师杂志, 2015, 7(3):187-188, 172.
[3] Gwida M, Al Dahouk S, Melzer F, et al. Brucellosis - regionally emerging zoonotic disease? Croat Med J, 2010, 51(4):289-295.
[4] Roth F, Zinsstag J, Orkhon D, et al. Human health benenfits from livestock vaccination for brucellosis: case study. Bull World Health Organ, 2003, 81(12):867-876.
[5] Wang T, Ma WP, Li AQ, et al. Immune effect evaluation of livestock brucellosis in Dabancheng district of Xinjiang municipality. China Anim Health Inspection, 2016, 33(4):6-9, 22. (in Chinese)
王涛, 马卫平, 李爱巧, 等. 新疆达坂城区家畜布鲁氏菌病免疫效果评估. 中国动物检疫, 2016, 33(4):6-9, 22.
[6] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China. Volume 3, 2015. Beijing: China Medical Science Press, 2015:112-114. (in Chinese)
国家药典委员会. 中华人民共和国药典. 2015年版三部. 北京: 中国医药科技出版社, 2015:112-114.
[7] Olsen SC, Palmer MV. Advancement of knowledge of brucellosis over the past 50 years. Vet Pathol, 2014, 51(6):1076-1089.
[8] Greenfield RA, Drevets DA, Machado LJ, et al. Bacterial pathogens as biological weapons and agents of bioterrorism. Am J Med Sci, 2002, 323(6):299-315.
[9] Doganay GD, Doganay M. Brucella as a potential agent of bioterrorism. Recent Pat Antiinfect Drug Discov, 2013, 8(1):27-33.
[10] Smither SJ, Perkins SD, Davies C, et al. Development and characterization of mouse models of infection with aerosolized Brucella melitensis and Brucella suis. Clin Vaccine Immunol, 2009, 16(5):779-783.
[11] Schurig GG, Sriranganathan N, Corbel MJ. Brucellosis vaccines: past, present and future. Vet Microbiol, 2002, 90(1-4):479-496.
[12] Wang DL, Li TF, Liu FQ, et al. Analysis on the monitoring results of brucellosis in 2010. Chin J Ctrl Endem Dis, 2011, 26(4):256-258. (in Chinese)
王大力, 李铁锋, 刘凤岐, 等. 全国2010年布鲁杆菌病监测结果分析. 中国地方病防治杂志, 2011, 26(4):256-258.
[13] Liu ZG, Wang M, Liu RH, et a1. Species identification and epidemiological characteristics analysis of Brucella in Ulanqab, Inner Mongolia, China. Chin J Zoonoses, 2016, 32(7):618-622, 631. (in Chinese)
刘志国, 王妙, 刘日宏, 等. 内蒙古乌兰察布布氏菌分离株种型鉴定及流行病学特征分析. 中国人兽共患病学报, 2016, 32(7):618- 622, 631.
[14] Cheng JS, Wu MH, Zhao LX, et a1. Virulence comparision between three different vaccine strains of brucellosis in mice and guinea pigs. Chin J Vet Drug, 2012, 46(9):1-3. (in Chinese)
程君生, 吴梅花, 赵丽霞, 等. 三种布鲁氏菌病疫苗株的毒力比较. 中国兽药杂志, 2012, 46(9):1-3.
Establishment of the brucellosis vaccine potency evaluation model in mice
WEI Dong, LI Tian-zhu, CHEN Cheng,YOU Ming-qiang, WANG Guo-zhi
TB Vaccine Division, National Institute for Food and Drug Control, Key Laboratory of the Ministry of Health for Research on Quality and Standardization of Biotech Products, Beijing 100050, China (WEI Dong, CHEN Cheng, WANG Guo-zhi); Second Bacterial Vaccine Division, Lanzhou Institute of Biological Products Co., Ltd., Lanzhou 730046, China (LI Tian-zhu, YOU Ming-qiang)
To develop and utilize appropriate animal model ofinfection in order to evaluate the efficacy of vaccines for human brucellosis.
The most virulentstrain was selected by comparing the virulence. In order to establish the minimum infection dose of the selectedstrain in BALB/c mice, groups of 6 animals were injected with series concentration ofbacteria. In order to determine the time of anatomy, mice were culled and the bacterial loads in the spleens were determined at different time after injection. Two experiments were performed to confirm and further characterize this mouse model. The mice were challenged withbacteria at 4 weeks after immunization, and the bacterial loads in the spleens were determined at 4 weeks after injection.
Thestrain used for the evaluation of efficacy of brucellosis vaccine was selected, and the minimum infection dose of the selectedXJ91-60 strain in BALB/c mice was 300 CFU. Bacterial loads in the spleen achieved high and stable level at 4 weeks after injection. The mice immunized with brucellosis vaccinewere protected against challenge with virulentstrain.
Brucellosis vaccine potency evaluation model in mice is established, which lays a foundation for the development of the newbrucellosis vaccine.
Brucella vaccine; Minimum infection dose; Potency
WANG Guo-zhi, Email: vaccine2012@126.com
“重大新药创制”国家科技重大专项(2014ZX09304311-002)
王国治,Email:vaccine2012@126.com
2018-06-26
10.3969/j.issn.1673-713X.2018.05.005
