RANK/RANKL/OPG在角化囊性瘤、含牙囊肿、单囊型成釉细胞瘤囊壁上皮层表达的比较
2018-09-21陈凯瑞罗春媛裴婧贾云香谭艳林杨莉张强
陈凯瑞 罗春媛 裴婧 贾云香 谭艳林 杨莉 张强
1南昌大学第一附属医院口腔颌面外科(南昌330006);2广州医科大学附属口腔医院牙周科,广州口腔疾病研究所,口腔医学重点实验室(广州 510140);3南昌大学附属口腔医院口腔病理科(南昌 330006)
颌骨囊性病变具有诱导局部骨吸收的能力,临床及基础研究表明颌骨囊性病变中囊液的流体压力及渗透压增高对周围骨组织造成物理性压迫而导致骨吸收[1]。随着对骨代谢的认识加深,更多学者意识到颌骨囊性病变的局部骨吸收能力及侵袭性可能取决于病变细胞活化破骨细胞的能力[2]。目前已经明确的与骨吸收调控的相关因子较多,例如前列腺素E2(prostaglandin E2,PGE2),肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)等,通过影响RANK(receptor activator of nuclear factor-κB,RANK)、RANKL(receptor activator of nuclear factor-κBligand)、OPG(osteoprotegerin,OPG)的信号通路的表达从而调节破骨细胞分化及功能[3-4]。
口腔颌面部常见的成釉细胞瘤、角化囊性的临床表现为良性但存在局部侵袭性行为,复发风险高。通常影像学上角化囊性瘤显示为具有光滑或扇形边界的透射影,而成釉细胞瘤表现为单囊或蜂窝状多囊并常伴有根尖吸收。影像学表现的差异可以反映疾病中的RANK,RANKL和OPG含量的变化,并且很可能与病变处于活动或非活动阶段相关。关于RANKL在成釉细胞瘤、含牙囊肿、根尖囊肿中的表达已有相关研究证实[5-6],但是在单囊型成釉细胞瘤、角化囊性瘤、含牙囊肿等常见颌骨囊性病变中关于RANK/RANKL/OPG表达水平的比较目前研究较少。
本研究的目的是通过研究RANK、RANKL及OPG在口腔粘膜、含牙囊肿、角化囊性瘤、单囊型成釉细胞瘤等颌骨常见囊性病变囊壁上皮层的表达,比较疾病中各RANK信号通路分子表达水平。通过将RANK/RANKL/OPG的表达差异与疾病的影像学及临床特点相联系,阐述颌骨囊性病变骨内生长可能的局部因素。
1 材料与方法
1.1 材料选择2005年1月至2012年12月所有在南昌大学附属口腔医院住院手术治疗并且病理科明确诊断的无感染的含牙囊肿26例、单囊型成釉细胞瘤20例、角化囊性瘤23例,并且以10例口腔黏膜组织为对照组。术后病理诊断均由2名有经验的口腔病理医师做出,并在本次实验前再次明确。
1.2 实验方法
1.2.1 标本获取及切片从病理科存档的石蜡标本中收集符合纳入标准的病例,对照组:正常口腔黏膜标本常规石蜡包埋切片。
1.2.2 免疫组织化学SP法RANK/RANKL/OPG抗体(北京中杉金桥生物技术有限公司)最佳稀释浓度分别是1∶200、1∶200、1∶150。按照常规操作,所有切片染色前均经抗原修复。高压热修复抗原:将柠檬酸盐缓冲液(PBS)加热后,将切片置于钢架上,后加入沸腾的PBS,然后将高压锅盖紧闭,大火继续加热,10 min钟后排气继续加热5 min,随后冷却至室温:PBS液清洗2次,每次5 min。
1.2.3 免疫组化结果判定采用10×40光学显微镜对所有切片组织上皮显色反应进行观察,并根据Barnes综合计分法对切片进行计分定性分析。判断标准:切片高倍镜(400×)随机取5个上皮视野,应用A×B评分等级区分表达强度。A:显色细胞的有无及深浅,不着色或与背景色相似、浅黄色,棕黄色或棕褐色分表记为1、2、3;B:显色细胞的比例,1%~10%记为1、11%~50%记为2、51%~80%记为3、>80%记为4;评分用A×B,0表示阴性表达(-)、1~4标记为弱阳性表达(+)、>4代表强阳性表达(++)。所有阅片均采用双盲法。
1.2.4 统计学方法应用SPSS19.0软件进行统计学处理,RANK、RANKL、OPG在各组之间表达水平的比较采用多个独立样本的非参数检验(Kruskal-Wallis test),两两比较采用R×C的Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
RANK、RANKL、OPG在实验组及对照组中的表达情况见表1及图(1~4)。光镜下,RANK、RANKL、OPG等物质被染色成黄色至棕褐色粗细不一颗粒,主要位于细胞质中,在实验样本中均有表达。在疾病组和黏膜中都有RANK蛋白表达,且单囊型成釉细胞瘤中阳性率高达85%,各疾病组的强阳性率高于正常黏膜(P>0.05)。RANKL在牙源性角化囊性瘤中表达的阳性率最高,且角化囊性瘤、含牙囊肿,成釉细胞瘤切片中RANKL的表达水平高于对照组(P<0.05),3组疾病的RANKL的表达强度不存在差异。OPG蛋白在疾病组中水平表达较低,角化囊性瘤的表达强度高于成釉细胞瘤(P<0.05),两两分析认为OPG表达强度存在:黏膜>角化囊性瘤>成釉细胞瘤。
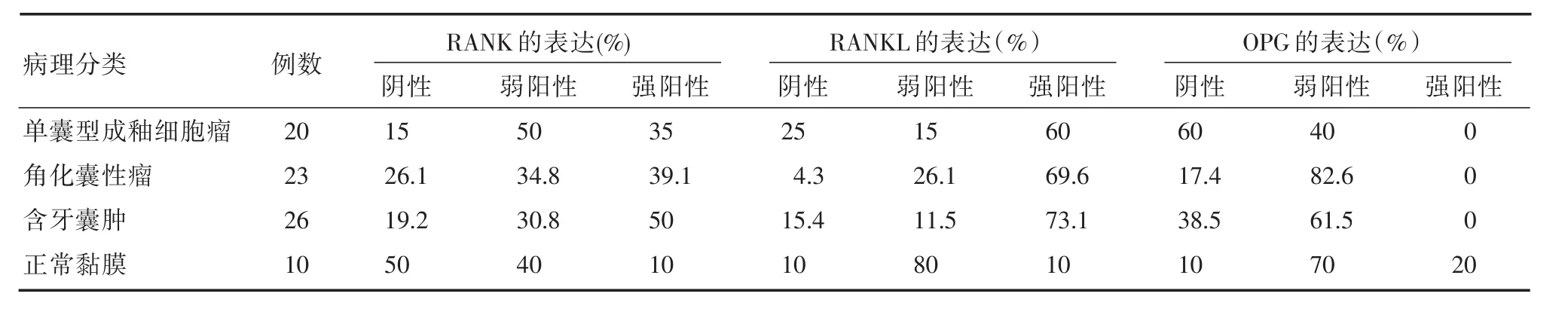
表1 RANK、RANKL、OPG在单囊型成釉细胞瘤、角化囊性瘤、含牙囊肿以及黏膜中的表达情况Tab.1 Distribution of cases with respect to RANK,RANKL,OPGranks of positive and negative in unicystic ameloblastomas,keratocystic odontogenic tumors,dentigerous cysts and mucosa
3 讨论
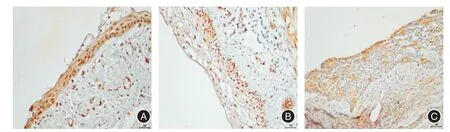
图1 RANK、RANKL、OPG在单囊型成釉细胞瘤(A、B、C)中的阳性表达(免疫组化染色,放大倍数×400)Fig.1 Representative immunohistochemical reactivity for RANK,RANKL,and OPGin the epithelium of unicystic ameloblastomas(A,B and C)(immunohistochemical staining,original magnification 400)
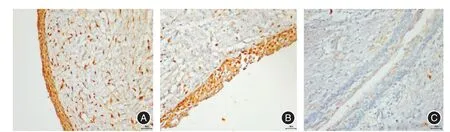
图2 RANK、RANKL、OPG在角化囊性瘤(D、E、F)中的阳性表达(免疫组化染色,放大倍数× 400)Fig.2 Representative immunohistochemical reactivity for RANK,RANKL,and OPGin the epithelium of keratocystic odontogenic tumors(D,Eand F)(immunohistochemical staining,original magnification 400)
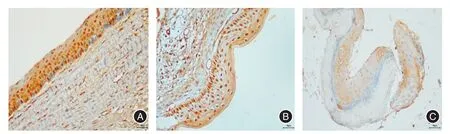
图3 RANK、RANKL、OPG在含牙囊肿(G、H、I)中的阳性表达(免疫组化染色,放大倍数× 400)Fig.3 Representative immunohistochemical reactivity for RANK,RANKL,and OPGin the epithelium of dentigerous cysts(G,H and I)(immunohistochemical staining,original magnification 400)
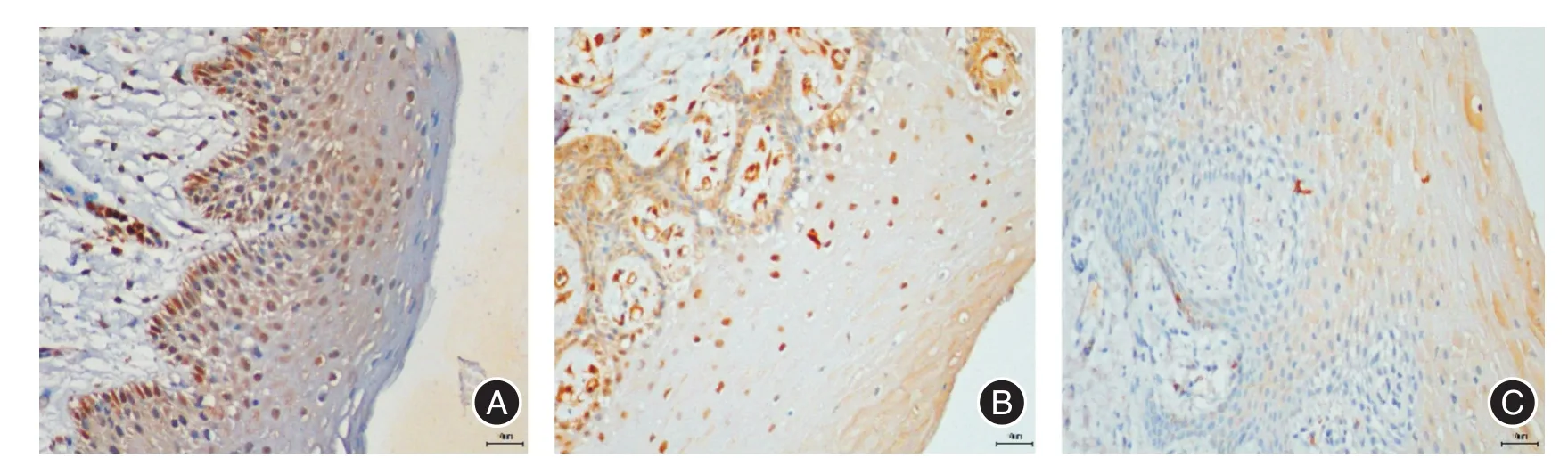
图4 RANK、RANKL、OPG在正常黏膜(J、K、L)中的阳性表达(免疫组化染色,放大倍数× 400)Fig.4 Representative immunohistochemical reactivity for RANK,RANKL,and OPGin the epitheliumof normal mucosa(J,K and L)(immunohistochemical staining,original magnification 400)
该研究应用免疫组化方法检测RANK、RANKL、OPG等因子在单囊型成釉细胞瘤,角化囊性瘤和含牙囊肿的囊壁上皮层表达,并以10例口腔黏膜为对照组。以往的研究显示RANK/RANKL/OPG信号通路的活化在牙源性肿瘤及非肿瘤疾病造成颌骨吸收过程中有重要意义[5-7],然而单囊型成釉细胞瘤、角化囊性瘤、含牙囊肿等常见颌骨囊性病变中关于RANK/RANKL/OPG表达水平的比较目前研究较少。
成釉细胞瘤是经典的良性牙源性肿瘤,其生长具有局部侵袭性、手术治疗后有较高的复发率[8]。单囊型成釉细胞瘤的性质类似于牙源性囊肿,X线多呈现边缘清晰的单房性透射影且病损区域常含有阻生的牙齿,需要与角化囊性瘤、含牙囊肿等鉴别。病例回顾研究发现青年患者中成釉细胞瘤多见单囊型成釉细胞瘤,临床上保守治疗常有较高的复发率,其复发率范围从16%~30.5%不等[9]。与其性质类似的颌骨角化囊性瘤的发病年龄集中在10~29岁,影像学上角化囊性瘤多呈单囊或多囊性椭圆形投射影,边缘清晰并常伴有边缘骨质硬化。临床上多采取保守手术治疗但是复发率高达20%~30%,甚至角化囊性瘤有癌变的零星文献报道[10]。基于单囊型成釉细胞瘤与角化囊性瘤的临床行为和影像学特点,RANK、RANKL、OPG的表达水平在两组疾病囊壁上皮中可能存在差异。关于成釉细胞瘤破骨机制的研究中显示“成釉细胞瘤骨吸收与瘤细胞中OPG低表达和RANKL高表达相关”[11]。研究中也观察到RANKL、RANK及OPG在单囊型成釉细胞瘤及角化囊性瘤的囊壁上皮结构中均有表达,较正常粘膜组织上皮结构存在RANKL和RANK高表达,OPG低表达。进一步比较发现单囊型成釉细胞瘤和角化囊性瘤的囊壁上皮结构中的RANKL阳性表达率不存在差异(P>0.05),然而OPG的表达水平则表现单囊型成釉细胞瘤的表达水平低于角化囊性瘤(P<0.05),即单囊型成釉细胞瘤较角化囊性瘤有更强的骨吸收破坏能力。病变组织高表达RANKL和低表达OPG导致邻近的骨组织中破骨细胞活性增强,因而我们认为临床上单囊型成釉细胞瘤较角化囊性瘤存在较大骨破坏性及复发率可能与OPG表达水平差异有关。该研究结果与大部分研究结论一致[12-13],但是部分学者的研究的结论也值得思考,特别是KUMAMOTO和OOYA的研究中观察到的成釉细胞瘤细胞中有这较高的OPG 的表达[14]。
含牙囊肿又称滤泡囊肿,指囊壁包含一个未萌牙的牙冠并附着于该牙的颈部的囊肿。因此其存在典型的X表现圆形透射区,边界清晰,囊腔内含有一个未萌的牙冠,较大的病变可呈多房性改变。但是囊腔含有牙齿的特点并非其独有,角化囊性瘤,单囊型成釉细胞瘤囊腔中也多见含有未萌出的牙齿。含牙囊肿多见于10~39岁男性并且手术治疗后很少复发。实验结果显示含牙囊肿囊壁上皮结构中OPG表达水平与正常黏膜中的接近,但是RANKL表达水平正常黏膜的高,并且与角化囊性瘤、单囊型成釉细胞瘤之间不存在差异。含牙囊肿造成颌骨吸收的机制可能与囊壁上皮细胞高表达RANKL信号分子,激活的RANKL信号通路促进破骨细胞分化、抑制破骨细胞凋亡,最终颌骨吸收形成。对比含牙囊肿、角化囊肿和单囊型成釉细胞瘤中OPG的表达强度,有理由认为含牙囊肿的预后良好与OPG高表达相关。最后也应该注意到RANK的表达水平在各组切样本中的表达水平不存在差异,这表明在3种颌骨囊性病变中RANK所起的作用有限,可能RANK并不是RANK/RANKL/OPG信号通路的主导者。同时颌骨的代谢涉及众多的信号分子,RANK信号通路仅是其中较关键的一部分而且其作用不仅仅只有骨代谢相关。
研究中可以观察到RANK、RANKL、OPG信号分子在正常黏膜、含牙囊肿、角化囊性瘤及单囊型成釉细胞瘤的上皮结构中均有表达,显示牙源性肿瘤与非肿瘤类疾病都能够表达RANK信号通路分子,扩展了关于RANK信号通路的知识。然而用免疫组化方法探讨单囊型成釉细胞瘤、角化囊性瘤和含牙囊肿囊壁上皮层中RANK/RANKL/OPG信号通路的表达水平并对比分析,实验结果能解释各疾病之间部分临床差异然而还是存在部分不足。实验中还观察到囊壁的结缔组织或肿瘤的间质中也有不同水平的目标蛋白表达,然而本文仅分析上皮结构中各分子的表达水平。同时免疫组化的研究方法只能测定时间点的表达量,疾病的发展是一个动态过程存在静止期和稳定期。我们期待有更好的方法准确检测牙源性肿瘤及非肿瘤病变中骨吸收破坏相关因子的水平差异。
单囊型成釉细胞瘤、角化囊性瘤、含牙囊肿都会造成颌骨的吸收,然而彼此之间存在不同X线特点,临床上保守手术治疗后复发率也有差异。本实验结果表明单囊型成釉细胞瘤、角化囊性瘤和含牙囊肿的囊壁上皮结构会分泌较口腔黏膜高水平的RANKL和低的OPG导致颌骨缺损的发生,而且OPG的表达水平存在“正常黏膜>牙源性角化囊性瘤>单囊型成釉细胞瘤”,我们认为RANK/RANKL/OPG信号通路在含牙囊肿、牙源性角化囊性瘤、单囊型成釉细胞瘤的所造成的颌骨吸收中有重要作用并且OPG的表达水平差异与3组疾病的临床差异有关联。
