氯代肉桂醛纳米乳的制备及其抑菌活性研究
2018-09-13胡梁斌
王 婧,周 威,胡梁斌,钟 敏,张 浩
(河南科技学院食品学院,河南新乡 453003)
肉桂醛作为天然醛类化合物来源于肉桂等多种植物中,能有效抑制细菌和真菌生长[1-3]。近年来,相关报道指出,肉桂醛能显著抑制或清除多种微生物形成的生物膜[4-6]。肉桂醛的许多衍生物也具有良好的抑菌活性。课题组通过前期筛选和比较对肉桂醛及其多种衍生物进行了抑菌活性比较,结果发现在对肉桂醛及其7种衍生物如肉桂酸、肉桂醇、苯丙醛、苯丙酸、苯丙醇、氯代肉桂醛、甲基肉桂醛等开展的抑菌实验中,氯代肉桂醛的抑菌活性最高,其对食源性病原微生物如金黄色葡萄球菌、大肠杆菌和沙门氏菌均具有良好的抑制效果。
氯代肉桂醛作为肉桂醛的衍生物,在物理性质上为油状液体,虽具有良好的抗菌活性,但其与水不相溶、具刺激气味和高度挥发等特性会限制其在实际工作中的应用。大量研究表明将精油纳米化是有效解决这一问题的方法之一。纳米乳是各向同性,热力学稳定的透明(或半透明)液体。形成纳米乳的方法有高能量法与低能量法,低能量法中的自发乳化法,通过混合助剂材料自发形成纳米乳。纳米乳的粒径可通过改变组分含量和改变环境因素[7]等条件进行调整,此体系中含有油、水、表面活性剂等化合物,粒径在10~100 nm,因而具有长期的稳定性,能高度溶解精油类等水难溶性的物质,使其成为携载药物的有效工具之一[8],且能克服精油在水相体系中时,物理和化学性质都不稳定的现象[9]。纳米化技术不但解决了精油利用受限的问题,且许多实验表明纳米化后精油的活性也被显著提高。其中,王德德等[10-11]研究的纳米化肉桂醛具有抗辣椒疫霉病原菌与抗黄曲霉菌的增效作用等。因此,对氯代肉桂醛开展的深入研究,能为研发环境消杀剂及食品器械接触用灭菌剂提供理论依据,且能为扩大其利用范围开发新类型的药物制剂提供理论参考。
1 材料与方法
1.1 材料与仪器
金黄色葡萄球菌ATCC25923、大肠杆菌MG1655 购于中国工业微生物菌种管理保藏中心;沙门氏菌CVCC541 由河南科技学院动物科技学院提供;氯代肉桂醛 美国Sigma公司;吐温-80 北京索莱宝科技有限公司;橄榄油 100%,上海市浦东新区,食品级;无水乙醇 天津市恒兴化学试剂制造有限公司;试剂均为分析纯。
ZetasizerNano V 7.11型激光粒度分析仪 英国Marlvern instrument公司;透射电子显微镜 日本奥林巴斯公司;多功能酶标仪 美国赛默飞世尔公司;UV-7200型可见分光光度计 上海尤尼柯公司;SHP-160 型智能恒温培养箱 上海沪循科学仪器公司;HL-2S型恒流泵 上海沪西分析仪器厂有限公司;78-1型磁力加热搅拌器 江苏金坛市中大仪器厂等。
1.2 实验方法
1.2.1 纳米化氯代肉桂醛制备
1.2.1.1 油相筛选 由于氯代肉桂醛难溶于水,可选择有机溶剂来溶解。将10 μL氯代肉桂醛精油分别滴在5 mL橄榄油、维生素E油与乙酸乙酯中,边滴边振荡,直至饱和状态,记录滴加体积,氯代肉桂醛在三者中选取溶解度最大的作为油相[12]。
1.2.1.2 表面活性剂筛选 参考Azeem[13]的方法,取非离子表面活性剂Tween-80、EL-40,将表面活性剂与超纯水以3∶20 (w/w)比例混合,37 ℃水浴10 min,涡旋振荡,充分混匀,若液体澄清,再次加入10 μL 氯代肉桂醛,直至液体浑浊为止。溶解油相最多的表面活性剂为最佳表面活性剂。
1.2.1.3 助表面活性剂筛选 经过初步筛选,选择无水乙醇、1,2-丙二醇及混合醇(乙醇∶1,2-丙二醇=13∶12)作为助表面活性剂,室温下,将吐温-80与三种助表面活性剂按质量比为3∶1的比例混合,然后与确定的油相按照质量比(w/w)为9.8∶0.2、9.5∶0.5、9∶1、8.75∶1.25、8.5∶1.5、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9比例混合,室温下,用恒流泵逐滴加入蒸馏水,边滴加边用磁力搅拌器搅拌,记录体系由澄清到混浊时的各组分的质量百分比并记录用水量,以水相、油相、表面活性剂作为三个顶点,利用Origin 8.0绘制伪三元相图,根据乳区大小,筛选最佳的助表面活性剂。
1.2.1.4 Km值确定 表面活性剂和助表面活性剂的质量比例为Km值[14],室温下将筛选好的表面活性剂和助表面活性剂按照质量比为4∶1、5∶1、6∶1混合好,然后此混合物同油相以9.8∶0.2、9.5∶0.5、9∶1、8.75∶1.25、8.5∶1.5、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9比例混合,室温下,用恒流泵逐滴加入蒸馏水,边滴加边用磁力搅拌器搅拌,记录体系由澄清到混浊时的各组分的质量百分比并记录用水量,以水相、油相、表面活性剂和助表面活性剂作为三个顶点利用Origin 8.0绘制伪三元相图,根据乳区的大小,筛选最佳的Km值[15]。
1.2.2 纳米化氯代肉桂醛的质量评价
1.2.2.1 纳米化氯代肉桂醛结构类型的鉴别 取两份等体积的氯代肉桂醛纳米乳,一份滴入油溶性苏丹Ⅲ,另一份滴入水溶性亚甲基蓝,记录两份样品在5 s、1 min与5 min时染料在纳米乳中的扩散状况和体系的外观变化,若制备的纳米乳为水包油型(oil in water,O/W),则亚甲基蓝在样品中的扩散速度快于苏丹Ⅲ,且亚甲基蓝会溶于纳米乳体系,苏丹Ⅲ则不溶[16]。
1.2.2.2 纳米化氯代肉桂醛的粒径分析 取制备好的纳米化氯代肉桂醛,用去离子水稀释100倍,旋涡振荡仪混匀后用0.22 μm的水系滤膜过滤,分成两份,其中一份,吸取少量的样品液滴加在含有Formvar膜的铜网上,用磷钨酸负染30 s,放在通风橱中自然风干,在透射电镜下观察纳米乳的形态[17];另一份则借助激光粒度分析仪检测其平均粒径和多分散系数(polydispersity index,PDI),PDI值越高,纳米乳粒径的均一性越差,PDI<0.7视为稳定[18]。每次实验设三组重复,实验重复三次。
1.2.3 纳米化氯代肉桂醛热力学稳定性评估
1.2.3.1 冷热储藏稳定性 在4 ℃和40 ℃两种环境下,循环交替存放24 h,连续5次循环,看是否出现相的分离、浑浊、乳状液分层和破乳等现象。
1.2.3.2 高速离心实验 将刚制备好的纳米乳放在2 mL离心管中,10000 r/min离心30 min,观察外观是否出现分层、浑浊和絮凝等不稳定的现象[8],在由水、油、表面活性剂和助表面活性剂形成的分散体系中,在100倍重力下,不发生相的分离,即可认为此纳米乳稳定[19]。
1.2.3.3 冻融循环实验 取三组制备好的纳米乳在-20 ℃和20 ℃的环境下,经过三次冻融循环,每个环境下存放48 h,观察纳米乳的形态。
1.3 纳米化氯代肉桂醛的溶血实验
采用96微孔,每孔加入195 μL制备好的2%兔血红细胞悬液,用氯代肉桂醛精油和纳米化氯代肉桂醛处理,使其终浓度为0、50、100、200、300、400、500、800、1000 μg/mL,2% triton处理作为阳性对照;溶剂作为阴性对照。37 ℃恒温培养箱中作用2 h,取出放在离心机中离心15 min,观察实验现象,每个实验平行重复三次。
1.4 纳米化氯代肉桂醛的抑菌活性
1.4.1 最小抑菌浓度(Minimum Inhibitory Concentration,MIC)和最小杀菌浓度(Minimum Bactericidal Concentration,MBC)
取-80 ℃的菌种划线培养,挑取单克隆,接种到液体培养基中37 ℃过夜摇培,以1∶200的比例转接至OD600=0.8~1.0,稀释此溶液至OD600≈0.1,再稀释100倍,作为测MIC、MBC的待测菌液。
MIC值:用微量滴定法,在96孔板中每孔加入200 μL菌悬液,依次加入氯代肉桂醛和纳米化氯代肉桂醛,使其终浓度分别为20、40、80、100、200、300、400、500、600 μg/mL,37 ℃培养24 h,目测法检查细菌的生长情况,抑制细菌生长的最低浓度被定为MIC值[20],同时用酶标仪测定其在OD600值,以吸光度的变化得出它们的抑菌活性。
MBC值:依据最小抑菌浓度(MIC)的结果,取OD=0.1稀释100倍的菌液,6000 r/min,离心3 min弃上清,加1 mL PBS悬起,梯度稀释作为对照。在96孔板中,用纳米化和非纳米化的Cl-CA的终浓度分别为15、30、37.5、75、150 μg/mL的处理,37 ℃培养24 h。分别从每孔中吸取10 μL培养物,采用梯度稀释滴板法[21]测定菌落总数,以菌落存活率下降3lg的最低抑菌浓度为MBC值[22]。吸取每个梯度的稀释液10 μL滴LB固体培养基上,37 ℃静置培养12 h,计数统计菌落生长数目。
1.4.2 纳米化氯代肉桂醛对生物膜的清除作用 利用生物膜能被结晶紫着色固定的原理[23],选择金黄色葡萄球菌S.aureusATCC25923、大肠杆菌E.coilMG1655、沙门氏菌S.enteriditisCVCC541来研究纳米化氯代肉桂醛对微生物已经形成的生物膜的清除作用。96孔板中,每孔加入107cfu/mL的菌液,190 μL液体培养基,37 ℃静置培养48 h形成生物膜。将上层的培养基吸掉,然后用PBS进行冲洗,避免把生物膜冲破,吸走PBS清洗液,放置在4 ℃过夜干燥,在每个孔里加入200 μL纳米化的氯代肉桂醛,使其终浓度为0、93.75、187.5、375、750、1500 μg/mL,37 ℃培养24 h。药物处理过后,将药物移除,每个孔里加入200 μL 0.1%的结晶紫溶液处理5 min,充分固定生物膜。着色后,用相同倍数的蒸馏水清洗2~3次以清除未被吸收的结晶紫,在37 ℃的气流中进行干燥。加入200μL乙醇溶解结晶紫,并用酶标仪测定其在595 nm下的吸光值[24],利用吸光值大小的变化来确定生物膜的清除效果。
1.5 数据处理
本研究中所有实验样品均设置3次重复。用SPSS 11软件one-way ANOVA对数据进行方差分析同时利用Duncan新复极差法进行显著性检测(p<0.05)。Orgin 8.0进行绘图,其中各图同一指标中不同字母表示差异显著(p<0.05)。
2 结果与分析
2.1 纳米乳配方的筛选及制备
2.1.1 油相筛选 亲脂性的药物倾向于溶解在O/W类型的纳米乳中,药物装载在油相中和其他组分形成纳米乳,疏水性药物在油相中的溶解度越大则形成纳米乳的油相体积越小,在实际应用中就越易进行药物递送。油相作为纳米乳重要的成分之一,Azeem曾指出蓖麻油、玉米油、椰子油、矿物油、乙酸乙酯等均可作为油相形成纳米乳[25]。在备选油相中,氯代肉桂醛在橄榄油中的溶解度最大,且橄榄油来源天然、稳定性好、无毒无害符合纳米乳制备中油相的选择标准,故作为油相。
2.1.2 表面活性剂筛选 表面活性剂的选择决定形成纳米乳的稳定性,在表面活性剂的选择中最关键的因素是化合物的毒性。相对离子型表面活性剂来说,非离子表面活性剂的毒性相对较小且临界胶离子浓度较小[11]。非离子表面活性剂很少因体系的pH和离子强度的改变而受影响,且体系具有良好的流动性[13],经常被认为是安全和生物适用,在此体系中吐温-80能溶解更多的氯代肉桂醛,故选择作为表面活性剂。
2.1.3 助表面活性剂筛选 纳米乳体系中加入助表面活性剂首先是为了降低表面活性剂的使用浓度,减小界面张力和增加界面的流动性,其次其能增加表面活性剂烃链尾部的流动性,渗透更多的油相到该烃链区域,助表面活性剂一般选择短链或中链醇类,醇类具有增加水相和油相相互渗透的作用且能相互包容[26]。由图1可比较出橄榄油-水-吐温-80和不同的助表面活性剂,形成乳区面积的大小,在此体系中无水乙醇和1,2-丙二醇作为混合助表面活性剂的成乳区最大,因此选择混合醇类作为助表面活性剂。

图1 不同助表面活性剂形成纳米乳区面积的对比
2.1.4 Km值的确定 利用伪三元相图成乳区面积的大小对纳米乳的Km值进行筛选,Km的筛选是为了进一步优化纳米乳的配方,使得各组分不分先后顺序加在一起都能形成稳定的纳米乳。研究发现表面活性剂:助表面活性剂的Km比值不但影响相图中成乳区面积和位置的关键因素[13],还能通过增加分散熵、增加界面区域来降低纳米乳体系的自由能以至于使用低剂量的助剂浓度达到体系热力学稳定的目标。通过图2显示,同其他比值相比,当Km=4∶1(吐温-80∶混合醇)时伪三元相图形成的乳区面积最大,表明在此条件下形成纳米乳体系更加稳定,因此选择Km=4∶1。

图2 不同Km值纳米乳区面积的对比
故纳米乳的制备方法为:将w(氯代肉桂醛)=2.81%加入w(橄榄油)=1.02%中混合均匀,逐滴滴加w(吐温-80)=25%,w(无水乙醇)=3.26%,w(1,2-丙二醇)=2.99%,最后逐滴加入w(蒸馏水)=65.3%,边滴加边搅拌,直至形成澄清透明的纳米乳。
2.2 纳米化氯代肉桂醛的质量评价
2.2.1 纳米化氯代肉桂醛的结构类型鉴别 图3A中可以看出,制备好的纳米化氯代肉桂醛是微淡黄色澄清透明液体,具有良好的流动性,把水溶性的染料亚甲基蓝和油溶性的染料苏丹Ⅲ同时滴入刚制备氯代肉桂醛纳米乳中,滴入5 s(图3a)、滴入1 min(图3b)、滴入5 min(图3c)后呈现出不同景象。从图3a、b、c中可看出亚甲基蓝滴入5 s即可融入氯代肉桂醛纳米乳中,5 min后和纳米乳相容;而苏丹Ⅲ图3d、e、f滴入后不能溶于纳米乳中,分层明显,由此可以证明制备的氯代肉桂醛纳米乳为O/W类型的纳米乳。

图3 两种染料在氯代肉桂醛纳米乳中的扩散过程
2.2.2 纳米化氯代肉桂醛形态观察及粒径分析 在12000倍的透射电镜下观察到氯代肉桂醛纳米乳,乳滴呈现规则的球形,形态大小较一致,液滴平均粒径为25.35 nm,分散性良好,无破乳团聚等现象(图4a)。

图4 纳米乳的透射电镜和粒度分布图片
激光粒度分析仪的结果显示,其平均粒径为(15.88±1.01) nm,PDI为0.16,PDI系数越小表明形成的纳米乳粒径的均一性越好,粒径分布范围均在10~50 nm(图4b)。
2.2.3 纳米化氯代肉桂醛的稳定性分析 为防止形成的纳米乳是亚稳定的状态,可通过热力学实验进行冷热交替储藏、高速离心、反复冻融实验来检测其热力学稳定性,经过上面的实验发现制备的氯代肉桂醛纳米乳外观仍为微淡黄色澄清透明的液体,在10000 r/min离心30 min后未出现相的分离、浑浊、乳状液分层和破乳等不稳定现象,在4 ℃和40 ℃交替存放24 h,取出并未发现相的分层和沉淀等现象,故此体系为热力学稳定的体系,且通过透射电镜及激光粒度分析仪的测定,粒径未发生变化。
2.3 氯代肉桂醛纳米乳的生物安全性
从图6中可以看出,作为阴性对照的溶剂不会对红细胞造成破坏,而2% triton作为阳性对照能完全引起血红细胞的破裂;因此和氯代肉桂醛精油相比,纳米化氯代肉桂醛在浓度为300 μg/mL时,引起红细胞的破裂,但氯代肉桂醛在100 μg/mL即引发溶血现象,由此可见纳米化修饰后能显著提高氯代肉桂醛的生物安全性。

图5 氯代肉桂醛和纳米化氯代肉桂醛处理2%血红细胞的溶血现象对比
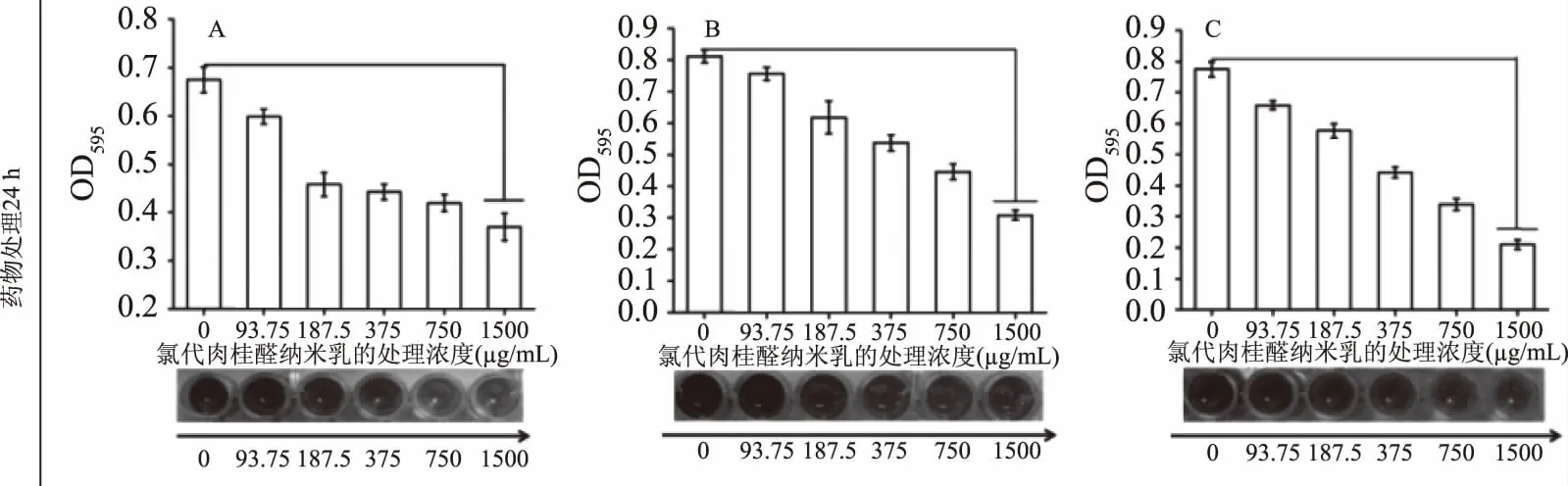
图6 纳米化氯代肉桂醛对三种细菌生物膜的清除作用
2.4 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)
通过对比纳米化氯代肉桂醛和氯代肉桂醛的抑菌活性,发现纳米化后能增大氯代肉桂醛的抑菌作用,结果见表1,体外抑菌实验显示抑菌活性均提高了50%~200%,对革兰氏阳性菌和革兰氏阴性菌均有良好的抑菌作用,这与李红波等发现将肉桂醛纳米化后能够显著的提高其抑菌活性的结果相一致[11]。
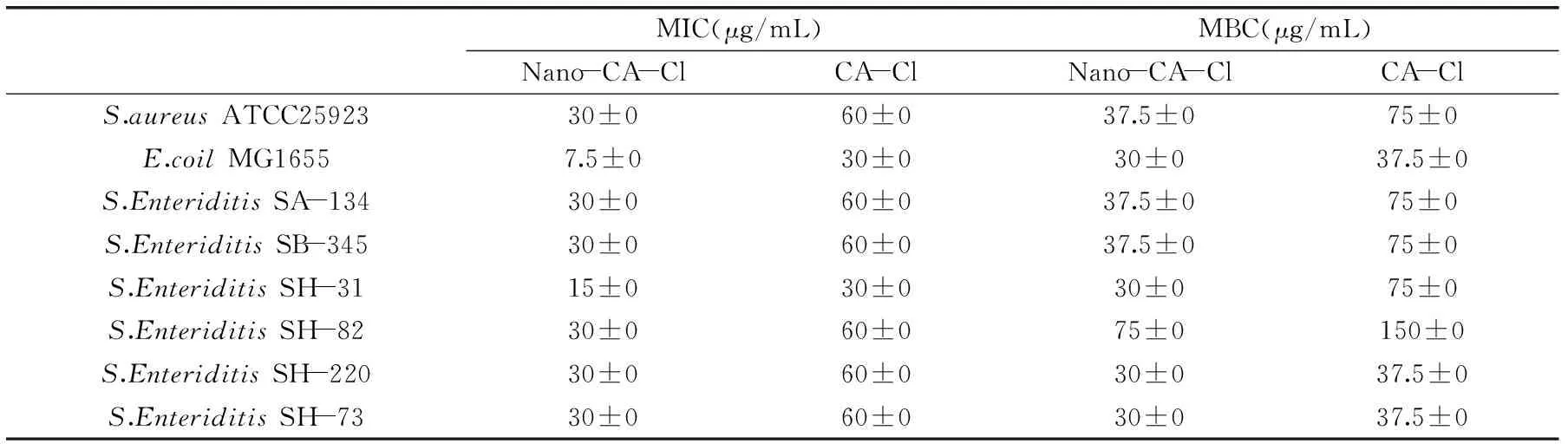
表1 氯代肉桂醛和纳米化氯代肉桂醛对8种细菌的最小抑菌浓度和最小杀菌浓度
2.5 纳米化氯代肉桂醛对生物膜的清除作用
通过测定OD595 nm的吸光值来分析纳米化氯代肉桂醛是否能清除或裂解已经形成的细菌生物膜,在此选择静置培养48 h的生物膜来分析。由于培养72 h时,其生物膜量低于前期(24~48 h),可能是由于营养物质的匮乏引起了自行裂解。在培养48 h的A:S.aureusATCC25923、B:E.coilMG1655、C:S.EnteriditisCVCC541三种细菌的上层LB液体培养基中,未发现生物膜裂解的残留,进而在48 h形成的生物膜中加入浓度为93.75~1500 μg/mL的纳米化氯代肉桂醛处理24 h后,测其OD595 nm下的吸光值,如图6所示,随着纳米化氯代肉桂醛浓度的升高,OD值逐渐减小,说明能清除已形成的生物膜。
3 结论
本研究以肉桂醛的衍生物氯代肉桂醛作为研究对象,虽然其抑菌活性比肉桂醛好,但与肉桂醛一样属于水不溶性油状液体且具有挥发性,导致其在实际应用中受到限制,故采用低能乳化法将其进行纳米化修饰,纳米化后形成了具有良好流动性的澄清透明液体,能与水无限混溶。与非纳米化氯代肉桂醛相比,其抑制食源性细菌活性提高了50%~200%,且能有效清除微生物形成的生物膜。与此同时,纳米化修饰后的氯代肉桂醛降低了氯代肉桂醛的溶血浓度,提高了其生物安全性,为氯代肉桂醛在实际生活中的应用提供了理论依据。
