超声造影联合声辐射力脉冲成像技术在甲状腺微小乳头状癌诊断中的研究
2018-08-24何燕莲余岳芬徐小兰符春荣李梅芬
何燕莲,余岳芬,徐小兰,舒 婷,符春荣,李梅芬
(儋州市人民医院超声科,海南 儋州 571799)
甲状腺微小乳头状癌(Papillary thyroid microcarcinoma,PTMC)是指甲状腺癌原发病灶的最大直径≤1 cm的乳头状癌,其发病率近年来有上升的趋势且呈年轻化[1]。研究发现,超声造影(Contrast-enhanced ultrasound,CEUS)及声辐射力脉冲成像(A-coustic radiation force impulse-imaging,ARFI)技术对于良恶性肿瘤的鉴别有着重要的意义[2-3],但在甲状腺病变的研究中正处于探索阶段。本研究通过回顾性分析496例PTMC患者的CEUS及ARFI成像特征,探讨CEUS及ARFI在PTMC诊断中的价值,旨在为PTMC的确诊提供新的思路和方法。
1 资料与方法
1.1 研究对象
选取2013年1月—2016年12月海南省儋州市人民医院行甲状腺手术并在术前接受超声检查的患者496例,男 228例,女 268例,年龄18~63岁,平均(39.24±11.63)岁,共564个病灶。 纳入标准:甲状腺低回声结节,结节最大直径≤1.0 cm,经病理学证实者。排除囊性、囊实性或高回声结节者。
1.2 仪器与方法
1.2.1 主要仪器
采用siemens Acuson S2000型超声诊断仪,使用线阵探头9L4,造影探头频率9.0 MHz,造影机械指数(MI)0.08,配备 ARFI技术及造影软件。
1.2.2 检查方法
先用常规彩色多普勒超声对甲状腺结节进行连续多切面扫查。常规超声检查后,启用ARFI程序,取样框置于结节中心,屏住呼吸,避免吞咽动作,将取样框(大小6 mm×5 mm)置于甲状腺结节最大切面处,获得系统自动计算的剪切波传导速度(Shear wave velocity,SWV),单位为 m/s,并测量患者远离结节正常甲状腺组织的SWV值,每个部位重复测值5次取中位值。仪器中出现x.xx m/s,在排除囊性病变后,将x.xx m/s记为9.00 m/s。进行CEUS时,使用莱科公司的造影剂声诺维(SonoVue),将5 mL生理盐水注入SonoVue冻干粉末中进行配置,振摇均匀。选择合适切面的同时显示完整的病灶及周边正常组织,抽取1.8 mL造影剂经肘静脉团注,随后注入5 mL生理盐水,保持切面不变,同时启动计时器,连续观察造影剂灌注过程,将CEUS动态全过程采集存储于机器硬盘供后处理分析。
1.3 图像分析
由两位有10年以上工作经验的医师脱机分析所有肿块的常规超声图像、ARFI图像及CEUS图像,均独立完成诊断结果。如两位医师诊断结果不一致,则重新读图,达成一致后纳入本研究。CEUS图像分析结节为病灶显影达峰时与周围组织显影强度比较,分为高增强、等增强及低增强。
1.4 统计学方法
采用SPSS 17.0统计软件分析,计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验。计数资料以百分率(%)表示,组间比较采用χ2检验。评估常规超声、CEUS及ARFI对PTMC的诊断效能,并应用受试者工作特征(ROC)曲线下面积(Area under cure,AUC)分析 SWV 对 PTMC 的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 病灶特征
564个病灶中,良性病灶306个,包括结节性甲状腺肿242个、甲状腺炎38个、滤泡型腺瘤26个,最大直径为0.5~≤1.0 cm的病灶197个,最大直径<0.5 cm的病灶109个。恶性病灶258个,均为PTMC,最大直径为0.5~≤1.0 cm的病灶142个,最大直径<0.5 cm的病灶116个。
2.2 常规超声特征
超声声像图在鉴别PTMC中有统计学意义的是形状、边界、晕环、内部回声及微小钙化(P<0.01),而后方衰减差异无明显统计学意义(P>0.05)(表1)。
2.3 CEUS特征
甲状腺良性结节CEUS多表现为非向心性、环形增强、均匀增强,而PTMC多为向心性、不均匀低增强,造影剂早期消退明显。以不均匀、低增强作为恶性结节的定性诊断标准。甲状腺良性结节与PTMC在CEUS图像特征中比较,差异均有统计学意义(P<0.01)(表 2)。
2.4 ARFI特征
PTMC结节内部SWV值及SWV比值明显高于甲状腺良性结节,差异有统计学意义 (P<0.05)。PTMC周边组织SWV值与甲状腺良性结节比较,差异无统计学意义(P>0.05)(表 3)。
2.5 CEUS、ARFI及两者联合对PTMC的诊断效能
CEUS或ARFI用于诊断PTMC的敏感度及特异度均明显高于常规超声,差异有统计学意义(P<0.05);CEUS联合ARFI用于诊断PTMC的敏感度、特异度、准确率、阳性预测值及阴性预测值均优于CEUS 或 ARFI,差异有统计学意义(P<0.05)(图 1,表 4)。
2.6 SWV对PTMC的诊断价值
SWV诊断PTMC的AUC及95%CI为0.894(0.836~0.958),当 SWV 取值为 3.65 m/s时,其诊断PTMC的敏感度、特异度、阳性预测值及阴性预测值均最好,分别为 87.3%、90.6%、92.3%和85.7%(图1)。
3 讨论
PTMC因其病灶较小,且无明显临床症状,给早期诊断带来极大的困难。目前常规超声对PTMC的诊断率较低,无法满足临床的需求。CEUS能够检出肿块的微循环灌注情况和浸润范围,ARFI是一种定量评判组织硬度的技术,能够获得常规成像模式无法获取的组织弹性信息,两者为甲状腺良恶性结节的鉴别诊断提供了新的技术支持。

表1 甲状腺结节的常规超声特征(例(%))
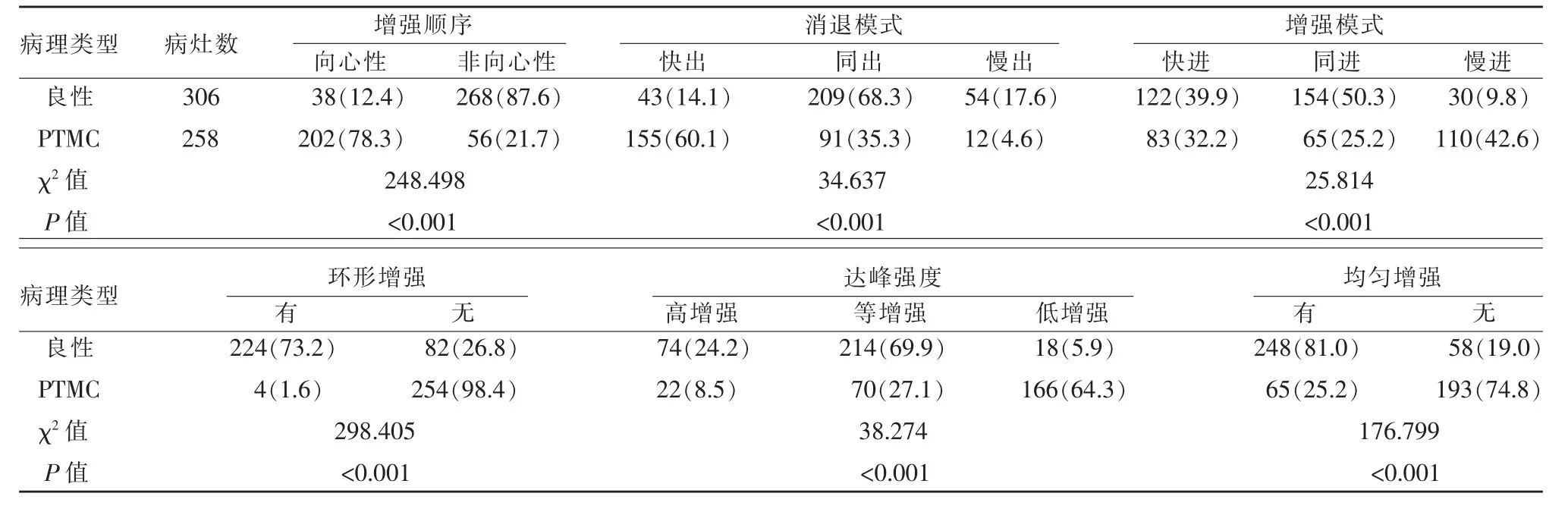
表2 甲状腺结节的CEUS特征(例(%))
表3 甲状腺结节的ARFI结果(±s)

表3 甲状腺结节的ARFI结果(±s)
病理类型 结节内部SWV值 周边组织SWV值 SWV比值良性 (2.02±0.93)m/s (1.96±0.84)m/s 1.05±0.46 PTMC (5.92±3.25)m/s (2.13±0.95) m/s 2.82±1.44 t值 6.914 1.062 5.017 P值 <0.001 0.358 0.023
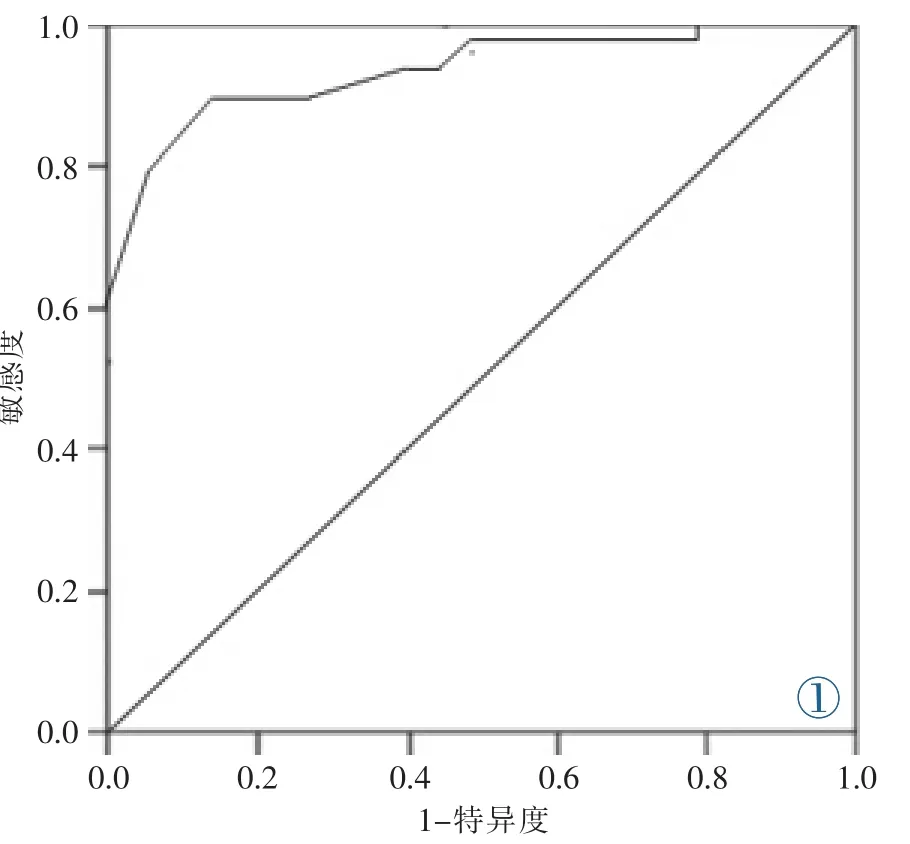
图1 SWV诊断PTMC的ROC曲线。Figure 1.ROC curve of SWV for diagnosing PTMC.

表4 CEUS、ARFI及两者联合对PTMC的诊断效能
本研究中,良性结节常规超声主要表现为形态规则、边界清晰、无微小钙化,CEUS表现为非向心性、环形增强、均匀等/高增强,ARFI显示SWV值与周边正常组织较接近,与既往研究[4-5]结果相似。结节性甲状腺肿呈膨胀性生长,边界清晰,形态规则(图2)。良性结节在组织反复增生和修复的过程中,引起周边纤维结缔组织增生,故CEUS表现为环形增强。良性结节大多数表现为与周边甲状腺组织同进同退并等/高增强,是因为经历了不同的增生、修复时期,在不同的病变发展的阶段,结节内的血管分布特征不一,最终导致结节造影表现多种多样。PTMC常规超声表现为边界不清、形态不规则、低回声结节,CEUS大多数表现为向心性、不均匀低增强、造影剂早期消退明显,ARFI显示PTMC结节内部SWV值及SWV比值明显高于甲状腺良性结节,与王小燕等[6]研究结果相似。PTMC患者中有161个结节多次测量SWV值为“x.xx m/s”,经CEUS证实为实性病灶,说明甲状腺结节硬度较硬,超出仪器的检测上限,若实性结节测量SWV中出现“x.xx m/s”时,则高度提示恶性(图3)。有研究表明,ARFI可反映甲状腺肿瘤的硬度,有效评价肿瘤组织的弹性变化,从而有利于甲状腺良、恶性病变的早期鉴别诊断[7]。He等[8]的研究也发现,ARFI通过SWV值的大小定量反映组织的弹性特征,SWV值越高,组织越硬、弹性越差,其恶性程度越高。国内外应用CEUS对甲状腺结节的研究认为恶性结节多表现为不均匀低增强[9],也有研究指出CEUS增强程度与肿瘤大小相关[10],较大的恶性结节以高增强多见。

图2 a 常规超声表现为边界清晰、形态规则。 图2b CEUS表现为均匀高增强。 图2c ARFI显示SWV值为2.39 m/s。 图3a 常规超声表现为边界不清、低回声实性结节。 图3b CEUS表现为不均匀低增强。 图3c ARFI显示SWV值为x.xx m/s(甲状腺结节硬度超过上限)。Figure 2a. Conventional ultrasound shows clear boundary and regular shape. Figure 2b. CEUS shows homogeneous high en hancement.Figure 2c.ARFI shows that the SWV value is 2.39m/s.Figure 3a. Conventional ultrasound shows unclear boundary and hypoechoic solid nodule. Figure 3b. Contrast-enhanced ultrasound shows heterogeneous low enhancement. Figure 3c. ARFI shows that the SWV value is x.xx m/s(the hardness of thyroid nodules exceeds the upper limit).
我们应用不同超声检查方法评价其对PTMC的诊断价值,结果显示CEUS或ARFI用于诊断PTMC的敏感度及特异度均明显高于常规超声,CEUS联合ARFI用于诊断PTMC的敏感度、特异度、准确率、阳性预测值及阴性预测值均优于CEUS或ARFI。说明CEUS联合ARFI应用在PTMC的诊断中较单一检查方法具有更高的诊断价值,与Zhang等[11]研究结果相符合。有研究表明,CEUS、弹性成像及两者联合诊断甲状腺癌的敏感度、特异度和准确率分别为 88.24%、90.34%、89.67%,85.29%、88.97%、87.89%,98.53%、96.55%、97.18%,两者联合的诊断效能明显高于单一检查方法[12]。此外,Liang等[13]研究也发现CEUS和ARFI对甲状腺癌的检出均有较高的价值,在<1 cm的PTMC诊断中两者联合检出敏感性较高。本研究显示,SWV诊断PTMC的AUC及 95%CI为 0.894(0.836~0.958),SWV 最佳诊断截点为3.65 m/s,诊断PTMC的敏感度为87.3%,特异度为90.6%,与Deng等[14]的研究结果相似。Friedrich-Rust等[15]的研究结果也表明,甲状腺恶性结节的SWV值高于良性结节,将SWV≥3.30 m/s诊断为甲状腺恶性结节,ARFI技术鉴别诊断良恶性结节的特异度为95%。
综上所述,常规超声能从形态学和血流动力学角度帮助判断PTMC,CEUS及ARFI则从组织灌注血供及组织生物力学特性的角度提供常规超声所不能显示的诊断信息,CEUS联合ARFI的应用能进一步提高PTMC诊断的准确率。
