自然妊娠与辅助生殖妊娠早期流产染色体非整倍体发生的比较
2018-08-13向菁菁刘敏娟刘英华张建林张玉泉李海波
向菁菁,刘敏娟,毛 君,刘英华,张建林,张玉泉,李 红,王 挺,李海波
(1南京医科大学附属苏州医院生殖与遗传中心,江苏 苏州215002;2江苏南通大学附属医院妇产科,江苏 南通226000)
0 引言
统计数据显示只有25%~30%的妊娠能够最终得到活产,而其他70%~75%的妊娠终止在各个孕期,大部分是由于染色体异常。而对于怀孕前三个月的流产,约50%是由于染色体异常导致[1]。因此,对早期停止发育的胚胎进行染色体检查对指导再次生育具有重要的意义。辅助生殖技术(assisted reproduction technology,ART)指利用医疗技术对配子、合子、胚胎进行人工操作,以达到受孕的目的,包括宫腔内人工授精(intrauterine insemination,IUI)和体外受精-胚胎移植技术(in vitro fertilization-embryo transfer,IVF-ET)及其各种衍生技术。ART能够有效治疗不孕症,在临床上已经得到广泛应用,但由于高流产率,成功生育率仍然较低。为比较自然妊娠与辅助生殖技术妊娠早期流产胎儿的绒毛染色体非整倍体发生情况,本研究对自然妊娠和辅助生殖妊娠中698例早期流产绒毛运用CNVplex高通量多重基因拷贝数检测技术进行分析,比较两组人群早孕期流产样本染色体非整倍体情况,并进一步探讨ART技术对胚胎非整倍体发生的影响。
CNVplex高通量多重基因拷贝数检测技术用于检测染色体非整倍体,共设计有170对探针,分布在24条染色体的着丝粒两侧及染色体末端约0 Mb、10 Mb、20 Mb处进行探针设计,平均每条染色体覆盖5~8条。该体系可用于检测每条染色体靶定区域的拷贝数情况,以及染色体的末端缺失或重复。2017年一篇关于CNVplex技术用于流产物检测的文章中提到,CNVplex对于流产物的检测结果与aCGH的结果完全一致,因此该技术可作为自然流产后有效的筛查方式[2]。 2017年国内另一项研究[3]对 60例反复自然流产病例的绒毛样本分别进行多重DNA拷贝数(CNVplex)和荧光原位杂交(fluorescence in situ hybridization,FISH)技术检测,所有样本同时行绒毛培养核型分析验证。结果48例培养成功的流产绒毛样本中,染色体异常率为60.42%。其中48例CNV-plex检测结果与核型分析相一致,而FISH检测结果中与核型分析结果相符的只有38例。对于非嵌合体和非结构异常样本,两种方法与细胞遗传学核型分析结果符合率分别为100%(CNVplex)和79.17%(FISH)[3]。本研究旨在通过具有更高成本效能比的检测方法,对常规与辅助生殖流产的绒毛样本检测分析,以期揭示两组在染色体异常方面的差异。
1 资料和方法
1.1 一般资料选择2015年6月至2017年3月在苏州市立医院生殖与遗传中心门诊就诊,经临床确诊为胚胎停止发育而行手术清宫的孕妇698例,年龄21~43岁,孕龄为5~15周。分成两组:自然妊娠组和辅助生殖组,基本情况见表1,两组年龄(P=0.000 04)和孕龄(P =0.002)比较,差异有统计学意义。

表1 两组流产绒毛基本情况
1.2 方法
1.2.1 绒毛DNA的提取 挑取流产绒毛约15 mg,用Qiagen试剂盒提取DNA。DNA浓度和OD(260 nm)/OD(280 nm)比值用Nanodrop-1000测定,其 OD260/OD280 比值为 1.6~1.8,并将 DNA 稀释至25 ng/μL。
1.2.2 CNVplex检测及数据分析 采用天昊生物医药科技(苏州)有限公司N1008人类24条染色体非整倍体检测试剂盒。试剂盒共设计了170对探针,保证每条染色体至少被5对探针覆盖,这些探针在1个连接反应体系中完成连接,连接产物随后进行PCR反应扩增,扩增产物进行荧光毛细管电泳分离[2]。具体实验方法如下所述。①连接反应。每个反应孔中加入总量150 ng的相应体积的DNA样本,并用灭菌纯净水补齐至8 μL,阴性对照直接加8 μL洗脱液。按说明书配制预混合液体系,混匀后每管分装10.5 μL到反应孔中,置 PCR仪上进行如下反应:98℃ 2 min ;95℃ 30 s,60℃ 3 h 5 个循环;60℃保存。连接反应共15 h,反应结束后加入20 μL“终止液”终止反应并混匀。②连接产物多重荧光PCR扩增。对连接探针产物,进行多重PCR扩增。按说明书配制预混合液体系:混匀后每管分装19 μL,加入1 μL连接产物,置PCR仪上进行扩增:95℃ 2 min;94℃ 20s,62℃ -1℃ /cycle 40 s,72℃ 1.5 min 共 5 个循环;94℃20 s,57℃ 40 s,72℃ 1.5 min 共 27 个循环;68℃30 min;4℃保存。③扩增产物荧光毛细管电泳分离。取 1 μL 扩增产物稀释液与 0.1 μL LIZ500,8.9 μL Hi-Di混匀后,95℃ 5 min变性后上ABI测序仪。④数据分析。目标峰高的数据由GeneMapper读取,进而对样本目的区域的拷贝数进行分析确定。
1.3 统计学分析采用SPSS19.0软件进行统计分析处理,计数资料用率表示,两组间的比较用t检验,卡方检验或Fisher精确检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组流产绒毛染色体非整倍体情况698份流产绒毛中非整倍体共计308例,异常率为44.12%(308/698)。自然妊娠组流产绒毛正常整倍体为328例,非整倍体 255 例,异常率为 43.73%(255/583)。辅助生殖组流产绒毛正常整倍体为62例,非整倍体53例,异常率为 46.08%(53/115)。 两组异常率比较,差异无统计学意义(P=0.643,表 2)。
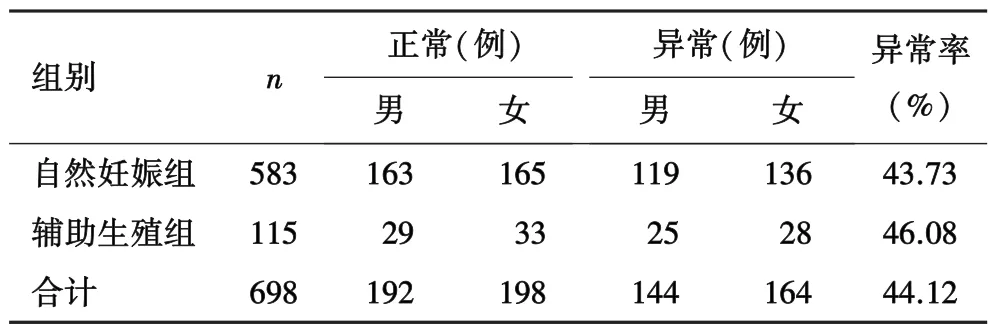
表2 两组流产绒毛染色体非整倍体情况
2.2 流产绒毛染色体非整倍体的类型流产绒毛染色体非整倍体中以三体型最为常见,占78.90%(243/308)。常染色体除了1号,19号三体未被检出,其他染色体的三体都有检测到,最常见的为16三体,22三体和21三体。特纳综合征(45,X)也是常见的异常核型(表3)。各种非整倍体类型的比例在两组流产绒毛中无显著性差异(表3)。
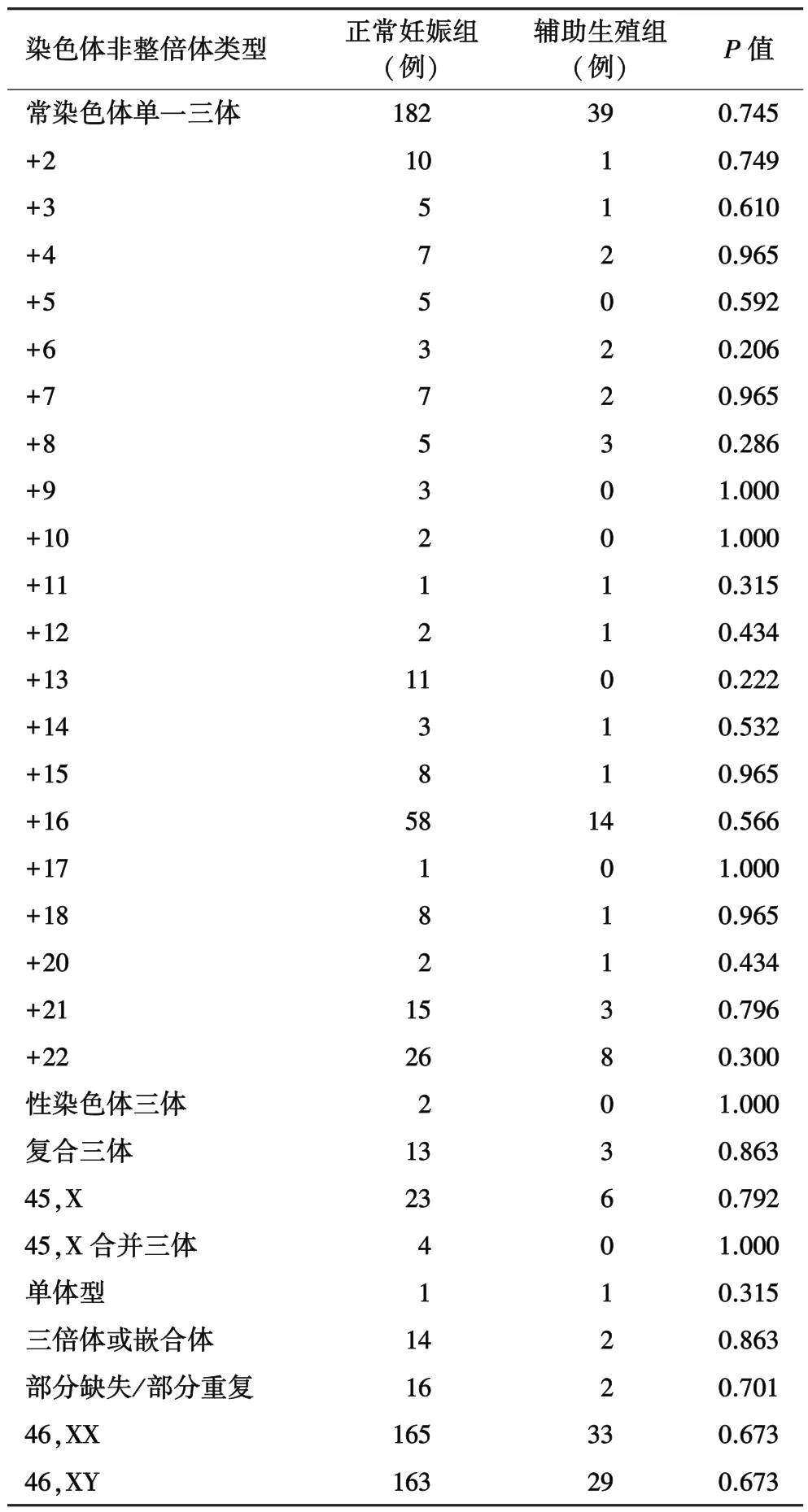
两组流产绒毛染色体核型分析结果
2.3 胚胎性别与核型异常的关系698份流产绒毛样本中男性胚胎占 48.14%(336/698),女性胚胎占51.86%(362/698),男女性别比例无显著性差异(P=0.164)。男性胚胎中染色体异常的胚胎占42.86%(144/336),女性胚胎中染色体异常的胚胎占45.30%(164/362),异常胚胎在两种性别胚胎中的比例无显著性差异(P=0.515,表 4)。

表4 胚胎性别与染色体核型异常的关系
3 讨论
近年来,妊娠早期流产的发病率呈上升趋势,是一种病因复杂的常见病。流产绒毛细胞染色体检查有助于医生了解胚胎细胞的遗传特点,为查找流产病因提供理论依据。引发胚胎停育及早期流产的原因包括遗传学因素、内分泌因素、免疫因素和环境因素等,排在第一的仍是染色体异常,异常率为50%~80%[4]。本研究的698例流产绒毛样本中,检出染色体非整倍体308例,异常率为44.12%。其中自然妊娠组的非整倍体发生率为43.73%,辅助生殖组的非整倍体发生率为46.08%。本研究中辅助生殖组女性平均年龄高于自然妊娠组,平均孕龄低于自然妊娠组,但自然妊娠组与辅助生殖组非整倍体发生率无显著性差异。随着女性年龄增加,不孕年限增加,接触外部环境污染机会增多,出现减数分裂错误率增加,卵子质量下降,胚胎非整倍体发生率增加[5]。而辅助生殖中男方精子数量、女方年龄、卵巢功能、用药方案、子宫内膜容受性及内膜厚度是影响妊娠结局的重要因素,以上因素中很多也是染色体异常的高危因素,但辅助生殖是否使染色体异常的风险增加尚无定论[6-8]。
有文献[9]报道引起自发流产最多的是16号三体,其次是21号三体和22号三体。本研究结果中16号三体最多72例,其次是22号三体34例和21号三体18例,与之前报道一致。此外,特纳综合征(45,X)病例大多数在胚胎期流产,只有少数可以存活,本研究共检出33例,也是常见的异常核型。本研究也对各种非整倍体类型的比例在两组流产绒毛中的差异进行了统计学分析,结果显示均无显著性差异。
本研究发现在早期流产的胎儿绒毛组织样本中,女性胚胎的比例与男性胚胎相比,差异无统计学意义(51.86%vs 48.14%,P>0.05),核型异常胚胎在两种性别胚胎中的比例差异也不显著。但有文献[10-11]报道早期流产的胎儿绒毛组织样本中女性胚胎比例明显高于男性,具体机制仍未知,可能是其他因素导致,也有可能是因为收集的样本数量有限,后续可能需要更大的样本量来证实。
综上所述,胎儿的染色体异常是临床上自然流产的主要诱因。如果能对流产的胚胎进行大规模的染色体非整倍体分析及相关的生化检测,将有效地提高优生优育工作的效率。本研究采用的CNVplex技术探针分布广,每条染色体设计5~8个探针,24条染色体共计170个探针,保证了染色体覆盖的广度和深度,使检测结果更精准,其操作更简便,快捷,通量高。该技术除可检测24种染色体数目异常,还可检测5Mb以上的缺失或重复,但CNVplex也存在一定局限性,例如无法检测到流产绒毛染色体中嵌合体的比例,多倍体以及平衡易位、倒位等染色体结构异常。但这些异常情况在流产样本中合计所占比例为10%~15%,可通过 CNVplex初筛后的其他成本高(如SNP-array)技术补充,以实现最高的检测成本效能比。近年基因芯片技术和高通量测序技术也被用来进行流产绒毛染色体的检测,这些新技术具有高准确性、高通量、高灵敏度等优点,不仅能够检测染色体非整倍体,还能够检测精细拷贝数变异(copy number variation, CNV)[12-15]。 这些技术的联合应用可以更为准确地诊断流产的遗传病因,更加有利于临床医生快速寻找流产原因,指导下次备孕。
