一种防PM2.5喷雾对空气污染致大鼠肺部炎症反应的保护作用研究
2018-08-13王月丹北京大学医学部基础医学院北京100191
初 明,王月丹 (北京大学医学部基础医学院,北京100191)
0 引言
2012年,联合国环境规划署公布的《全球环境展望5》中指出,每年有近200万的过早死亡病例与颗粒物污染导致的呼吸系统疾病有关。《美国国家科学院院刊》(PNAS)也发表了研究报告称,人类平均寿命因为空气污染已经缩短了约5年半[1]。2013年10月17日,世界卫生组织下属国际癌症研究机构首次指出大气污染对人类致癌,并明确了颗粒物是主要的环境致癌物。
颗粒物污染系悬浮在空气中的固体或液体颗粒物,因对生物和人体健康造成危害而得名。颗粒物种类很多,一般指 0.1~75 μm 的化学烟雾、煤烟、烟、尘粒、粉尘和雾尘。其中,PM2.5是指大气中直径小于或等于2.5 μm的颗粒物,也称为可入肺颗粒物,其直径还不到人头发丝直径的1/20。与较粗的大气颗粒物相比,PM2.5多为带正电荷的“阳离子”颗粒,粒径小,活性强,比表面积大,易附带有毒、有害物质,如重金属、微生物等,且在空气中停留的时间长,分散的距离远,因而对人体健康的影响更大。大量研究[2-10]表明,颗粒物直径越小,进入呼吸道的部位越深,直径10 μm的颗粒物PM10通常沉积在上呼吸道,直径小于2.5 μm 的颗粒物 PM2.5可深入细支气管和肺泡,直接影响肺的通气功能,造成肺组织的损伤,引起哮喘、肺功能下降、呼吸系统炎症,累及心血管系统、神经系统、免疫系统,并促进癌症的发生。PM2.5颗粒物污染不仅威胁人类的健康,而且对社会造成了巨大的经济负担。因此,结合科学研究,预防PM2.5迫在眉睫。本研究通过动物空气暴露试验研究一种防PM2.5喷雾对空气污染导致大鼠肺部炎症反应的保护作用。
1 材料和方法
1.1 实验动物无特定病原体(specific pathogen free,SPF)级的成年 SD大鼠,雄性40只,体质量343~395 g。实验动物均购于北京大学医学部实验动物科学部,动物合格证号:SCXK(京)2011-0012,常规饲养于北京大学医学部实验动物科学部的SPF级动物室,12 h光照,温度22~24℃,湿度(55%±15%)。
1.2 主要试剂一种防 PM2.5喷雾(专利号:ZL201410108955.9,由北京意嘉健康科技有限公司提供)[11],这种防 PM2.5喷雾能够在皮肤的表面形成正电场,通过静电排斥的原理有效减少PM2.5通过呼吸系统进入肺部;RNA提取试剂盒(美国Invitrogen公司);逆转录聚合酶链反应(polymerase chain reaction,PCR)试剂盒(美国 Invitrogen公司);Trizol试剂(美国Invitrogen公司);大鼠IL-4、IL-6和TNF-α的酶联免疫(ELISA)检测试剂盒(美国R&D公司)。
1.3 主要设备大气PM2.5吸入暴露装置(由北京大学环境科学与工程学院提供)[12]。装置的放置点距离北京市北四环西路1000米。北京市北四环西路是北京市的主干道,每日承载220 000辆机动车通行。室外大气经进气口导入染毒柜或洁净柜后排出,气流量 300~350 L/min。 气体进入染毒柜前经 PM2.5切割器滤除空气动力学当量直径≥2.5 μm的颗粒物,从而使进入染毒柜内的颗粒物直径<2.5 μm,且与外界PM2.5浓度保持一致;气体进入洁净柜前经 PM2.5切割器过滤再经高效空气过滤器(high efficiency particulate air filter,HEPA)滤除全部颗粒物,使进入洁净柜内的空气不含大气颗粒物。染毒柜与洁净柜内其他气态污染物浓度相同。其他主要设备包括便携式PM2.5检测仪(KHS-PMA,北京清风康华科技有限公司);酶标仪(Thermo MK3,美国 Thermo公司);正置荧光显微照相系统(BX53,日本 Olympus公司);NanoDrop One分光光度计(美国Thermo公司);实时荧光定量PCR仪(7500 Fast,美国Applied Biosystems公司)。
1.4 动物空气暴露实验按照不同处理方法设过滤空气-去离子水组(简称空气-纯水组)、空气-防 PM2.5喷雾组( 简称空气-喷雾组)、PM2.5-纯水组、PM2.5-喷雾组,每组10只,暴露时间为90 d。暴露点的空气PM2.5浓度采用便携式 PM2.5检测仪检测,每日 8:30、12:30 和 16:30 检测暴露点实时 PM2.5水平,取平均值与国家环境监测站的同期监测数据进行比较。空气-喷雾组和 PM2.5-喷雾组每日 8:30、12:30 和16:30对大鼠的口鼻及面部雾化喷雾10 s。空气-纯水组和PM2.5-纯水组以雾化纯水10 s处理。 其中,以空气-纯水组为阴性对照组,以PM2.5-纯水组为阳性对照组。
1.5 标本采集第91天,大鼠腹腔注射50 g/L戊巴比妥50 mg/kg。麻醉处死后,暴露气管,气管插管,结扎右肺叶,行左肺支气管肺泡灌洗,每次3 mL,重复3次,回收率约83%,收集大鼠BALF。取右肺中叶(未经灌洗),行4%多聚甲醛固定,并进行病理组织切片,HE染色,在光学显微镜下观察肺组织形态学变化。
1.6 BALF中炎症细胞因子含量检测采用ELISA法,检测BALF中IL-4、IL-6和TNF-α的含量。分别设标准品孔和待测样品孔,每孔分别加标准品或待测样品100 μL,混匀,37℃孵育 2 h;洗板 3 次,每孔加入100 μL生物素标记的抗体工作液(1∶10 000),37℃孵育1 h;洗板3次,每孔加入100 μL辣根过氧化物酶标记的亲和素工作液,37℃孵育1 h;洗板3次,每孔加入 90 μL底物工作液,37℃避光显色30 min后,每孔加50 μL终止液。反应终止5 min内酶标仪检测吸光度值,检测波长为450 nm。
1.7 肺组织中炎症细胞因子mRNA表达检测采用qPCR法检测大鼠肺组织中IL-4、IL-6和TNF-α的mRNA表达量。按照试剂盒说明书提取大鼠肺组织的总RNA,并进行mRNA反转录。基因引物由上海生工生物工程技术服务有限公司合成。基因引物序列如下。 IL-4:上游5’-CGA GCT CAC TCT CTG TGG TG-3’,下游 5’-GAA CGA GGT CAC AGG AGA A-3’;IL-6:上游 5’-GCT GGA GTC ACA GAA GGA G-3’,下游 5’-GGC ATA ACG CAC TAG GTT T-3’;TNF-α:上游 5’-GCC AGC CGA TGG GTT GTA-3’,下游 5’-GGT TGA CTT TCT CCT GGT ATG-3’;磷酸甘油醛脱氢酶(reduced glyceraldehydes-phosphate dehydrogenase, GAPDH):上游 5’-CTC ATG ACC ACA GTC CAT GC-3’,下游 5’-TTC AGC TCT GGG ATG ACC TT-3’。采用SYBR®GREEN染料法行qPCR反应,以2-ΔΔCt法计算目的基因相对于GAPDH的变化倍数作为目的基因表达的相对水平,以相对于空气-纯水组的变化倍数来比较组间差异。
1.8 统计学分析采用SPSS19.0软件进行统计学处理。正态分布计量数据采用±s表示,多组间连续计量资料的比较采用多因素方差分析,进一步的两两比较采用 LSD法。 P<0.05为差异有统计学意义[13]。
2 结果
2.1 PM2.5对大鼠 BALF中炎症细胞因子含量的影响实验实施期间(2014-12-01/2015-02-28),暴露点 PM2.5测得的浓度值范围为 68.2 ~228.4 μg/m3,平均 127.6 μg/m3。 空气暴露实验实施 90 d,与空气-纯水组比较,PM2.5-纯水组大鼠 BALF 中 IL-4、IL-6 和TNF-α 的含量明显升高(P<0.01)。 与 PM2.5-纯水组比较,PM2.5-喷雾组大鼠 BALF 中 IL-4、IL-6 和 TNF-α的含量明显下降(P<0.01)。 空气-纯水组与空气-喷雾组之间比较,差异无统计学意义(P>0.05,图1,表1)。
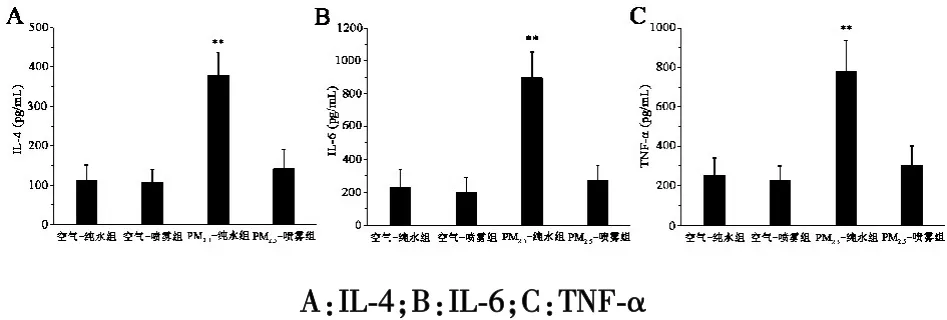
图1 PM2.5对大鼠BALF中炎症细胞因子含量的影响
表1 PM2.5对大鼠BALF中炎症细胞因子含量的影响(n=10,±s,pg/mL)
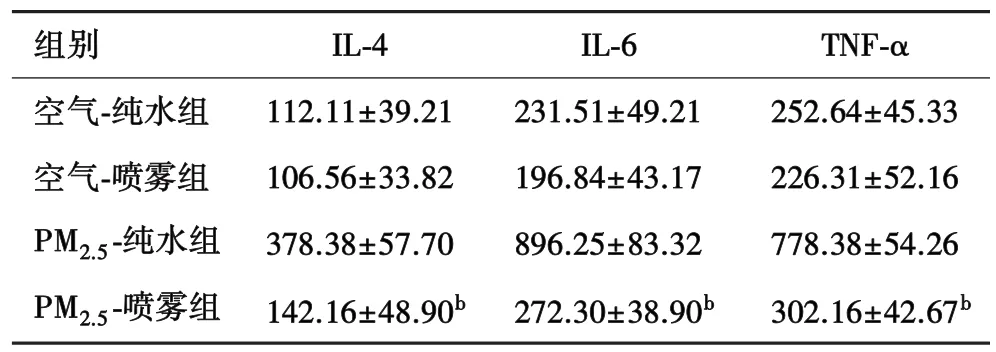
表1 PM2.5对大鼠BALF中炎症细胞因子含量的影响(n=10,±s,pg/mL)
bP<0.01 vs PM2.5-纯水组。
组别 IL-4 IL-6 TNF-α空气-纯水组 112.11±39.21 231.51±49.21 252.64±45.33空气-喷雾组 106.56±33.82 196.84±43.17 226.31±52.16 PM2.5-纯水组 378.38±57.70 896.25±83.32 778.38±54.26 PM2.5-喷雾组 142.16±48.90b 272.30±38.90b 302.16±42.67b
2.2 PM2.5对大鼠肺组织中炎症细胞因子 mRNA 表达的影响空气暴露实验实施90 d,与空气-纯水组比较,PM2.5-纯水组大鼠肺组织中 IL-4、IL-6 和 TNF-α的 mRNA 表达水平明显升高(P<0.01)。 与 PM2.5-纯水组比较,PM2.5-喷雾组大鼠肺组织中 IL-4、IL-6 和TNF-α 的 mRNA 表达水平明显下降(P<0.01)。 空气-纯水组与空气-喷雾组之间比较,差异无统计学意义(P>0.05,图 2)。
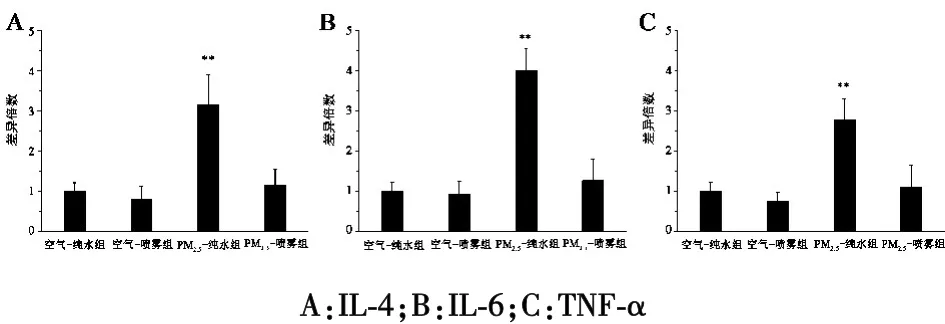
图2 PM2.5对大鼠肺组织中炎症细胞因子mRNA表达的影响
2.3 大鼠肺组织病理学改变空气暴露实验实施90 d,空气-纯水组、空气-喷雾组和 PM2.5-喷雾组大鼠肺组织结构正常。PM2.5-纯水组肺间隔增厚,肺间质大量炎症细胞浸润,肺泡间隔明显淤血(图3)。
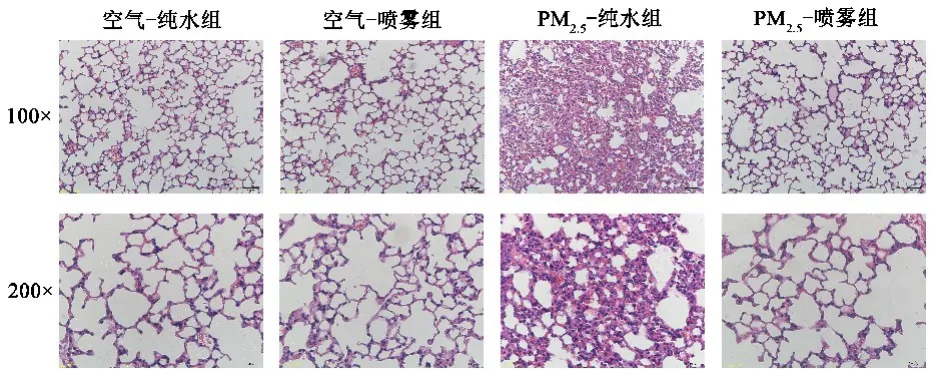
图3 大鼠肺组织病理学改变
3 讨论
PM2.5颗粒物,又称“可入肺颗粒物”,主要通过呼吸道进入人体。值得注意的是,PM2.5也可通过吸附在皮肤的毛孔中,导致皮肤炎症,特别是携带脂溶性有毒物质的PM2.5颗粒更容易通过皮肤进入人体。流行病学研究表明,长期暴露于空气污染物中的人群,其死亡率与空气污染物的浓度呈正相关。空气中的病毒、细菌、灰尘和烟雾等PM2.5颗粒物均带正电,负离子空气净化器即通过产生生态负离子中和沉降空气中的PM2.5颗粒物。在此基础上,本课题组研发了一种防PM2.5喷雾,其基本原理是在皮肤表面形成静电场,通过静电排斥的作用减少PM2.5颗粒物通过呼吸和皮肤进入机体,发挥保护作用[11]。本研究选用PM2.5空气污染物所致的SD大鼠肺损伤模型,探讨这种防PM2.5喷雾对空气污染导致大鼠肺部炎症反应的保护作用。
研究[14-15]发现,成年小鼠 PM2.5颗粒物暴露后出现气道高反应性和以嗜酸性粒细胞、中性粒细胞浸润为主的炎症反应,同时IL-4分泌增加,而IFN-γ的表达水平无明显变化,影响Th1/Th2的动态平衡状态,从而导致免疫系统功能异常。Th2细胞的过度活化会释放大量的细胞因子,包括 IL-4、IL-6和 TNF-α等,加重气道炎症反应[13]。本研究结果证明,大鼠长期暴露于PM2.5较高的环境下会导致肺部慢性炎症,肺组织中炎症细胞因子长期处于较高水平,引起肺间隔增厚、肺间质大量炎症细胞浸润及肺泡间隔淤血。值得注意的是,尽管PM2.5-喷雾组的大鼠同样长期暴露于 PM2.5较高的环境,但是在使用防 PM2.5喷雾进行干预后,未见明显的肺组织病理学改变,而且在大鼠的肺组织和BALF中炎症细胞因子的表达水平与暴露于洁净空气的大鼠相比,没有明显的差异,处于正常水平。这一结果证明了防PM2.5喷雾可明显抑制肺部的炎症反应,对肺部发挥保护作用。鉴于PM2.5颗粒物暴露不仅可造成肺组织的损伤,而且可累及心血管系统、神经系统、甚至导致癌症的发生。因此,我们需要进一步明确防PM2.5喷雾的保护作用,为全方面预防PM2.5颗粒物对人体造成的危害提供理论依据和可行方案。
