不同剂量和作用时间地塞米松对大鼠骨密度和成骨细胞作用的研究
2018-08-02吴丽婷蔡劲薇潘吉铭伍龙果梁敏
吴丽婷 蔡劲薇 潘吉铭 伍龙果 梁敏
广西医科大学第一附属医院内分泌科, 广西 南宁 530021
随着糖皮质激素的广泛应用,糖皮质激素性骨质疏松已经成为了最常见的继发性骨质疏松,以骨量快速丢失及骨折风险增加为特征[1-2]。风湿病患者使用糖皮质激素治疗后骨折风险明显增高[3-4],使用超生理剂量糖皮质激素治疗超过90天的患者骨密度(bone mineral density, BMD)明显下降,骨折风险增加[5]。研究认为在使用糖皮质激素初期,患者骨量丢失及骨折风险较长期持续使用糖皮质继续的患者高[6],另一项对使用吸入性糖皮质激素治疗≥1年的儿童与成人哮喘患者的研究发现,患者骨密度和骨折风险并无增加[7]。目前关于糖皮质激素应用剂量及疗程对骨骼代谢的影响尚有争议,本研究通过探讨不同剂量地塞米松干预不同时间对大鼠全身BMD及成骨细胞骨形成的作用,来阐明糖皮质激素剂量、疗程对骨代谢的影响。
1 材料与方法
1.1 实验动物及分组
3月龄雌性SPF级SD大鼠120只,购于广西医科大学实验中心,合格证号:SYXK 桂 2014-0003, 体质量210~250 g。按随机数字表法分为对照组(生理盐水组)、小剂量Dex组(Dex 1 mg/kg组)、中剂量Dex组(Dex 2.5 mg/kg组)、高剂量Dex组(Dex 5 mg/kg),每组30只。对照组肌内注射生理盐水,实验组分别肌内注射1 mg/kg、2.5 mg/kg、5 mg/kg的Dex,左右肢交替注射,2次/周,分别干预4 w、9 w、12 w。广西医科大学实验动物饲养房饲养,温度(22±1) ℃,湿度59%~61%,日夜昼律为12 h,自由摄食进水。
1.2 骨密度测定
使用PLODIGY型(Lunar公司)双能X线骨密度仪附带的小动物软件测定大鼠骨密度。干预前及干预后4 w、9 w、12 w,腹腔注射10%的水合氯醛3 mL/kg麻醉后测定大鼠全身骨密度。
1.3 免疫组化法检测骨组织ALP、I型胶原蛋白表达
干预4 w、9 w、12 w后处死大鼠,快速取右侧股骨近干骺端1/3部分,4%多聚甲醛(含1‰DEPC)固定24 h,每周2次更换10%EDTA脱钙液,共6周。脱钙结束后免疫组化SABC法检测ALP蛋白表达,显微镜(OLYMPUS BX53)下观察并选取3个视野,使用Image-ProPlus 图像分析系统分析阳性细胞数情况,并计算平均光密度值。
1.4 成骨细胞分离培养及鉴定
出生24 h的SD大鼠乳鼠(广西医科大学动物实验中心提供)颅骨中提取成骨细胞,采用酶消化法提取原代成骨细胞,差速粘附法去除成纤维细胞。分离的成骨细胞24 h贴壁生长,倒置显微镜下观察成骨细胞呈纺锤形,多边形,长梭形,包浆丰富,核仁清晰,含有1个明显核仁,有数个细胞突起,随着培养时间延长,成骨细胞规律性排列,呈放射性生长,符合成骨细胞的形态。采用碱性磷酸酶重氮盐染色法鉴定成骨细胞,发现细胞内有棕黑色细微颗粒,细胞阳性率95%,用PBS 代替底物的阴性对照中的细胞内无黑色颗粒。采用茜素红染色法钙结节结果提示分离的成骨细胞经茜素红染色呈橙红色。通过细胞形态观察、碱性磷酸酶染色和钙结节染色,证明分离培养的细胞具有成骨细胞的形态特征和分泌碱性磷酸酶、形成钙结节的生物学行为。
1.5 实验分组及处理
纯化的原代成骨细胞按每毫升2×104个细胞的密度接种96孔板,每孔100 μL,设置6个复孔。培养24 h待细胞贴壁后对细胞进行换液,并加入含有不同浓度(5×10-5mol/L、5×10-6mol/L、5×10-7mol/L、5×10-8mol/L)Dex的培养液100 μL干预成骨细胞12 h、24 h、48 h,对照组给予等体积培养液,空白组加入等量的PBS,一般位于96孔板的4 w。
1.6 CCK-8检测成骨细胞增殖
培养结束时每孔加入cck8 10 μL,37 ℃培养箱避光孵育1 h后用酶标仪测每孔的吸光值,空白组一般设为96孔培养板四周的PBS孔。避光孵育1 h后,将孔板置于酶标仪上,选择450 nm波长处测各孔吸收度,结果用A450表示。计算时将每个Dex药物浓度组细胞的6个复孔值去掉一个最大数值,去掉一个最小数值,剩余的4个数值取平均值表示该Dex药物干预组的吸光值。
1.7 RT-PCR检测成骨细胞ALP和I型胶原基因的表达
纯化的成骨细胞培养一定时间后,Trizol Reagent(美国Invitrogen 公司)提取细胞总RNA。采用一步法RT-PCR 试剂盒(日本Takara 公司)检测细胞ALP mRNA 表达。内参β-actin 和ALP 序列为:
ALP 上游序列:CACGTTGACTGTGGTTACTGCTGA;
下游序列:CCTTGTAACCAGGCCCGTTG,扩增长度158 bp。
I型胶原 上游序列:GACATGTTCAGCTTTGTGGACCTC;
下游序列:GGGACCCTTAGGCCATTGTGTA,扩增长度119 bp。
β-actin 上游序列:GGCACAGTCAAGGCTGAGAATG
下游序列:ATGGTGGTGAAGACGCCAGTA,扩增长度143 bp。
PCR反应条件:95 ℃预变性5 min,95 ℃变性15S,60 ℃退火30 s,72 ℃延伸1 min,共40个循环。
1.8 主要试剂
地塞米松磷酸钠注射液(1 mL∶ 5 mg,广东三才石岐制药有限公司),大鼠麻醉剂(10% 的水合氯醛),地塞米松(Sigma),焦炭酸二乙酯(DEPC),Trizol (Invitrogen 公司),逆转录试剂盒(Fermentas),DreamTaq Green PCR Master Mix (TaKaRa宝生物公司),免疫组化染色试剂盒(KIT-7720,迈新),CCK8试剂盒(日本同仁)。PCR 引物: 根据Gene Bank 中大鼠ALP、I型胶原(内参) 的基因序列设计引物,由宝生物工程(大连) 有限公司设计并合成。
1.9 统计学分析
2 结果
2.1 Dex对大鼠骨密度的影响
干预4 w,不同剂量Dex 组大鼠全身BMD与对照组相比均无差异(P>0.05)。干预9 w,不同剂量Dex 组大鼠全身BMD均低于对照组,差异有统计学意义(P<0.05),高剂量组大鼠BMD明显低于小剂量组(P<0.05)。干预12 w,不同剂量Dex 组大鼠BMD均低于对照组(P<0.05),高剂量组BMD明显低于中剂量和小剂量组(P<0.05)。见表1。
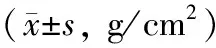
表1 不同剂量地塞米松组大鼠干预前后全身骨密度的比较Table 1 Comparison of BMD among the four groups before and after Dex intervention g/cm2)
注:▲与对照组相比P<0.05,#与高剂量组比较,P<0.05。
2.2 Dex对骨组织ALP和I型胶原蛋白表达的影响
干预4 w,不同剂量Dex 组大鼠骨组织ALP与I型胶原蛋白表达与对照组均无差异(P>0.05),见图1。干预9 w,小剂量Dex组大鼠骨组织I型胶原蛋白表达与对照组无差异(P>0.05),ALP蛋白表达低于对照组(P<0.05);中剂量和高剂量Dex 组骨组织的ALP及I型胶原蛋白表达明显低于对照组(P<0.05),见图2。干预12 w,不同剂量Dex组大鼠骨组织ALP及I型胶原蛋白表达均明显低于对照组(P<0.05),高剂量Dex 组骨组织的ALP、I型胶原蛋白表达显著低于中剂量和小剂量组(P<0.05),见图3。
2.3 Dex对体外分离培养的成骨细胞增殖的影响
分别采用5×10-5mol/L、5×10-6mol/L、5×10-7mol/L、5×10-8mol/L Dex作用于成骨细胞12 h、24 h及48 h。干预12 h,与空白对照组比较,5×10-6mol/L和5×10-5mol/L Dex均抑制成骨细胞的增殖(P<0.05),见表2;干预24 h及48 h后,不同浓度Dex均抑制成骨细胞的增殖(P<0.05),干预同一时间,成骨细胞增殖率随着Dex浓度的增加而下降,呈浓度依赖性,见表2;同一浓度Dex作用下,随着干预时间的延长,成骨细胞增殖率逐渐下降,呈时间依赖性,见图4。
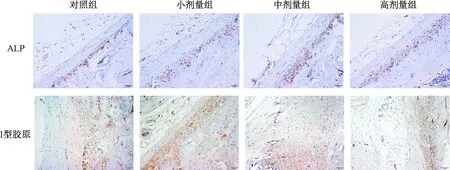
图1 干预4 w后ALP、I型胶原蛋白在不同剂量Dex组的表达(×200)Fig.1 Expression of ALP and type I collagen protein in different groups after treated with Dex for 4 weeks (×200).
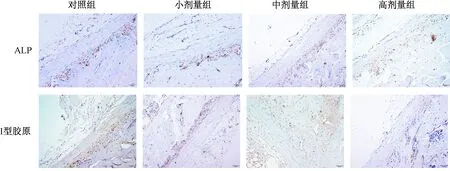
图2 干预9 w后ALP、I型胶原蛋白在不同剂量Dex组的表达(×200)Fig.2 Expression of ALP and type I collagen protein in different groups after treated with Dex for 9 weeks (×200).
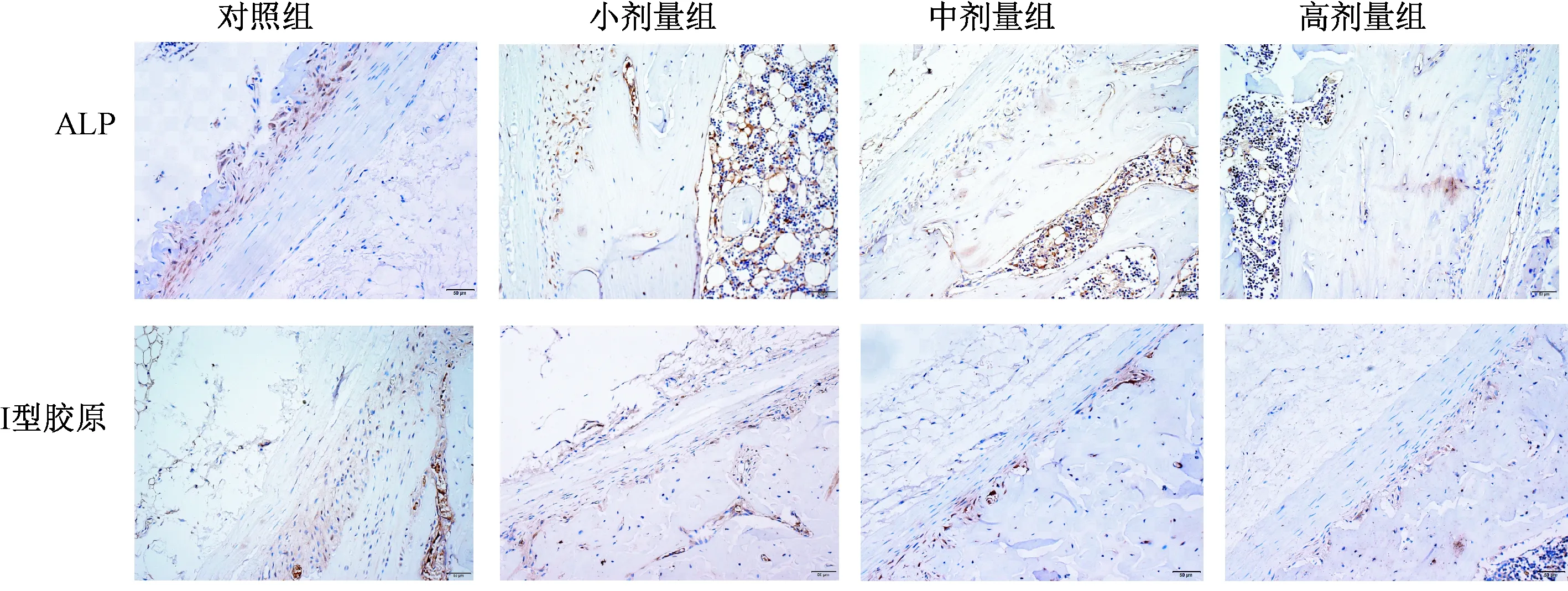
图3 干预12 w后ALP、I型胶原蛋白在不同剂量Dex组的表达(×200)Fig.3 Expression of ALP and type I collagen protein in different groups after treated Dex for 12 weeks (×200).
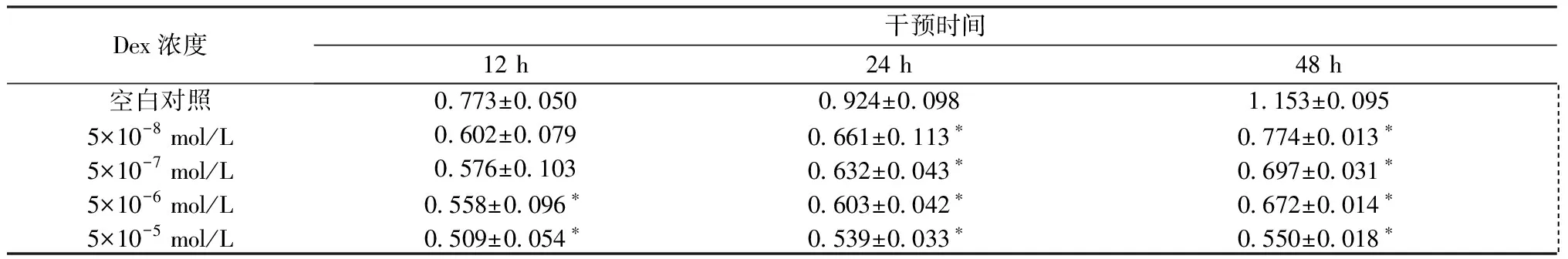
表2 不同浓度的Dex干预不同时间对成骨细胞增殖的影响Table 2 Effect of different concentrations of Dex on osteoblast proliferation in different courses.
注:*表示同一作用时间点的不同浓度地塞米松药物与空白对照比较,P<0.05。
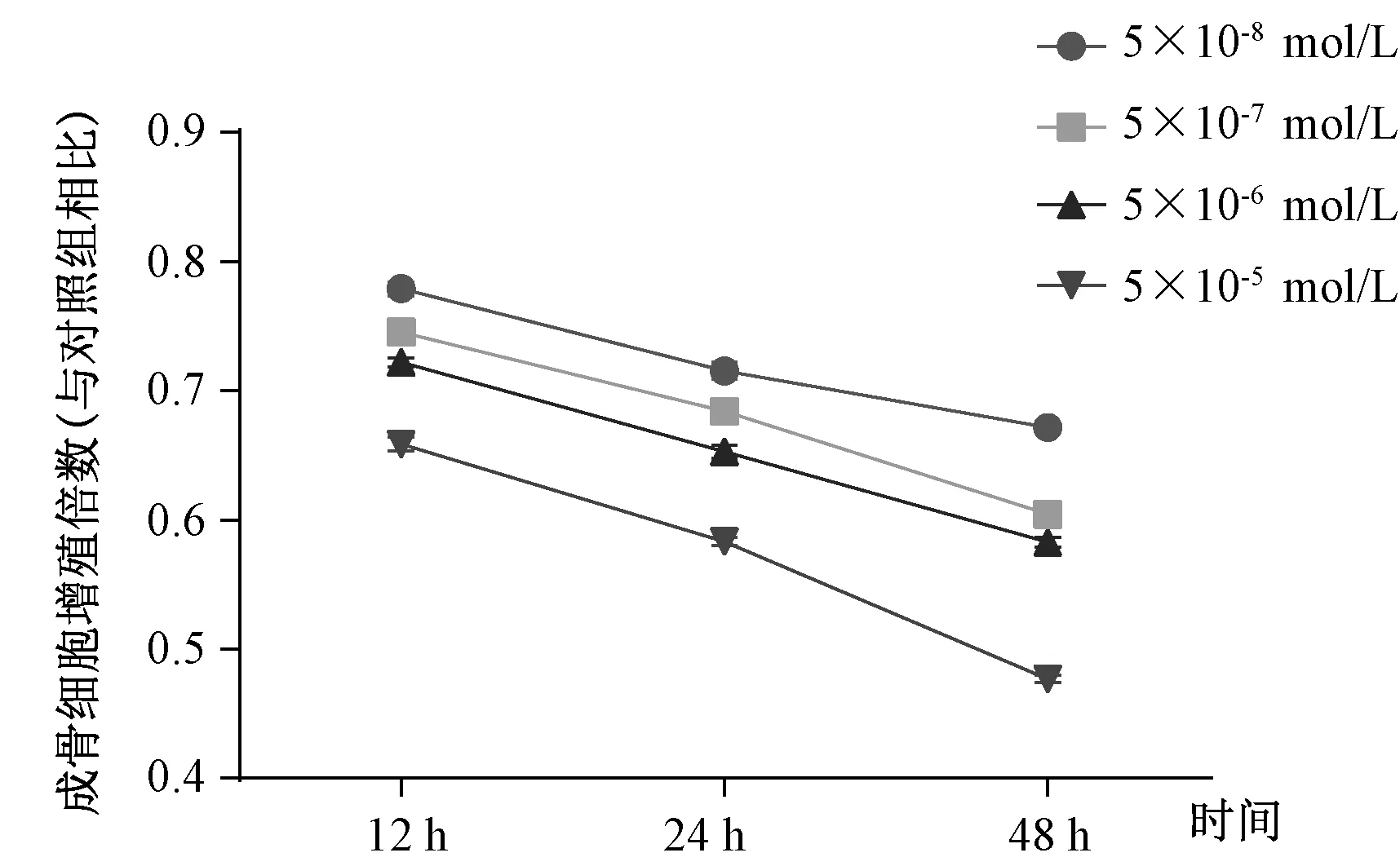
图4 不同浓度的Dex干预不同时间对成骨细胞增殖率的变化Fig.4 Effect of different concentrations of Dex on osteoblast proliferation in different courses.
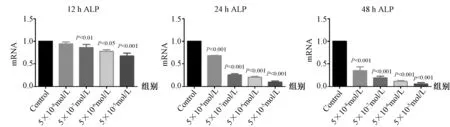
图5 不同浓度Dex干预不同时间对成骨细胞ALP mRNA表达的影响(与对照组相比)Fig.5 Effect of different concentrations of Dex on the expression of ALP mRNA in different courses (compared with the control group).
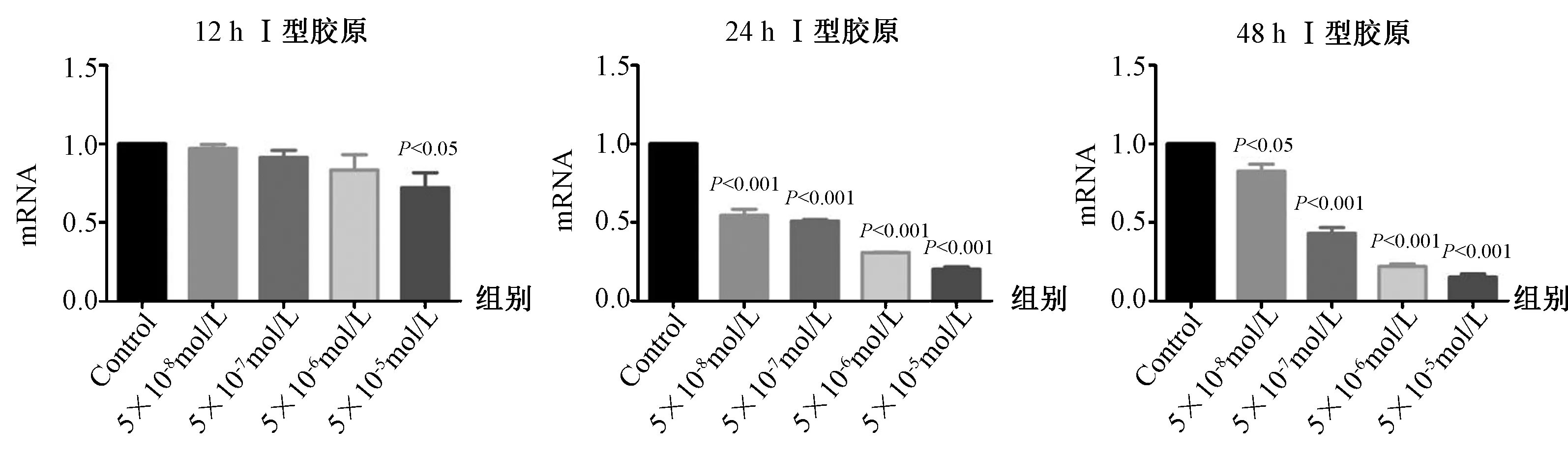
图6 不同浓度的Dex干预不同时间对成骨细胞骨形成指标 I型胶原mRNA表达的影响(与对照组相比)Fig.6 Effect of different concentrations of Dex on the expression of type I collagen mRNA in different courses (compared with the control group)
2.4 Dex对体外分离培养的成骨细胞ALP、I型胶原 mRNA表达的影响
分别采用5×10-5mol/L、5×10-6mol/L、5×10-7mol/L、5×10-8mol/L Dex作用于成骨细胞12 h,24 h及48 h。干预12 h,与对照组相比,5×10-8mol/L Dex组成骨细胞ALP mRNA表达与对照组无差异(P>0.05);随着Dex浓度的增加,ALP mRNA的表达逐渐降低(P<0.05),以5×10-5mol/L Dex组的成骨细胞ALP mRNA下降最明显(P<0.001),呈浓度依赖性,见图5;干预12 h,与对照组相比,5×10-5mol/L Dex组成骨细胞I型胶原mRNA表达低于对照组(P<0.05),其余浓度Dex组与对照组比较均无差异(P>0.05),见图6。干预24 h及48 h,不同浓度Dex组成骨细胞ALP、I型胶原 mRNA表达均低于对照组(P<0.05),在同一干预时间随着Dex的浓度增加,ALP及I型胶原 mRNA的表达逐渐降低(P<0.05),呈浓度依赖性,见图5~6。进一步观察Dex作用时间对ALP、I型胶原mRNA的影响,除5×10-8mol/L Dex组外,其他浓度Dex组均随着干预时间的延长,ALP及I型胶原 mRNA的表达均逐渐降低,以48 h时间点的抑制作用最强,呈时间依赖性(见图7~8)。
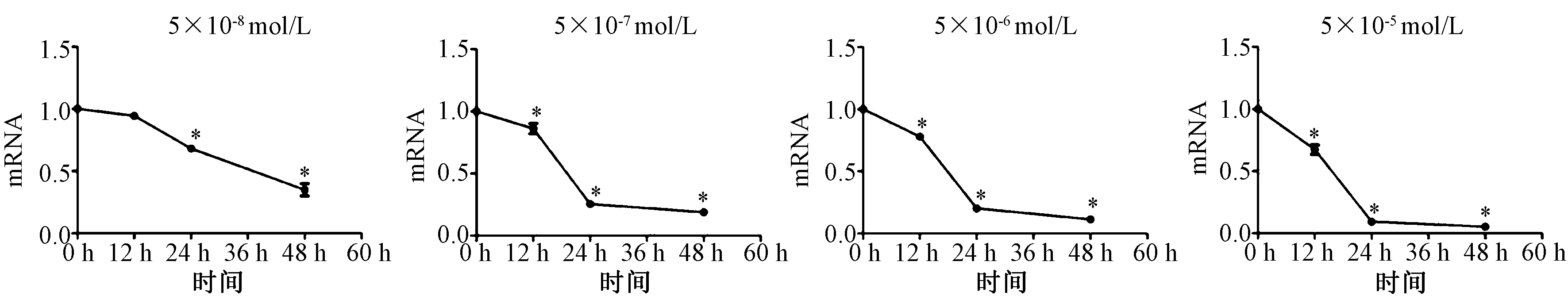
图7 同一浓度Dex干预不同时间对成骨细胞ALP mRNA表达的影响(*表示与对照组比较,P<0.05)Fig.7 Effect of the same concentration of Dex on the expression of ALP mRNA in different courses (*:Compared with the control group, P<0.05).
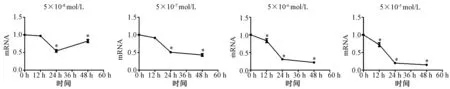
图8 同一浓度的Dex干预不同的时间对成骨细胞 I型胶原mRNA表达的影响(*表示与对照组比较,P<0.05)Fig.8 Effect of the same concentration of Dex on the expression of type I collagen mRNA (*: Compared with the control group, P<0.05)
3 讨论
GIOP作为第一位医源性所致的骨质疏松[8],可致骨量减少和骨微结构破坏,易发生脆性骨折[9]。糖皮质激素应用的剂量、时间、给药方式等均可能会对骨骼有不同影响,研究发现在多发性硬化症患者短期内应用大剂量糖皮质激素并未出现骨密度降低[10],长期应用糖皮质激素可导致骨吸收增加及骨形成减少,加快骨量丢失,出现骨密度下降[11]。本课题组前期以2.5 mg/kg Dex每周2次肌注,4 w后不同剂量Dex组大鼠骨密度与对照组相比无差异,9 w后各组大鼠骨密度均下降[12]。Ogoshi等[13]分别使用2 mg/(kg·d)及20 mg/(kg·d)的泼尼松龙对3月龄大鼠干预4 w,结果显示大鼠的骨小梁及皮质骨BMD并未下降。本研究结果也显示,Dex干预4 w内大鼠全身骨密度并未下降,骨形成无减少,这与本课题组前期发现是一致的[14],说明短期内Dex对大鼠的骨形成并未产生抑制作用,全身骨量无明显丢失。糖皮质激素对骨代谢影响有着强烈的时间、剂量依赖性[15],随着干预时间的延长,各剂量Dex均可导致大鼠全身BMD下降,骨形成明显减少,高剂量Dex 导致骨密度下降幅度及对骨形成的抑制作用均明显强于小剂量及中剂量Dex,本研究结果也表明糖皮质激素对骨形成及骨密度影响呈现时间和剂量依赖性,长期及大剂量应用糖皮质激素对骨形成抑制作用更强,骨密度明显下降。这也与“糖皮质激素并没有最低的安全剂量”观点是相符合的[16]。
有研究发现,糖皮质激素可抑制成骨细胞增殖[17],在10-9mol/L~10-5mol/L Dex干预24 h后,成骨细胞增殖随着浓度的增加而减少[18];国内研究也发现使用不同浓度Dex(10- 7mol/L、5×10- 8mol/L、10- 8mol/L)培养成骨细胞96 h后,在5×10- 8mol/L 和10- 7mol/L 浓度的Dex可抑制成骨细胞骨钙素基因表达和细胞增殖[19]。 在高浓度Dex作用下,成骨细胞的成脂活性增强,成骨细胞的增殖、骨形成活性明显受到抑制[20]。本研究结果与上述研究相似,仅干预12 h,最低浓度(5×10-8mol/L) Dex对成骨细胞增殖及骨形成并无抑制作用,但高浓度(5×10-5mol/L)Dex可抑制成骨细胞的增殖及骨形成;Dex干预24 h后,成骨细胞增殖和ALP、I型胶原mRNA 表达均呈浓度依赖性降低,表明短期内低剂量的Dex对成骨细胞增殖及骨形成未产生抑制作用,但随着剂量和时间的增加,Dex 对成骨细胞增殖及骨形成的抑制作用越来越强。而研究也发现,使用10-9mol/L~10-6mol/L浓度Dex干预骨髓间充质干细胞,ALP活性随着时间和浓度的增加越来越低,在干预最长时间及最高浓度时骨形成作用最弱[21],说明糖皮质激素呈时间和浓度依赖性地抑制成骨细胞增殖及骨形成作用。
综上所述,短时间、小剂量的Dex 对大鼠骨密度和骨形成无不良影响,但长期、高剂量的Dex可明显抑制成骨细胞增殖和骨形成,降低骨密度,导致了糖皮质激素性骨质疏松的发生。
