α-MEM培养基和高糖DMEM培养基对RAW264.7细胞向破骨细胞分化的影响
2018-08-02曾汝君马亚仙张郡罗云瑶谯小勇刘玲许良智
曾汝君 马亚仙 张郡 罗云瑶 谯小勇 刘玲 许良智*
1.四川大学华西第二医院妇产科,四川 成都 610041 2.四川大学华西第二医院西部妇幼研究院,四川 成都 610041
骨代谢包括骨形成和骨吸收两个基本过程,在生理状态下二者处于动态平衡中。破骨细胞由造血系统中的单核巨噬前体细胞分化而来,在骨吸收的过程中发挥着重要的作用[1]。小鼠破骨细胞前体细胞系RAW264.7细胞可分化为成熟且有功能的破骨细胞[2],因此被广泛作为研究破骨细胞结构及代谢过程的细胞模型[3]。
美国模式菌种收集中心推荐RAW264.7细胞的培养液为DMEM(high-glucose Dulbecco’s modified Eagle’s medium)[4-5]。但有关RAW264.7细胞培养的研究中,选择α-MEM(MEM Eagle,alpha modification)作为培养基也较为常见[6-10]。与DMEM高糖培养基相比,α-MEM培养基含有的氨基酸和维生素种类更为丰富,而DMEM培养基中葡萄糖及氨基酸浓度更高,这些差异都可能在不同程度上影响破骨细胞的增殖及分化能力,使得各研究结果难以进行横向比较。然而目前尚缺乏比较以上两种培养基对RAW264.7细胞向成熟破骨细胞分化结果的影响的研究,因此本实验拟用α-MEM和DMEM高糖培养基分别培养RAW264.7细胞,观察在促分化条件下RAW264.7细胞在不同培养基中细胞分化的能力,探究不同培养条件下破骨细胞前体细胞的分化能力。
1 材料与方法
1.1 材料
抗TRAP、NFATc1、Cathepsin K抗体购自美国Abcam公司,抗GAPDH、辣根过氧化物酶标记二抗购自中国成都正能抗体公司。重组鼠核因子κB受体激活蛋白配体(receptor activator for nuclear factor-κB ligand,RANKL)购自美国R&D公司。TRAP染色试剂盒购自美国Sigma公司。Trizol、逆转录试剂盒购自日本Takara公司。
1.2 细胞培养与诱导
小鼠破骨细胞前体细胞系RAW264.7(四川大学华西医院移植免疫实验室赠送)用含10%的胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的高糖DMEM培养基,在37 ℃、5%CO2饱和湿度的细胞培养箱中培养。
实验分为无RANKL的α-MEM培养基组(α-MEM组)、无RANKL的DMEM高糖培养基组(DMEM组)、加入RANKL的α-MEM培养基组(RANKL+α-MEM组)、加入RANKL的DMEM高糖培养基组(RANKL+DMEM组)4组。取对数生长期的RAW264.7细胞,按1.5×104/cm2接种于6孔板或10 cm培养皿,分别用α-MEM或DMEM高糖培养基培养,待细胞增殖至90%后,向其中两组加入RANKL,RANKL终浓度为50 ng/mL。于孵箱中培养72 h。
1.3 细胞分化相关标记物检测
1.3.1mRNA水平:采用Trizol提取各组细胞总RNA,取用逆转录试剂盒将其逆转为cDNA,通过qPCR分别检测抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)、活化的T细胞核因子(nuclear factor of activated T-cells 1,NFATc1)、核因子κB受体活化因子(receptor activator for nuclear factor-κB,RANK)以及组织蛋白酶(Cathepsin)K的mRNA表达水平。引物序列见表1。
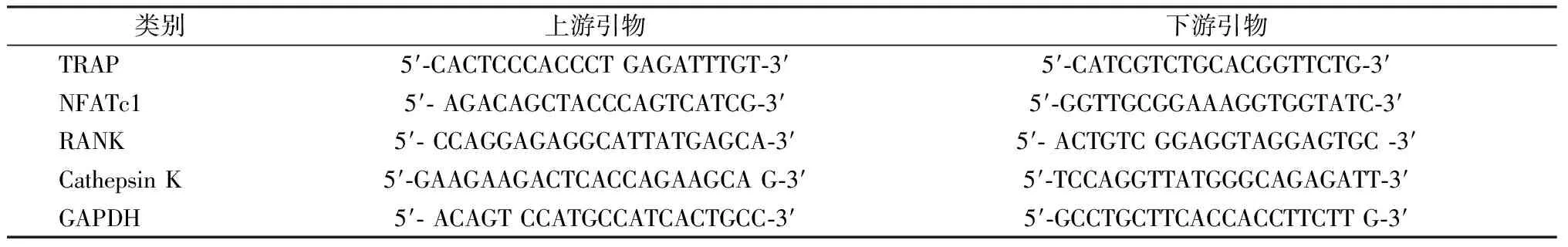
表1 目的基因引物序列
1.3.2蛋白质水平:分别检测RAW264.7细胞的TRAP、NFATc1和Cathepsin K蛋白表达水平。预冷PBS洗涤细胞2次,用RIPA(含1%PMSF)在冰上裂解细胞,收集裂解液在4 ℃、12 000 rpm离心20 min后取上清液,用BCA法定量总蛋白,各组取30 μg蛋白行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳后转膜至PVDF膜,用5%脱脂奶封闭,经相应一抗及二抗孵育,经化学发光法显影。
1.3.3细胞抗酒石酸酸性磷酸酶染色:RAW264.7细胞以1.5×104/cm2接种于玻片上,按上文实验方法分为4组,分别孵育72 h后,细胞用柠檬酸盐/丙酮溶液固定30 s,在以萘酚 AS-BI磷酸盐作为底物的混合液中避光孵育1 h(37 ℃),去离子水清洗,干燥后甘油明胶封片,显微镜下见TRAP阳性的多核细胞(细胞核≥3个)即为破骨细胞,各组分别行破骨细胞计数。
1.4 统计学处理
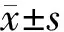
2 结果
2.1 破骨细胞分化相关标记物TRAP、NFATc1、RANK和Cathepsin K的mRNA表达水平
将破骨细胞前体细胞RAW264.7分别用加或不加RANKL的α-MEM、DMEM高糖培养基培养3 d后,通过qPCR分析TRAP、NFATc1、RANK以及Cathepsin K的mRNA表达水平(图1),加入RANKL后,DMEM组TRAP、Cathepsin K的mRNA表达无明显变化,NFATc1、RANK的表达减少,而α-MEM组的相关标记物的表达水平均增加。
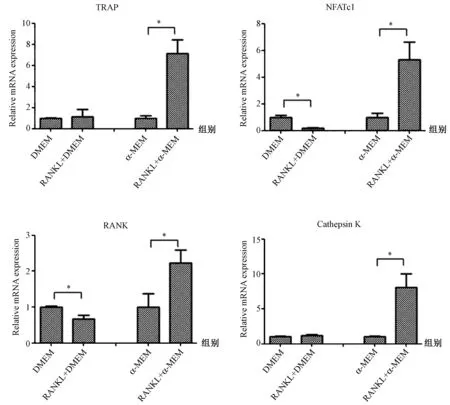
图1 两种培养基对RAW264.7细胞破骨分化相关标记物mRNA表达水平的影响(*P<0.05)Fig.1 Effects of the two kinds of media on the mRNA expression levels of osteoclast related markers in RAW264.7 cells(*P<0.05)
2.2 破骨细胞分化相关标记物蛋白表达水平
通过观察蛋白电泳条带(图2),结果显示RANKL+α-MEM组较α-MEM组细胞分化相关蛋白表达水平增加,而RANKL+DMEM组与DMEM组间则未见明显差异,这与qPCR的结果是基本一致的。
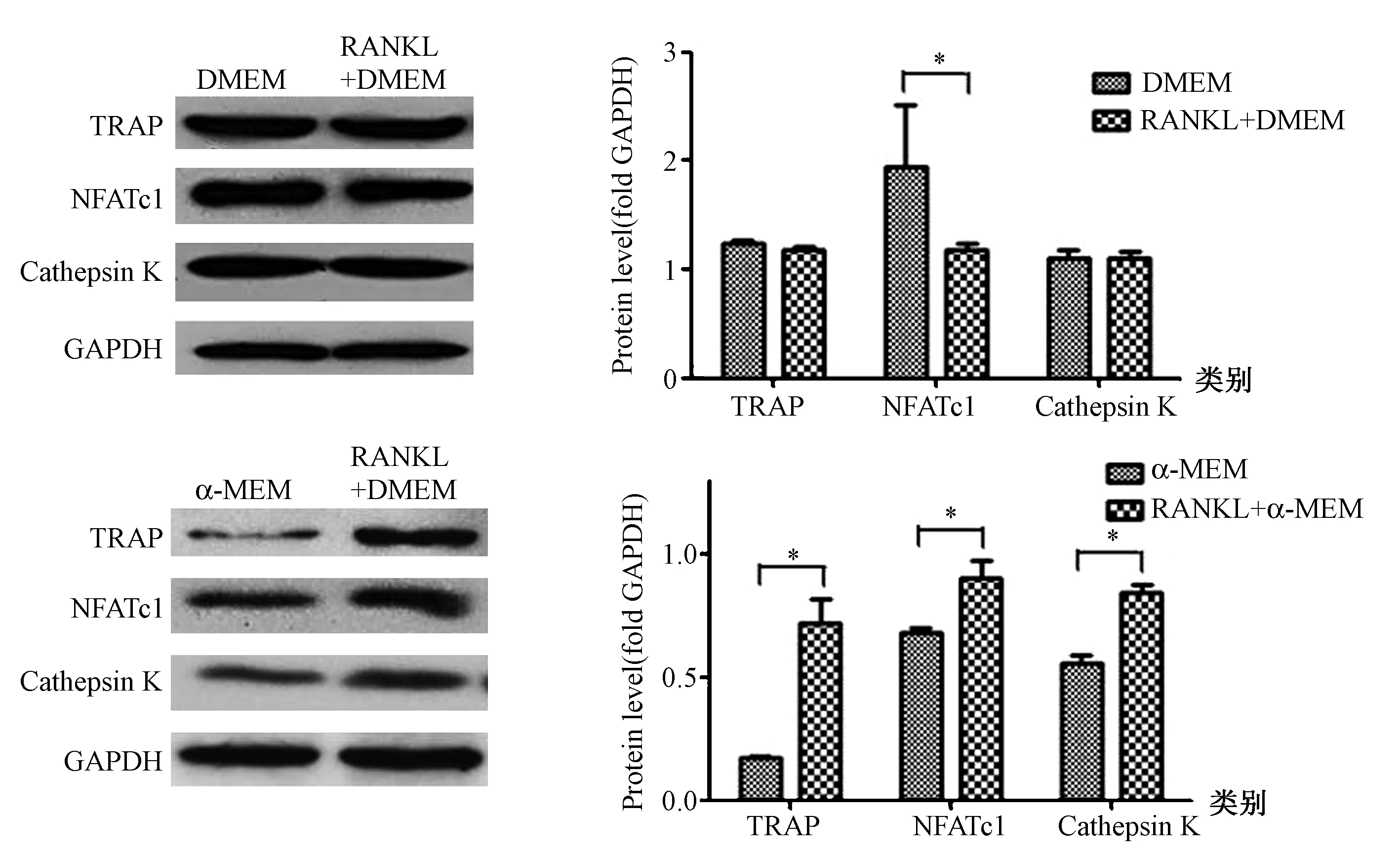
图2 两种培养基对RAW264.7细胞破骨分化相关标记物蛋白表达水平的影响(*P<0.05)Fig.2 Effects of the two kinds of media on the protein expression levels of osteoclast related markers in RAW264.7 cells(*P<0.05)
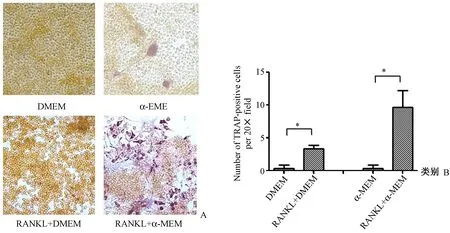
图3 两种培养基对RAW264.7细胞分化为成熟破骨细胞的影响(*P<0.05)。A:TRAP染色图片(×20);B:TRAP染色分析结果(×20)Fig.3 Effects of the two kinds of culture media on the differentiation of RAW264.7 cells into mature osteoclasts. A: TRAP activity staining (×20); B: Numbers of TRAP-positive cells per field (×20).
2.3 细胞TRAP染色
成熟的破骨细胞为多核巨细胞,可见伪足样胞浆突起,TRAP染色胞浆呈酒红色颗粒。经TRAP染色,当未加入RANKL时,两种培养基处理的细胞中均未见被染成酒红色的TRAP阳性细胞。加入RANKL后,两组细胞均可见TRAP阳性细胞,其中RANKL+α-MEM组可见更多的分化更为成熟的TRAP阳性细胞(图3)。
3 讨论
RAW264.7细胞系是研究骨吸收过程的重要细胞模型,然而不同培养基对其细胞贴壁、生长、老化等方面有着不同的影响,所以在细胞培养过程中选择合适的培养基是十分必要的。本研究发现,在促分化的条件下,与DMEM高糖培养基相比,RAW264.7细胞在α-MEM培养基中表达的破骨细胞分化相关标记物更多,形成的成熟破骨细胞更多,向破骨细胞分化的能力更强,这与刘水涛等[11]对人骨髓单个核细胞向破骨细胞分化研究的结果是一致的。
RANK/RANKL介导的信号通路是调控破骨细胞分化的重要通路。RANKL是成骨细胞表达的肿瘤坏死因子蛋白超家族成员之一[12],与存在于破骨细胞前体细胞表面的RANK结合后,可募集TRAFs激活下游信号,上调NFAT-c1的表达,促进破骨细胞分化[13]。Cathepsin K是破骨细胞功能性酶,在酸性条件下可参与降解I型胶原蛋白等细胞外基质[14]。TRAP是破骨细胞的特异性标志酶,可在酒石酸存在条件下将萘酚AS-BI磷酸盐水解为萘酚AS-BI,与显色剂结合形成红色沉淀,光镜下可见胞质内红色阳性颗粒,用于辅助鉴定破骨细胞。故此,本研究选择了TRAP、NFATc1、RANK以及Cathepsin K作为监测破骨细胞分化的标志,并行TRAP染色鉴定成熟的破骨细胞。本实验结果表明,促破骨细胞分化条件下,用α-MEM培养的RAW264.7细胞向破骨细胞分化相关基因的表达明显升高,且成熟破骨细胞形成明显,但DMEM高糖培养基中细胞的上述相关因子的表达未见明显变化或是有所降低,成熟破骨细胞形成不明显。说明各培养基中营养物质的成分及含量不同可能影响细胞的分化能力。
培养基的主要营养成分包括葡萄糖、氨基酸、维生素和无机盐。其中前3者在诱导RAW264.7细胞向成熟破骨细胞分化的过程中具有十分重要的作用。诱导破骨细胞分化的最优葡萄糖浓度为5 mmol/L,与α-MEM培养基中葡萄糖的浓度相当(约为5.5 mmol/L),而当环境中葡萄糖浓度升至20 mmol/L时(DMEM高糖培养基中葡萄糖浓度为25 mmol/L),细胞的分化效应则减弱[15]。这可能是由于高糖条件下肝X受体β可被激活,从而抑制破骨细胞的分化[16]。不同培养基中的氨基酸组成及含量也不相同,甘氨酸、谷氨酸、芳香族氨基酸(酪氨酸、苯丙氨酸和色氨酸)在各种培养基中普遍存在,其中芳香族氨基酸在DMEM高糖培养基中的含量(186 mg/L)高于α-MEM培养基(94 mg/L)。芳香族氨基酸具有抗氧化活性,可参与抑制破骨细胞贴壁及分化、减少骨髓间充质干细胞的氧化损伤[17]。Refaey等[18]报道芳香族氨基酸可减少破骨细胞分化相关分子的表达,抑制成熟破骨细胞形成,减少骨丢失。因此含有较少芳香族氨基酸成分的α-MEM培养基更能促进RAW264.7细胞向成熟破骨细胞分化。
目前发现维生素家族中的维生素C和维生素B12可能参与骨代谢,其在α-MEM培养基中的含量分别为50 mg/L和1.36 mg/L,而DMEM培养基则不含有此两种物质。上述两种维生素的缺乏可能与促进破骨细胞分化、自发性骨折相关[19-22]。但本实验中未含有这两种维生素的DMEM高糖培养基对破骨细胞原始细胞的促分化能力较弱,说明α-MEM与DMEM高糖培养基中其他成分的差异也可能对骨代谢存在影响。
相对高浓度的葡萄糖和芳香族氨基酸可能是本实验中DMEM高糖培养基促RAW264.7细胞分化效应较差、甚至可能抑制部分细胞分化相关基因表达的主要原因。与之相比,α-MEM培养基中葡萄糖和芳香族氨基酸含量则更为适宜。本研究表明,在探究RAW264.7细胞的性质及分化效能时,α-MEM是较为理想的促分化培养基。
