糠秕马拉色菌感染与寻常性银屑病患者血清炎性因子的关系研究
2018-07-02邓国辉杨国良
邓国辉,杨国良
寻常性银屑病(psoriasis vulgaris,PV)为炎性、免疫性皮肤疾病。寻常性银屑病病情迁延难愈,具有高复发性。白色鳞屑、发亮薄膜和点状出血是诊断银屑病的重要三联征[1]。银屑病发病机制尚不明确,有研究认为多种炎性因子在皮损组织处大量聚集可能与寻常性银屑病的发生有密切的关系[2]。近年有研究指出[3],真菌可作为交叉抗原或超抗原诱导银屑病的发生及病情进展,其中最常见的真菌为糠秕马拉色菌(Malassezia furfur)。糠秕马拉色菌为一种寄生在正常人体皮肤中的致病性酵母菌属,当宿主防御功能或皮肤微环境发生变化时,其可大量繁殖并引起多种皮肤疾病。其致病机制源于菌体对细胞脂质的分解,引起角质形成导致细胞形态学改变及凋亡。本研究应用酶联免疫吸附试验(ELISA)检测寻常性银屑病患者血清中糠秕马拉色菌特异性抗原,分析马拉色菌特异性抗原与寻常性银屑病患者血清炎性因子的关系,旨在探讨寻常性银屑病发病机制,为寻常性银屑病的防治提供临床资料。
1 资料及方法
1.1 临床资料
选择2014年5月―2015年12月68例寻常性银屑病患者为研究对象,其中男 36例,女32例,年龄22~78岁,平均(46.23±3.4)岁,病程1~15年,平均(9.8±1.2)年,进展期28例,缓解期 40例;另选取同期在本院行体格检查的35例健康体检者作为对照组,男 20例,女15例,年龄18~68岁,平均(45.2±2.8)岁,两组性别、年龄无统计学差异(P>0.05),具有可比性。研究对象纳入标准:①研究对象均符合《临床诊疗指南-皮肤与性病分册》、《临床操作指南-皮肤与性病分册》及《中国银屑病治疗指南》中对寻常性银屑病的诊断标准[4]。②所有患者纳入研究前2个月未接受过糖皮质激素、维A酸及免疫抑制剂等药物治疗;③所有研究对象近2个月未应用过任何治疗银屑病的外用药物;④所有研究对象均签署知情同意书。
1.2 方法
1.2.1 仪器及试剂 ELISA分析仪(瑞士Tecan Fame ELISA系统);超声粉碎仪(北京祥鹄智能有限公司);紫外分光光度计(北京普析通用仪器有限责任公司);ELISA板(上海邦景实业有限公司);羊抗人IgG、IgA、IgM(美国sigma公司);IL-8试剂盒(北京伯乐生命科学发展有限公司),TNF-α试剂盒[通蔚试剂(上海)有限公司],SP试剂盒(上海研卉生物科技有限公司),糠秕马拉色菌(菌株CBS7878,中国医学科学院皮肤病研究所提供)。
1.2.2 糠秕马拉色菌抗原制备 将糠秕马拉色菌菌株分别接种培养4 d后,采用PBS冲洗液对培养样本进行冲洗,将悬浮物离心处理并去沉淀物。按0.5 mg/ml制成真菌悬液,并分装于2个试管中,1个试管用于制备整菌抗原包被液,即为整菌抗原(Wag),1个试管在-20℃~37℃中反复冷融、加热后采用超声粉碎仪处理20 min,频率为18 000 Hz,以3 000 r/min离心处理30 min,留取上清液即为可溶性抗原(Sag),采用紫外分光仪测定蛋白质浓度。
1.2.3 血清炎性因子水平测定 研究对象空腹12 h抽取静脉血3 ml,3 000 r/min离心处理后留取上清液待检,采用ELISA法测定两组寻常性银屑病患者及对照组血清IL-8、TNF-α、SP,严格按试剂说明书操作,当日质控保证结果的有效性。
1.3 统计学方法
计量资料指标均进行正态性及方差齐性检验,符合正态分布的数据以均数±标准差(±s)表示,多组计量资料样本均数的比较方差分析,进一步两两分析采用SNK法检验,相关性分析采用Pearson相关分析,采用SPSS19.0软件包进行处理,以P<0.05具有统计学意义。
2 结果
2.1 两组寻常性银屑病患者及对照组抗体水平对比
3组抗Wag IgG水平、抗Sag IgM水平经方差分析均有统计学差异(P<0.05),组间两两比较经SNK法分析,寻常性银屑病进展期组、寻常性银屑病缓解期组及对照组抗Wag IgG水平依次降低,组间差异均具有统计学意义(P<0.05);寻常性银屑病进展组与寻常性银屑病缓解组抗Sag IgM水平比较差异无统计学意义(P>0.05),寻常性银屑病进展组、寻常性银屑病缓解组抗Sag IgM水平均低于对照组,差异有统计学意义(P<0.05);3组抗Wag IgA水平、抗Wag IgM水平、抗Sag IgG水平、抗Sag IgA水平经方差分析均无统计学差异(P>0.05),见表1。
2.2 寻常性银屑病患者及对照组血清炎性因子水平对比
两组寻常性银屑病患者和对照组血清炎性因子IL-8、TNF-α及SP经方差分析均有统计学差异(P<0.05),组间两两比较经SNK法分析比较,寻常性银屑病进展期、寻常性银屑病缓解期及对照组IL-8、TNF-α及SP均依次降低,组间差异均有统计学意义(P>0.05),见表2。
2.3 糠秕马拉色菌抗体与寻常性银屑病患者血清炎性因子的关系
糠秕马拉色菌抗体与寻常性银屑病患者血清炎性因子经Pearson相关性分析,抗Sag IgM水平、抗Wag IgG水平与血清IL-8、TNF-α、SP均呈正相关(P>0.05),差异均有统计学意义,见表3。
3 讨论
寻常性银屑病为临床常见的复发性皮肤病,分为寻常性、脓疱性、红皮病性及关节病性4种类型,其中寻常性银屑病占95%左右[5]。其发病机制尚未完全明确,有资料显示近30%寻常性银屑病患者具有家族遗传性[6]。近年研究证明T淋巴细胞介导的自身免疫异常与寻常性银屑病的发病及病情进展均有密切的关系[7,8]。微生物感染为机体免疫异常的重要诱因,正常寄生真菌诱发银屑病引起了临床的关注[9]。免疫抑制、温度改变及潮湿等因素均可引起真菌菌相转变,包括细胞表面抗原质或量的改变,菌丝的形成,菌毒力因子的改变,菌相的变化同时也是真菌的致病机制之一。Aydogan等[10]研究发现寻常性银屑病患者体内存在抗马拉色菌特异性IgG抗体。Gomez-Moyano等[11]研究也证明马拉色菌PO100、PO120结合位点为细菌或真菌胞壁中的N-乙酰葡萄糖胺残基(Glc-Nac)。李源等[12]研究进一步显示,抗Glc-Nac可与人角蛋白K14多肽产物结合,并生成K14蛋白。Honnavar等[13]发现在银屑病患者血清K14水平显著高于正常对照组。上述研究表明,糠秕马拉色菌与皮肤组织自身抗原发生的交叉反应与寻常性银屑病发病及病情进展过程关系密切。糠秕马拉色菌易引起皮肤浅表角质层和毛囊感染,导致角质层损伤,损伤皮肤的屏障功能,防御能力降低,在脂质作用下更容易发生炎性反应[14]。本研究结果显示,寻常性银屑病患者血清抗Sag IgM水平低于对照组,抗Wag IgG水平显著高于对照组,分析原因可能为抗Sag IgM水平与抗Wag IgG水平相互发生交叉作用,导致病原菌细胞免疫发生异常,与银屑病的发病机制相关。
表1 各组抗体水平比较 (±s,g/L)

表1 各组抗体水平比较 (±s,g/L)
注:PV:寻常性银屑病;与对照组相比,aP<0.05;与缓解期值相比,bP<0.05
PV进展期组 28 0.563±0.122ab 0.122±0.05 0.069±0.02 0.725±0.112 0.105±0.052 0.098±0.012a PV缓解期组 40 0.412±0.121a 0.118±0.06 0.062±0.05 0.742±0.119 0.098±0.052 0.096±0.010a对照组 35 0.312±0.112 0.119±0.08 0.064±0.07 0.756±0.121 0.106±0.048 0.145±0.082 F值 6.232 0.114 0.122 0.118 0.118 7.856 P值 0.000 0.856 0.893 0.896 0.836 0.000
表2 两组寻常性银屑病患者及对照组血清炎性因子水平比较 ( ±s,g/L)

表2 两组寻常性银屑病患者及对照组血清炎性因子水平比较 ( ±s,g/L)
注:PV:寻常性银屑病;与对照组相比,aP<0.05;与缓解期组相比,bP<0.05
PV进展期组 28 256.36±48.25ab 18.22±3.25ab 312.85±32.56ab PV缓解期组 40 128.96±32.52a 7.98±2.45a 285.69±30.48a对照组 35 52.63± 7.98 4.98±1.46 148.52±22.45 F值 12.963 9.145 15.252 P值 0.000 0.000 0.000
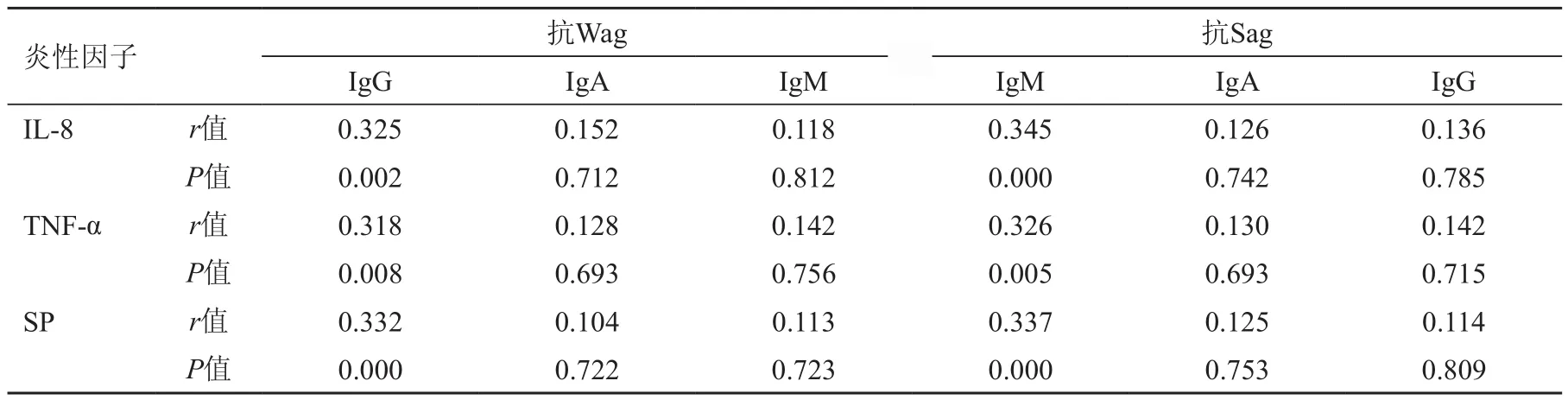
表3 糠秕马拉色菌抗体与寻常性银屑病患者血清炎性因子的关系
本研究显示,寻常性银屑病进展期、寻常性银屑病缓解期及对照组血清炎性因子IL-8、TNF-α及SP均依次降低,组间差异均有统计学意义。炎性因子网络失衡在银屑病发病过程中起到重要的作用,局部炎性细胞浸润,促使血管细胞增殖,导致皮损形成[15]。IL-8、TNF-α是由T淋巴细胞及角质形成细胞分泌,具有促使细胞增殖及角质形成的作用。同时IL-8参与激活或趋化中性粒细胞,TNF-α可促进血管新生[16]。TNF-α为先天性免疫炎症反应的关键因子,对巨噬细胞及记忆性T淋巴细胞有强烈的诱导作用,T淋巴细胞功能异常引发皮肤表层角质形成及细胞继发性增殖过度也是寻常性银屑病发病的关键所在。SP属于神经肽,可刺激角质形成及促进细胞增殖,调节免疫反应,并引起皮肤瘙痒[17],寻常性银屑病患者临床症状及体征均与炎性因子的大量聚集关系密切。国外研究指出[18],IL-8、TNF-α、SP等炎性因子在寻常性银屑病患者静脉血清中及皮损组织中含量显著高于正常人群,且与患者病情进展及转归有密切的关系。本研究结果也证实,寻常性银屑病患者中血清IL-8、TNF-α、SP水平显著高于正常人群,且进展期患者高于稳定期患者,与上述观点相符。本文研究数据提示炎性因子IL-8、TNF-α及SP在寻常性银屑病患者皮损处存在高浓度聚集现象,炎性因子与寻常性银屑病疾病的发生及进程关系密切。Abdel-Hamid等[19]研究认为,炎性因子的产生主要源自于皮损局部的异常分泌。但本研究结果显示,血清IL-8、TNF-α、SP水平与糠秕马拉色菌抗Sag IgM、抗Wag IgG水平呈正相关,这提示寻常性银屑病患者炎性因子的升高可能是由皮损意外的免疫细胞产生并在皮损处聚集的结果。同时研究数据也说明马拉色菌感染可能会导致机体免疫功能异常,并刺激炎性因子释放,寻常性银屑病患者机体免疫调节紊乱对寻常性银屑病发病及防治均有重要的临床应用价值。
综上所述,糠秕马拉色菌感染可能与寻常性银屑病的发病有着密切的关系,其作用机制可能与糠秕马拉色菌感染后引起体液免疫异常,促使机体炎性因子释放,使得炎性因子在皮损部位大量浓集有关。
[1] 蹇强, 姜文成, 李可心, 等. 马拉色菌相关疾病研究现状 [J]. 微生物学免疫学进展, 2013, 25(5):60-63.
[2] 尹斌, 冉玉平. 马拉色菌临床鉴定研究进展 [J].中华皮肤科杂志,2014, 47(12):912-914.
[3] 舒畅. 盐酸特比萘芬乳膏治疗面部脂溢性皮炎的临床疗效观察 [J].实用皮肤病学杂志, 2016, 9(3):183-185.
[4] 乌云塔娜. 蒙医辩证施治寻常银屑病88例疗效观察 [J]. 中国民族医药杂志, 2015, 7(7):29-30.
[5] 乔献伟. 银屑病患者血液学检验指标变化特点及临床诊治价值 [J]. 中国实用医刊, 2016, 43(15):108-110.
[6] 杜华, 许旭峰, 陈克明. 寻常性银屑病患者 BMD、ALP、Ca、P、TRACP-5b 的检测及其意义 [J]. 临床军医杂志, 2011, 39(6):1163-1165.
[7] Jagielski T, Rup E, Zió kowska A, et al. Distribution of Malassezia species on the skin of patients with atopic dermatitis, psoriasis,and healthy volunteers assessed by conventional and molecular identi fi cation methods [J]. BMC Dermatol, 2014, 8(7):96-98.
[8] 姚树, 朱红兰, 刘梅. 红皮病型银屑病 120 例临床分析 [J]. 中国皮肤性病学杂志, 2011, 25(10):764-765.
[9] 拓江, 路永红. 马拉色菌属的研究进展 [J]. 中国皮肤性病学杂志,2011, 25(1):66-68.
[10] Aydogan K, Tore O, Akcaglar S, et al. Effects of Malassezia yeasts on serum Th1 and Th2 cytokines in patients with guttate psoriasis [J].Int J Dermatol, 2013, 52(1):46-52.
[11] Gomez-Moyano E, Crespo-Erchiga V, Martínez-Pilar L, et al. Do Malassezia species play a role in exacerbation of scalp psoriasis [J]. J Mycol Med, 2014, 24(2):87-92.
[12] 李源, 李影, 周芳, 等. 部分炎症因子在银屑病与胰岛素抵抗相关性中的作用 [J]. 皮肤性病诊疗学杂志, 2014, 21(3):264-266.
[13] Honnavar P, Chakrabarti A, Dogra S, et al. Phenotypic and molecular characterization of Malassezia japonica isolated from psoriasis vulgaris patients [J]. J Med Microbiol, 2015, 64(3):232-236.
[14] 周春红, 张军民, 席丽艳. 寻常性银屑病hBD-2表达及与嗜脂性马拉色菌感染的相关性 [J]. 中国热带医学, 2009, 9(3):459-460.
[15] Dai YJ, Li YY, Zeng HM, et al. Effect of Yinxieling decoction on PASI, TNF-α and IL-8 in patients with psoriasis vulgaris [J]. Asian Pac J Trop Med, 2014, 7(8):668-670.
[16] 潘智慧, 王丽, 贾珍, 等. 银屑病患者骨髓基质细胞分泌转化生长因子β1、干细胞因子、角质形成细胞生长因子、肿瘤坏死因子α水平检测 [J]. 中华皮肤科杂志, 2012, 45(7):488-491.
[17] 唐新平, 勉闻光, 匡丽莎, 等. 2%酮康唑洗剂对炎热地区部队特发性瘙痒症患者疗效与生活质量的影响 [J]. 实用皮肤病学杂志,2017, 10(1):28-31.
[18] Wang CQ, Akalu YT, Suarez-Farinas M, et al. IL-17 and TNF synergistically modulate cytokine expression while suppressing melanogenesis: potential relevance to psoriasis [J]. J Invest Dermatol,2013, 133(12):2741-2752.
[19] Abdel-Hamid MF, Aly DG, Saad NE, et al. Serum levels of interleukin-8, tumor necrosis factor-α and γ-interferon in Egyptian psoriatic patients and correlation with disease severity [J]. J Dermatol, 2011, 38(5):442-446.
