PTEN在银屑病和皮肤非黑色素肿瘤中的表达和意义
2018-07-02李娅娣蔓小红尤立平张晓艳
李娅娣,蔓小红,尤立平,张晓艳
银屑病是一种由多基因遗传决定的、多环境因素刺激诱导的免疫异常性慢性炎症性增生性皮肤病。笔者前期研究发现,在银屑病皮损表皮中,磷脂酰肌醇-3激酶(phosphatidyl inositol 3 kinase, PI3K)的表达明显高于正常人及银屑病非皮损区表皮[1],磷酸化丝氨酸/苏氨酸激酶(serine/threonine kinase, Akt)的蛋白水平及Akt的激酶活性明显升高[2],提示银屑病的角质形成细胞(keratinocyte,KC)可能存在着PI3K/Akt信号传导通路异常活化。活化的Akt通过磷酸化其下游几个重要的靶蛋白:促Bcl-XL/Bcl-2凋 亡 因 子(Bcl-XL/Bcl-2-associated death promoter,Bad),Caspase-9,原癌蛋白核转录因子 κB(NF-κB),叉头蛋白O家族(forkhead box O subfamily,FoxO),哺乳动物雷帕霉素靶分子(mammalian target of rapamycin,mTOR),加速 KC增殖。PTEN(phosphatase and tensin homolog deleted on chromosome ten)是PI3K/Akt信号传导通路的负调因子,银屑病皮损内PI3K/Akt的异常活化是否是由PTEN的功能或表达的下调所致?另一方面,PTEN作为仅次于p53的第二大抑癌基因,主要通过负调控PI3K/Akt信号通路的方式发挥其抑癌作用。本研究收集银屑病、慢性湿疹、良恶性皮肤肿瘤(脂溢性角化、基底细胞癌、鳞状细胞癌皮损)以及正常人皮肤,采用免疫组化技术测定PTEN分布情况和蛋白水平,初步探讨PTEN与银屑病KC增殖的关系, PTEN在炎性增生性疾病与皮肤恶性肿瘤中的作用机制,以期揭示银屑病发生发展的机制,为治疗银屑病提供新的思路和新的靶向。
1 材料与方法
1.1 临床资料
19例寻常性进行期银屑病患者来自2007—2010年中日友好医院皮肤科门诊及住院确诊患者,男10例,女9例,年龄18~65岁,平均(33.83±9.48)岁,病程7 d~2年,平均4个月;19例患者银屑病皮损面积和严重度评分(PASI)为2.4~26.1分,平均(8.997±5.098)分。所有入选患者均需符合以下条件:近2个月无系统应用免疫抑制剂、糖皮质激素及维A酸类药物治疗史,近2个月无中波紫外线(UVB)或补骨脂素长波紫外线(PUVA)光照史,近2周无外用药物史;无内科疾病,血常规、尿粪常规、肝肾功能及其他生化指标均在正常范围。正常对照选择与银屑病患者性别、年龄相匹配的中日友好医院整形外科患者正常皮瓣18例,均无免疫系统疾病及相关家族史。其中男9例,女9例。两组在性别、年龄上差异无统计学意义(P>0.05)。本研究通过医院伦理委员会批准,遵照赫尔辛基宣言执行,患者签署知情同意书。
1.2 试剂
PTEN (C-term) RabMAb 抗体(美国Epitomics公司);β-肌动蛋白抗体 NO. ab3280(美国abcam公司);ChemMateTMDAKO EnVisionTM/HRP,Rabbit/Mouse(ENV)(美国Epitomics公司);DAB显色试剂盒(丹麦Dako公司);抗体稀释液(丹麦Dako公司)。
1.3 方法
银屑病患者按常规皮肤手术活检取典型皮损,对照组皮肤均来自整形外科手术切除的多余正常皮肤。置于10%的甲醛溶液,常规石蜡包埋。中日友好医院皮肤科苏木精-伊红染色(HE)病理诊断慢性湿疹、脂溢性角化、基底细胞癌、鳞状细胞癌各20例的蜡块,行免疫组化染色。常规石蜡切片,采用免疫组化SP法,操作步骤按说明书进行,所有切片染色均在同一质控条件下进行。阳性对照为扁桃体组织,PBS代替一抗做阴性对照。
1.4 图像处理
免疫组化切片采用日本NIKON公司的ECLIPSE 80i专业图像采集与分析系统进行分析。在相同条件下对同一批染色切片进行观察、图像采集,通过NIS-Elements3.0软件对所采集的图像中阳性部位(细胞核和细胞质中棕黄色颗粒为阳性表达)进行光密度(A)值的测定,每张皮肤组织切片在200倍光学显微镜下随机选取表皮部位各3处,计算阳性表达的平均A值,进行定量分析。
1.5 统计学方法
检测结果应用SPSS17.0软件做统计分析比较,所得数据符合正态分布的计量资料以均值±标准差(±s)表示,两组数据采用独立样本t检验进行分析,P<0.05确定为组间差异有统计学意义。
2 结果
PTEN染色阳性信号为棕色颗粒。PTEN定位于正常皮肤、银屑病皮损、慢性湿疹、脂溢性角化症、皮肤基底细胞癌、皮肤鳞状细胞癌表皮角质形成细胞的细胞核及胞质内。正常对照者表皮各层细胞核和胞质均见浓密的深棕色颗粒(图1);银屑病皮损表皮内可见稀疏淡染的棕色颗粒(图2);慢性湿疹表皮内各层细胞核和胞质内均见浓密的深棕色颗粒(图3);脂溢性角化症表皮内各层细胞核和胞质内均见浓密的深棕色颗粒(图4);皮肤基底细胞癌表皮内各层细胞及真皮内肿瘤细胞团块胞核和胞质内均见浓密的深棕色颗粒(图5);皮肤鳞状细胞癌表皮内各层细胞及真皮内肿瘤细胞团块胞核和胞质内可见稀疏淡染的棕色颗粒,个别细胞甚至无染色(图6)。
分别测定各个疾病组PTEN表达的平均A值,并进行统计学分析,发现银屑病皮损、皮肤鳞状细胞癌PTEN着色的A值分别为0.078±0.052、0.036±0.132,平均A值均低于正常皮肤(0.659±0.120),三者之间相比差异有统计学意义,其中皮肤鳞状细胞癌平均A值比银屑病皮损低。慢性湿疹、脂溢性角化和皮肤基底细胞癌中PTEN着色的A值分别为0.711±0.162、0.694±0.055、0.704±0.165,高于正常皮肤,四者之间差异相比无统计学意义。
3 讨论
PTEN蛋白是人类发现的第一个兼具脂质和蛋白质磷酸酶双重活性的新型抑癌基因。PTEN定位于染色体10q23,在肿瘤生长、细胞增殖分化和代谢、血管增生、细胞运动、核糖体生物合成、mRNA翻译等方面发挥着重要的调控作用[3]。PTEN通过抑制肿瘤细胞无休止增殖和诱导细胞凋亡发挥抑癌作用,在肺部、结肠、前列腺、乳腺、子宫内膜及脑部等众多肿瘤性疾病中PTEN可发生突变、缺失和表达下降[4]。然而,PTEN在银屑病皮损中的表达和功能研究,与皮肤良、恶性肿瘤之间的关系报道甚少。
本实验对免疫组化染色结果采用量化分析,较以往染色阳性细胞百分比方法更为精确。同一批次染色组织切片,相同曝光情况下采集200倍图像,利用专业图像分析系统对同一切片多部位进行光密度测定,取其平均值作为每个切片的A值,再用统计学方法进行比较分析。较之以前以阳性细胞数占比结果来比较免疫组化染色强弱更加精确和可重复性,实验结果更加可信。
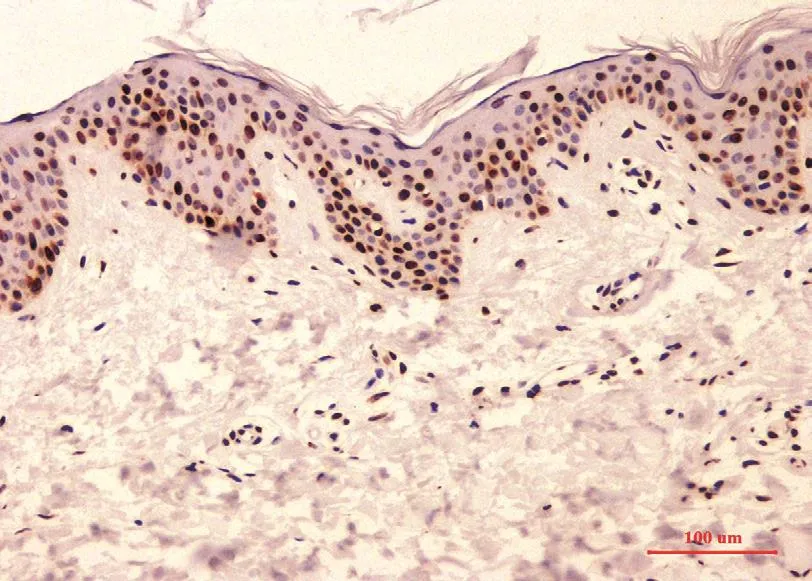
图1 正常对照表皮PTEN免疫组化组织病理(SP法×200)
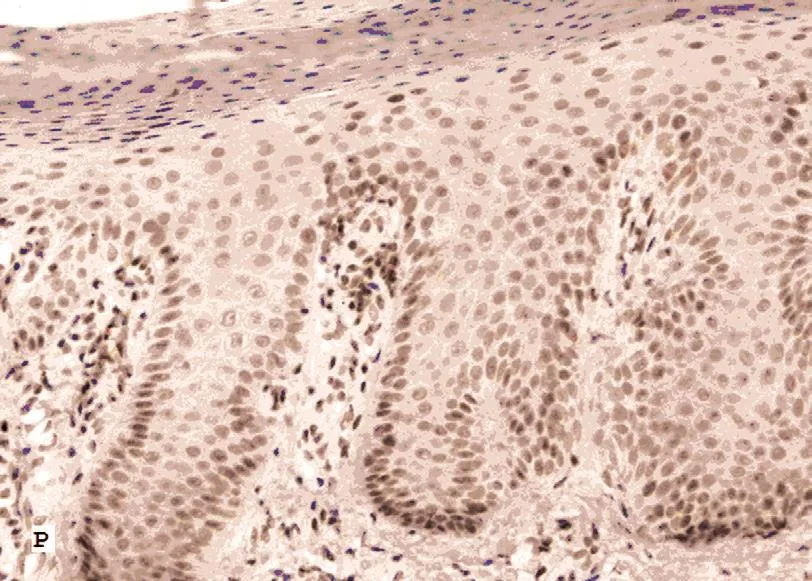
图2 银屑病表皮PTEN免疫组化组织病理(SP法×200)
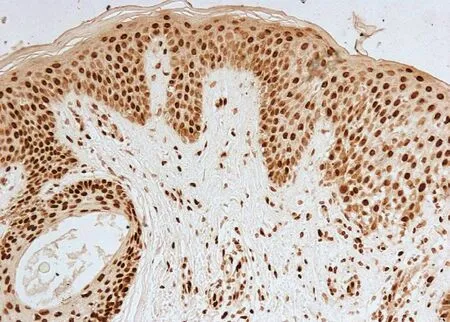
图3 慢性湿疹表皮PTEN免疫组化组织病理(SP法×200)
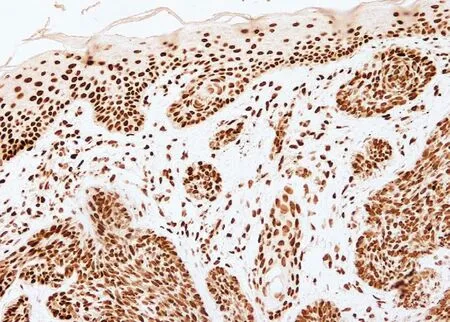
图5 基底细胞癌PTEN免疫组化组织病理(SP法×200)
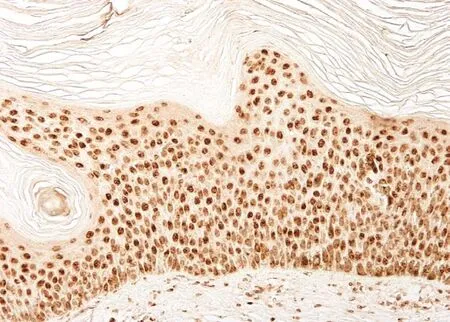
图4 脂溢性角化表皮PTEN免疫组化组织病理(SP法×200)
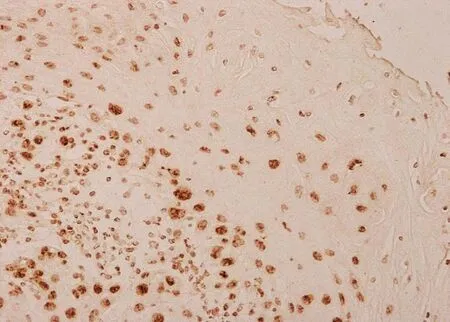
图6 皮肤鳞状细胞癌PTEN免疫组化组织病理(SP法×200)
笔者前期研究提示,银屑病皮损中PI3K/Akt通道调控细胞生长和增殖的关键性分子PI3K亚单位P110(PI3K-P110)特异性高表达[1],磷酸化Akt的蛋白水平与Akt的激酶活性明显升高[2],推测银屑病皮损中可能存在PI3K/Akt通路异常活化。PTEN在银屑病皮损中低表达的实验结果进一步说明,PI3K/Akt信号传导通路的上游PTEN表达低下,使本来PTEN致PIP3去磷酸化成为PIP2,逆转P13K的作用降低,继而Akt活性增强,引发PI3K/Akt通路过度活化。下游一系列靶蛋白级联反应:FOXO3失活,进而下调p27kip1和p130Rb2,上调cyclin D1表达[5],使细胞周期加速,促进细胞增殖。mTOR磷酸化水平升高,实验证明银屑病皮损内PI3K/Akt/mTOR信号传导通路活化使角质形成细胞过度增殖[6]。PTEN还可激活受体酪氨酸激酶(receptor tyrosine kinases,RTK),介导有丝分裂原蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,调控细胞生长和细胞周期。在银屑病中,PTEN缺乏致MAPK信号通路过度活化,引发细胞过度增殖和对凋亡诱导剂的敏感性下降[7]。
在良性炎症性表皮增殖性疾病如慢性湿疹和脂溢性角化症中,PTEN正常表达甚至略多于正常皮肤表达,提示这两种疾病表皮增殖机制与PTEN无关。已证实脂溢性角化症中PIK3CA,AKT1存在善意突变,无PTEN突变,发病与PI3K/PTEN/Akt信号传导通路无关[8]。低度恶性增殖性皮肤病变基底细胞癌中PTEN正常表达,说明与PTEN在众多人类肿瘤中缺失或突变导致其丧失抑癌作用不同。从蛋白水平看,PTEN似乎没有在皮肤基底细胞癌细胞增殖发展中起作用。研究发现皮肤基底细胞癌的分子发生机制是Hedgehog (Hh)传导通路异常活化[9]。然而,PI3K/Akt可与Hh通路一起协同作用致肿瘤生长发育[10]。因此,研究PTEN在皮肤基底细胞癌中的功能机制将对皮肤基底细胞癌发生发展具有重要意义。本研究测定显示,皮肤鳞状细胞癌PTEN低表达,与既往研究结果一致。人和小鼠的众多实验研究均证实PTEN在皮肤鳞状细胞癌中发挥重要的抑癌作用。体外人KC、体内皮肤肿瘤化学模型表明Cowden's患者皮肤鳞状细胞癌皮损内PTEN功能降低。小鼠敲除PTEN将会导致皮肤鳞状细胞癌[11]。Li等[12]研究显示,皮肤鳞状细胞癌中PI3K/PTEN/Akt通路活化促进肿瘤细胞生长、增殖、侵袭,抑制细胞凋亡。
本文实验结果示PTEN在银屑病和皮肤鳞状细胞癌皮损中均低表达,与多数肿瘤细胞中PTEN缺失有相似变化。但银屑病并不能导致肿瘤发生概率增加,或并不伴随肿瘤发生和发展。可能的原因一方面肿瘤发生是一个多重因素参与网络化的复杂的调控的过程,单一因素PTEN缺失不能导致肿瘤发生[13];另一方面也许银屑病中PTEN下调表达的数量不够低,不足以引起肿瘤发生。Yoshimoto等[14]证实PTEN蛋白表达水平的高低与肿瘤患者的病理分级及预后有关。患者恶性度越高,预后越差、PTEN蛋白水平越低。本文的实验结果也显示PTEN在皮肤鳞状细胞癌中表达更低于银屑病皮损中的表达量,推断PTEN在组织中含量低到一定量时才会导致肿瘤的发生和发展。
综上所述,PTEN可能在银屑病KC增殖方面发挥关键的作用。PTEN在银屑病中低表达,负调PI3K/Akt信号通路的作用减弱致PI3K/Akt信号传导通路异常活化,通过下游多个靶分子作用缩短细胞周期和促进细胞增殖生长,使银屑病不断发生发展。但需要更进一步的研究,如体外PTEN活性研究、PTEN基因转染、PTEN敲除动物模型等来揭示PTEN在银屑病KC过度增殖和异常凋亡中的确切功能,和其在皮肤肿瘤间的关系,对了解银屑病病因及寻找治疗药物有很大的帮助。
[1] 张晓艳, 马圣清, 柳惠图. 银屑病患者皮损中磷脂酰肌醇3激酶过表达 [J]. 中华皮肤科杂志, 2002, 35(2):97-98.
[2] 张晓艳, 周平, 尤立平, 等. 银屑病皮损表皮内Akt的激酶活性增强[J]. 中华皮肤科杂志, 2009, 42(6):413-416.
[3] Fumarola C, Bonelli MA, Petronini PG, et al. Targeting PI3K/AKT/ mTOR pathway in non small cell lung cancer [J]. Biochem Pharmacol, 2014, 90(3):197-207.
[4] Al fi eri R, Giovannetti E, Bonelli M, et al. New treatment opportunities in phosphatase and tensin homolog (PTEN)-de fi cient tumors: focus on PTEN/focal adhesionkKinase pathway [J]. Front Oncol, 2017, 7:170.
[5] Fatrai S, Elghazi L, Balcazar N, et al. Akt induces beta-cell proliferation by regulating cyclin D1, cyclin D2, and p21 levels and cyclin-dependent kinase-4 activity [J]. Diabetes, 2006, 55(2):318-325.
[6] Mitra A, Raychaudhuri SK, Raychaudhuri SP. IL-22 induced cell proliferation is regulated by PI3K/Akt/mTOR signaling cascade [J].Cytokine, 2012, 60(1):38-42.
[7] Steelman LS, Chappell WH, Abrams SL, et al. Roles of the Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR pathways in controlling growth and sensitivity to therapy-implications for cancer and aging[J]. Aging (Albany NY), 2011, 3(3):192-222.
[8] Hafner C, Toll A, Fernández-Casado A, et al. Multiple oncogenic mutations and clonal relationship in spatially distinct benign human epidermal tumors [J]. Proc Natl AcadSci USA, 2010,107(48):20780-20785.
[9] Saran A. Basal cell carcinoma and the carcinogenic role of aberrant Hedgehog signaling [J]. Future Oncol, 2010, 6(6):1003-1014.
[10] Filbin MG, Dabral SK, Pazyra-Murphy MF, et al. Coordinate activation of Shh and PI3K signaling in PTEN-de fi cient glioblastoma:new therapeutic opportunities[J]. Nat Med, 2013, 19(11):1518-1523.
[11] Ming M, He YY. PTEN: new insights into its regulation and function in skin[J]. J Invest Dermatol, 2009, 129(9):2109-2112.
[12] Li X, Huang K, Yu J. Inhibition of microRNA-21 upregulates the expression of programmed cell death 4 and phosphatase tensin homologue in the A431 squamous cell carcinoma cellline [J]. Oncol Lett, 2014, 8(1):203-207.
[13] You MJ, Castrillon DH, Bastian BC, et al. Genetic analysis of Pten and Ink4a/Arf interactions in the suppression of tumorigenesis in mice [J]. Proc Natl AcadSci USA, 2002, 99(3):1455-1460.
[14] Yoshimoto M, Cunha IW, Coudry RA, et al. FISH analysis of107 prostate cancers shows that PTEN genomic deletion is associated with poor clinical outcome [J]. Br J Cancer, 2007, 97(5):678-685.
