副溶血性弧菌vpa0166基因与耐药性相关性研究
2018-06-21,,,2,,2,,2
, , ,2,,2,,2
副溶血性弧菌(Vibrioparahemolyticus,Vp)属于弧菌科弧菌属,是一种嗜盐性细菌,革兰氏染色为阴性。Vp是最重要的食源性致病菌之一,据国家食源性疾病监测网数据显示近年来由副溶血弧菌引起的食物中毒居微生物食源性疾病之首[1]。溶血素是副溶血性弧菌的重要毒力因子,是一种胞外产物,起溶解红细胞的作用。其中耐热溶血素(thermostable direct hemolysin,TDH)、耐热相关溶血素(TDH-related hemolysin,TRH)、不耐热溶血素(thermoliable hemolsin,TLH)是主要致病因子,分别由tdh、trh、tlh基因编码。其中,tlh基因具有种属特异性,在临床分离株和环境分离株中都存在[2],虽然环境分离株神奈川现象(Kanagawa phenomenon,KP)较少见,但只要携带tdh或trh基因就可被认为是毒力株[3]。1996年起以O3∶K6血清型为代表的大流行株[4]在全球流行,其具有相同的基因型(tdh阳性,trh阴性,尿素酶阴性),orf8是噬菌体f237 10个开放阅读框(open reading frame,ORF)中独特的一个,与O3∶K6血清型菌株大流行有关[5],在超过96%的大流行株中存在。
随着抗菌药物在临床和水产养殖业的不合理使用,导致副溶血性弧菌的耐药程度日趋严重[6]。当耐药菌通过食物链传递到人类,将会导致临床用药的失效,从而严重威胁人类的健康。细菌抗药性产生的机制复杂而多样,目前研究的主要有靶位基因突变、外排泵作用及可移动基因元件等方面。其中由外膜蛋白(outer membrane protein,OMP)介导耐药性的产生是重要机制之一,包括外膜通透性的降低[7]和主动外排[8]两种机制。本研究对江苏省部分地区的副溶血性弧菌分离株进行了分子鉴定,包括毒力基因、大流行株标识基因及本实验室发现的推定外膜蛋白编码基因,测定了对8种常见抗生素的耐药性情况,并重点分析了VPA0166(编码推测外膜蛋白)的分子多样性与基因特征、耐药性的相关性,为寻找副溶血性弧菌的耐药机制提供重要线索,加强了对菌群的了解,有利于抗菌药物的合理使用和新药的开发。
1 材料与方法
1.1材料与试剂 副溶性弧菌标准菌株ATCC 33847(tdh+trh-)、大肠杆菌标准菌株ATCC 25922均由本实验室保存;166株副溶血弧菌菌株分离收集于2006-2014年江苏省部分地区海产品、熟食、医院肛拭子等不同来源,经VITEK 2-Compact全自动微生物鉴定为副溶血性弧菌。
TCBS琼脂、M-H琼脂和3% NaCl碱性蛋白胨水 北京陆桥技术有限公司;8种抗生素药敏纸片 杭州微生物试剂有限公司;PCR反应试剂 宝生物工程(大连)有限公司。
1.2仪器与设备 瑞士Kuhner Shaker公司ISF1-XC型恒温振荡培养箱;美国ABI公司Veriti PCR扩增仪;美国BIO-RAD公司Model 3000Xi型电泳仪;美国BIO-RAD公司GelDoc XR凝胶成像系统。
1.3 方法
1.3.1引物设计与合成 本研究选择种特异性基因不耐热溶血素(tlh)[2]鉴定副溶血性弧菌,vpa0166-1引物序列根据GenBank已发表的V.parahaemolyticusRIMD 2210633全基因组(登录号:BA000032.2)序列自行设计,另外,根据后期测序比对结果优化设计更小目的片段引物vpa0166-2。对毒力基因耐热溶血素(tdh)[9]、耐热相关溶血素(trh)[10]及大流行株标识基因(orf8)[5]进行检测,所有引物由上海生工生物工程股份有限公司合成。具体引物序列如表1所示。
表1 副溶血性弧菌PCR检测引物序列
Tab.1 Oligonucleotide primers for PCR
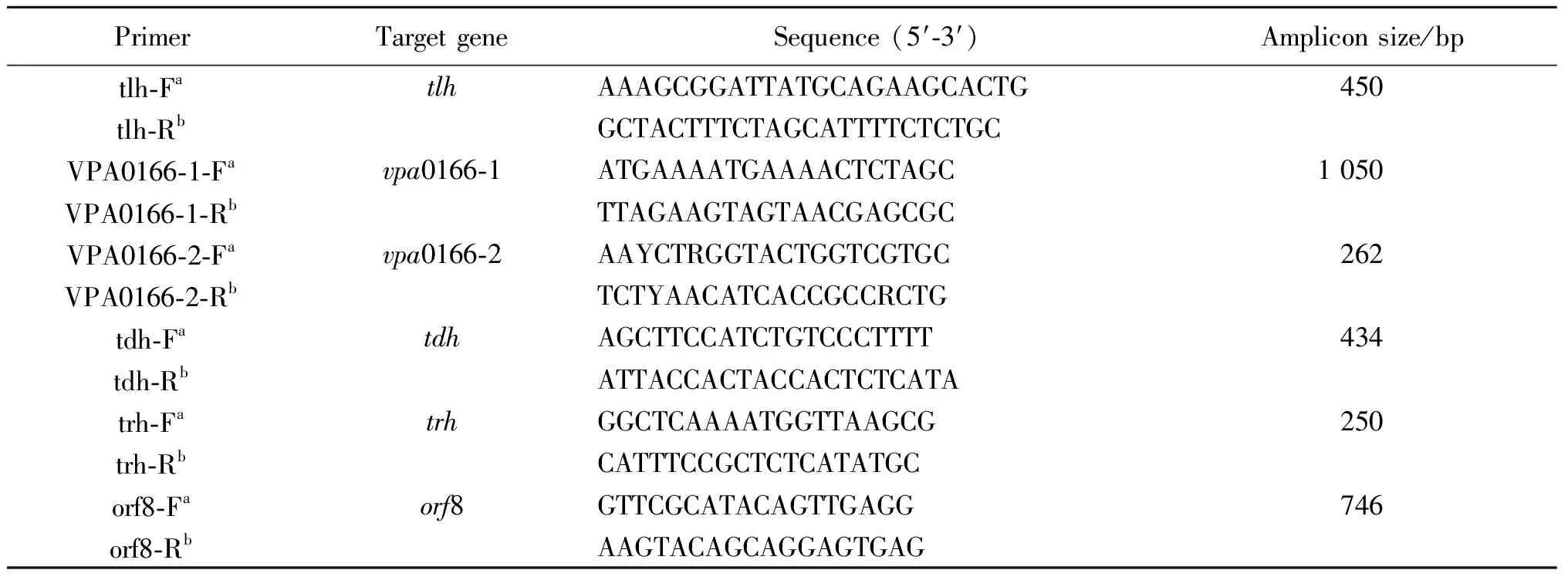
PrimerTarget geneSequence (5′-3′)Amplicon size/bptlh-FatlhAAAGCGGATTATGCAGAAGCACTG450tlh-RbGCTACTTTCTAGCATTTTCTCTGCVPA0166-1-Favpa0166-1ATGAAAATGAAAACTCTAGC1 050VPA0166-1-RbTTAGAAGTAGTAACGAGCGCVPA0166-2-Favpa0166-2AAYCTRGGTACTGGTCGTGC262VPA0166-2-RbTCTYAACATCACCGCCRCTGtdh-FatdhAGCTTCCATCTGTCCCTTTT434tdh-RbATTACCACTACCACTCTCATAtrh-FatrhGGCTCAAAATGGTTAAGCG250trh-RbCATTTCCGCTCTCATATGCorf8-Faorf8GTTCGCATACAGTTGAGG746orf8-RbAAGTACAGCAGGAGTGAG
注:a,上游引物;b,下游引物。
1.3.2PCR扩增 采用热裂解法粗提DNA:取新鲜培养物5 000 r/min离心5 min,用双蒸水洗涤菌体2次,弃上清,加500 μL双蒸水重悬菌体,100 ℃煮沸10 min;12 000 r/min离心10 min,取上清,-20 ℃保存备用。
tlh、tdh、trh、orf8基因PCR反应体系和扩增程序参考相应文献[2, 5, 9-10]进行PCR扩增;vpa0166基因PCR反应体积为25 μL,循环参数为:94 ℃预变性5 min;94 ℃变性30 s,48 ℃退火30 s,72 ℃延伸1 min,30循环;最后72 ℃再延伸7 min,反应结束。PCR产物用1.5%的琼脂糖凝胶电泳成像,拍照记录结果。
1.3.3vpa0166基因扩增产物测序 将PCR反应产物送南京金斯瑞生物科技有限公司测序,将测序结果用BLAST、BioEdit等软件参照GenBank(http://www. ncbi.nlm.nih.gov)数据库中已发表的V.parahaemolyticusRIMD 2210633 chromosome 2全基因组(登录号:BA000032.2)中相应序列比对分析。
1.4药敏试验 参照美国临床实验室标准协会CLSI推荐[11]的纸片扩散法(Kirby-Bauer)测定菌株对8种抗生素的敏感性。挑取TCBS平板上培养18-24 h的单菌落接种3% NaCl碱性蛋白胨水,37 ℃、120 r/min振荡培养6~8 h,以无菌生理盐水调节菌液浓度至0.5麦氏浓度(OD625=0.08~0.13,约含1~2×108CFU/mL)。取100 μL菌悬液涂布于直径90 mm,厚度4 mm的M-H琼脂平板(约25 mL)上,静置15 min后用灭菌镊子把药敏纸片平贴,并轻压纸片使其与培养基紧贴不掉落,平皿边缘距离纸片中心应大于15 mm,纸片之间的间距应大于24 mm,每种抗生素贴3个药敏纸片。37 ℃培养16~18 h后用游标卡尺测量抑菌圈直径,同时以大肠杆菌ATCC 25922做质控。
1.5相关性分析 采用SPSS 16.0软件对166株副溶血性弧菌菌株的耐药性进行统计学分析。
2 结 果
2.1tlh、tdh、trh、orf8和vpa0166基因的PCR检测结果 按所建立的DNA模板提取方法和PCR方法进行PCR扩增,扩增结果如图1所示。种特异性引物tlh基因阳性的菌株在450 bp处出现特异性扩增条带,166株副溶血性弧菌菌株均出现tlh基因阳性条带;毒力基因tdh、trh阳性率分别为21.1%(35/166)、9.6%(16/166),大多分布于临床株;大流行株标识基因orf8检出率为17.5%(29/166),且orf8+菌株都为tdh+;编码推测外膜蛋白基因vpa0166均为阳性,从电泳图上可以看出该基因结果具有多样性,呈现a型和b型两个形态,有86株是a型阳性,80株是b型阳性。

注:M,DL2000 DNA Marker;N,阴性对照;1~5,副溶血性弧菌分离株图1 副溶血性弧菌菌株tlh、tdh、trh、orf8和vpa0166基因的PCR检测结果Fig.1 Detection of tlh, tdh, trh, orf8 and vpa0166 gene of V. parahaemolyticus isolates by PCR

图2 vpa0166基因a型和b型扩增产物测序结果Fig.2 Sequencing result of type a and b amplified products of vpa0166
2.2vpa0166基因测序结果分析 通过测序结果与GenBank中已报道的序列对比分析发现,a型和b型序列同源性为94%,其中a型产物中在523至580 bp之间有54个碱基缺失,见图2。b型序列与GenBank中登录的BA000032.2相应序列同源性为99%,表明b型菌株与测序菌株在进化上更接近。毒力基因与vpa0166多样性相关性分析发现,vpa0166多样性与毒力基因的携带没有显著的相关性,但是tdh+trh-orf8+菌株均属于b型,大部分tdh-trh+orf8-菌株属于a型。
2.3药敏试验结果 用8种常见抗生素对166株副溶血性弧菌菌株进行药敏试验,总体耐药情况见表2。结果显示对头孢西丁和四环素耐药率为3%(5/166),头孢噻肟、庆大霉素和复方新诺明耐药率分别为3.6%(6/166)、5.4%(9/166)、1.8%(3/166)。多重耐药分析结果显示多重耐药现象不突出,仅有5株耐2种抗生素以及3株耐3种抗生素,其中有1株菌株对四环素和复方新诺明同时完全耐药(药敏试验无抑菌圈),该菌株基因型为tdh-trh-orf8-,分离自无锡市。对同类抗生素的耐药性有很大不同,如喹诺酮类的环丙沙星和萘啶酸敏感率分别为51.8%(86/166)、100%(166/166);β-内酰胺类的头孢西丁和头孢噻肟敏感率分别为6%(10/166)、81.9%(136/166),所有菌株对氯霉素均敏感。
表2 166株副溶血性弧菌药敏试验结果
Tab.2 Drug resistance of V. parahaemolyticus strains

DrugSensitive% Intermediarysensitive%Resistant%QuinolonesCiprofloxacin8651.88048.200Nalidixic acid1661000000β-lactamsCefoxitin1061519153Cefotaxime13681.92414.563.6AminoglycosidesGentamicin1519163.695.4ChloramphenicolsChloramphenicol1661000000TetracyclinesTetracycline15090.4116.653SulfonamidesSulphamethoxazole/tri-methoprim 19:11619721.231.8
2.4耐药性与vpa0166基因型相关性分析 2006-2014年菌株对环丙沙星的耐药性未出现明显波动,中敏感率在32.3%~53.6%之间。不同来源株耐药分析显示,临床株和环境株对环丙沙星的中敏感率分别为46.6%(27/58)、49.1%(53/108)。菌株毒力基因携带与环丙沙星的敏感情况无必然联系,tdh+trh-/tdh-trh+、tdh-trh-型对环丙沙星中敏感率分别为56.9%(29/51)、44.3%(51/115)。对8种抗生素的药敏性与vpa0166多样性的相关性分析结果如表3所示。结果表明菌株vpa0166多样性仅对环丙沙星的敏感率存在统计学差异(P<0.05),同时有部分a型菌株对环丙沙星表现中介耐药,也有部分b型菌株表现为敏感,表明Vp对环丙沙星耐药性产生过程中存在其他机制共同作用。
表3 vpa0166基因a型和b型耐药性比较结果
Tab.3 Comparison result of type a and b drug resistance of vpa0166
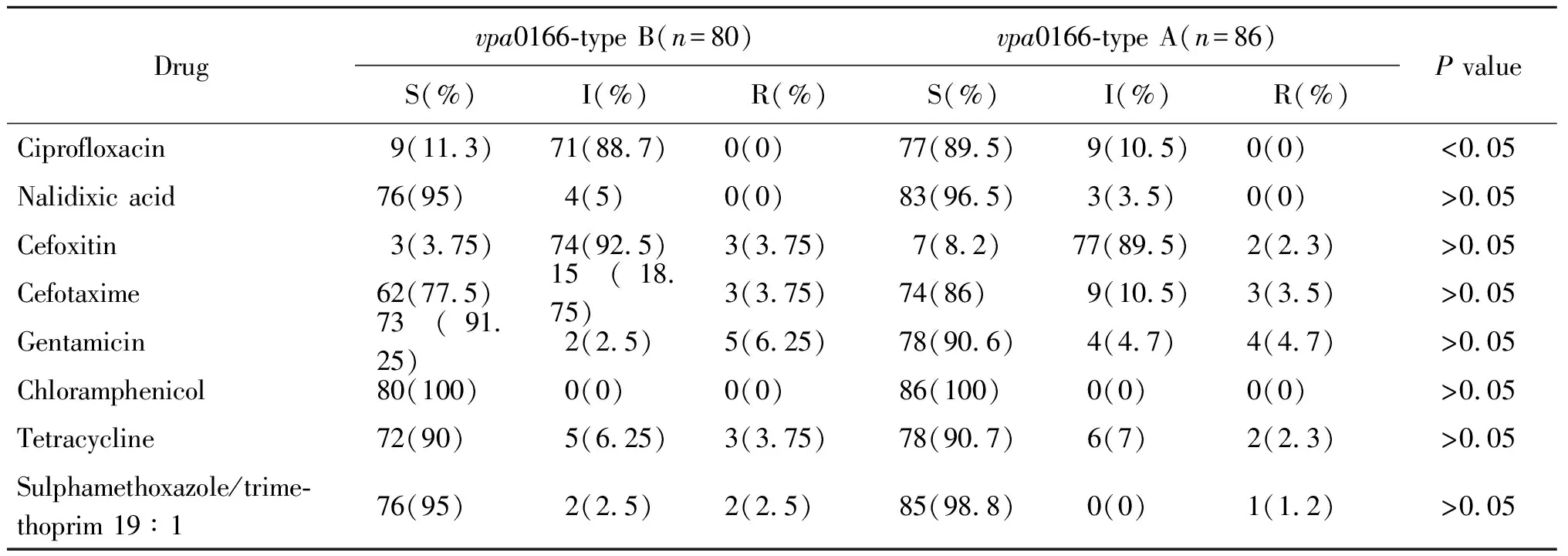
Drugvpa0166-type B(n=80)vpa0166-type A(n=86)S(%)I(%)R(%)S(%)I(%)R(%)P valueCiprofloxacin9(11.3)71(88.7)0(0)77(89.5)9(10.5)0(0)<0.05Nalidixic acid76(95)4(5)0(0)83(96.5)3(3.5)0(0)>0.05Cefoxitin3(3.75)74(92.5)3(3.75)7(8.2)77(89.5)2(2.3)>0.05Cefotaxime62(77.5)15(18.75)3(3.75)74(86)9(10.5)3(3.5)>0.05Gentamicin73(91.25)2(2.5)5(6.25)78(90.6)4(4.7)4(4.7)>0.05Chloramphenicol80(100)0(0)0(0)86(100)0(0)0(0)>0.05Tetracycline72(90)5(6.25)3(3.75)78(90.7)6(7)2(2.3)>0.05Sulphamethoxazole/trime-thoprim 19∶176(95)2(2.5)2(2.5)85(98.8)0(0)1(1.2)>0.05
注:S,敏感率;I,中介敏感率;R,耐药率。
3 讨 论
副溶血性弧菌(Vibrioparahemolyticus,Vp)是一种重要的食源性致病菌,被认为是典型的海洋性细菌,但也有研究报道发现在淡水水体中有检出,Sarkar等[12]通过在印度加尔各答淡水区域采集的样品中分离得到副溶血性弧菌。Vp的致病机理较为复杂,目前公认的主要致病因子是耐热溶血素(TDH)、耐热相关溶血素(TRH)。本研究表明在所有分离株中,tdh阳性率为21.1%(35/166),trh阳性率为9.6%(16/166),未发现tdh、trh双阳性高毒力菌株,其中临床分离株毒力基因携带率为63.8%(37/58)远超过环境分离株的携带率13.0%(14/108),与国际报道一致[13],但也有部分区域环境、食品分离株毒力基因阳性率也很高[14]。对于环境株中有毒力基因携带,临床株中存在tdh-trh-型菌株的现象揭示了不同来源副溶血性弧菌分离株的毒力基因呈多态性分布,并进一步说明的致病过程中存在与TDH或TRH共同作用的其他毒力因子,提示对于TDH和TRH阴性菌株不能忽视其致病性。自1996年O3∶K6大流行株以来,世界范围内相继出现许多与O3∶K6有相似遗传特征的血清型的O3∶K6克隆流行株,导致Vp的感染人数急剧上升。orf8是f237丝状噬菌体上的片段,此噬菌体曾被认为是1996年以来大流行株出现的最主要甚至是唯一的原因。本研究中orf8基因检出率为17.5%(29/166),且orf8+菌株都为tdh+trh-,有研究表明[15]在Vp进化过程中丢失噬菌体f237部分或全部片段可导致orf8片段的缺失,从而造成假阴性,认为orf8是确定大流行株的充分不必要条件,本研究仅仅将orf8基因作为参考基因研究,未将其作为判定大流行株的唯一标准。
本研究显示2006~2014年采集的166株Vp分离株未发现3种以上抗生素多重耐药的菌株,有1株无锡分离株对四环素和复方新诺明同时完全耐药,与李薇薇[16]等发现的1株浙江分离株耐药型一样;对头孢西丁(第二代头孢菌素类)、环丙沙星(第三代喹诺酮类)的中敏感率分别为91%(151/166)、48.2%(80/166),而黄锐敏[17]等检测结果显示对头孢西丁耐药率达83.9%,提示这两种药物有耐药趋势,养殖业及临床用药需引起重视。总体看来,近年来江苏副溶血性弧菌对大部分抗生素有较好的敏感性,此次头孢噻肟(第三代头孢菌素类)的敏感率达81.9%(136/166),与谭海芳[18]等报道的情况不同,但与秦思[19]等研究结果相吻合,这可能与地区养殖方式及医院用药习惯不同有关。环丙沙星耐药性与毒力基因携带、不同来源株相关性分析结果显示,tdh+trh-/tdh-trh+、tdh-trh-型对环丙沙星中敏感率分别为56.9%(29/51)、44.3%(51/115),两者无统计学差异(P>0.05),与吕虹等[20]报道的结果相同,但可适当添加一些毒力调控基因(toxR、toxS)以及毒力相关基因(UreR、FlaA、ompW)等做参考,进一步分析毒力基因分布与耐药性的相关性。另外,临床株和环境株对环丙沙星的中敏感率分别为46.6%(27/58)、49.1%(53/108),也无统计学差异(P>0.05)。
vpa0166是位于副溶血性弧菌染色体Ⅱ上的基因,本研究利用生物学软件PSORTb和PSLpred进行定位分析,确定该蛋白位于外膜,推测其为外膜蛋白。通过PCR方法鉴别出该基因存在两种基因型(a型和b型),测序结果表明a型(996 bp)和b型(1 050 bp)序列同源性为94%,且a型较b型产物有54个碱基缺失,与NCBI数据库中已发表的V.parahaemolyticusRIMD 2210633的相应蛋白序列同源性比对结果分别为94%和99%,可以看出b型更接近于测序菌株。另外,tdh+trh-orf8+菌株均属于b型,大部分tdh-trh+orf8-菌株属于a型,提示vpa0166基因的多样性为菌株分子分型和分析大流行株的亲缘关系提供了靶分子。通过Blasten结果发现还有24个相关的比对结果,其中有3个关于溶藻性弧菌(Vibrioalginolyticus,Va)也存在两种型,与RIMD 2210633同源性为86%,而溶藻弧菌与副溶血性弧菌在生物学特性等方面极其相似,同属于嗜盐性海生弧菌;另有2个是哈维氏弧菌(Vibrioharveyi,Vh),但比对结果覆盖度只有前50%,且相似度只有82%,说明vpa0166基因在弧菌属(Vibrio)中可被检测到,而在副溶血性弧菌中分布特性较好。细菌对喹诺酮类耐药机制的产生主要通过3种方式:靶位改变、膜通透性改变和主动外排。外膜蛋白(outer membrane protein,OMP)是革兰氏阴性菌细胞壁特有成分,具有控制小分子如抗生素进出的功能,其介导耐药性包括外膜通透性的降低和主动外排两种机制。有研究表明[21],大肠埃希菌膜孔蛋白OmpF与喹诺酮类药物抗菌作用有直接关联;肺炎克雷伯菌[22]、铜绿假单胞菌[23]中已发现多种主动外排系统,并已证实其发挥重要作用。本研究8种抗生素药敏结果显示,vpa0166 a型和b型仅对环丙沙星的敏感率存在统计学差异(P<0.05),其中b型(1 050 bp)更趋于耐药,a型(996 bp)趋于敏感,表明Vp对环丙沙星的耐药性与外膜蛋白编码基因vpa0166的多样性存在密切相关,为继续研究耐药机制提供理论依据。
[1] Wu Y, Wen J, Ma Y, et al. Epidemiology of foodborne disease outbreaks caused byVibrioparahaemolyticus, China, 2003-2008[J]. Food Control, 2014, 46(46): 197-202. DOI: 10.1016/j.foodcont.2014.05.023
[2] Bej AK, Patterson DP, Brasher CW, et al. Detection of total and hemolysin-producingVibrioparahaemolyticus, in shellfish using multiplex PCR amplification oftl,tdh, andtrh[J]. J Microbiol Methods, 1999, 36(3): 215-225. DOI: 10.1016/S0167-7012(99)00037-8
[3] Shirai H, Ito H, Hirayama T, et al. Molecular epidemiologic evidence for association of thermostable direct hemolysin (TDH) and TDH-related hemolysin ofVibrioparahaemolyticuswith gastroenteritis[J]. Infect Immun, 1990, 58(11): 3568-3573.
[4] Okuda J, Ishibashi M, Hayakawa E, et al. Emergence of a unique O3∶K6 clone ofVibrioparahaemolyticusin Calcutta, India, and isolation of strains from the same clonal group from Southeast Asian travelers arriving in Japan[J]. J Clin Microbiol, 1997, 35(12): 3150-3155.
[5] Nasu H, Iida T, Sugahara T, et al. A filamentous phage associated with recent pandemicVibrioparahaemolyticusO3∶K6 strains[J]. J Clin Microbiol, 2000, 38(6): 2156-2161.
[6] Kitiyodom S, Khemtong S, Wongtavatchai J, et al. Characterization of antibiotic resistance inVibriospp. isolated from farmed marine shrimps (Penaeus monodon)[J]. FEMS Microbiol Ecol, 2010, 72(2): 219-227. DOI: 10.1111/j.1574-6941.2010.00846.x
[7] 戎建荣, 李连青, 王淑峰, 等. 外膜孔道蛋白ompC、ompF的表达与大肠埃希菌耐药的相关性研究[J]. 中华医院感染学杂志, 2009, 19(6): 621-624. DOI:10.3321/j.issn:1005-4529.2009.06.007.
[8] Sato T, Yokota S, Okubo T, et al. Contribution of the AcrAB-TolC efflux pump to high-level fluoroquinolone resistance in Escherichia coli isolated from dogs and humans[J]. J Vet Med Sci, 2013, 75(4): 407-414. DOI:10.1292/jvms.12-0186
[9] 石亚素, 张行钦, 薛超波, 等. 舟山海产品副溶血性弧菌污染及毒力基因分析[J]. 中国公共卫生, 2007, 23(9): 1135-1136. DOI:10.3321/j.issn:1001-0580.2007.09.058
[10] Tada J, Ohashi T, Nishimura N, et al. Detection of the thermostable direct hemolysin gene (tdh) and thermostable direct hemolysin-related hemolysin gene (trh) ofVibrioparahaemolyticusby polymerase chain reaction[J]. Mol Cell Probes, 1992, 6(6): 477-487. DOI: 10.1016/0890-8508(92)90044-X
[11] M100-S20, performance standards for antimicrobial susceptibility testing: nineteenth informational supplement[S]. Wayne, PA: Clinical and Laboratory Standards Institute, 2010.
[12] Sarkar BL, Nair GB, Sircar BK, et al. Incidence and level ofVibrioparahaemolyticusassociated with freshwater plankton[J]. Appl Environ Microbiol, 1983, 46(1): 288-290.
[13] Theethakaew C, Feil EJ, Castilloramírez S, et al. Genetic relationships ofVibrioparahaemolyticusisolates from clinical, human carrier, and environmental sources in Thailand, determined by multilocus sequence analysis[J]. Appl Environ Microbiol, 2013, 79(7): 2358-2370. DOI: 10.1128/AEM.03067-12
[14] Velazquezroman J, Leónsicairos N, Floresvillaseor H, et al. PandemicVibrioparahaemolyticusO3∶K6 present in the Coastal Environment of Northwest Mexico is associated with recurrent diarrheal cases from 2004 to 2010[J]. Appl Environ Microbiol, 2012, 78(6): 1794-1803. DOI: 10.1128/AEM.06953-11
[15] Okura M, Osawa R, Iguchi A, et al. Genotypic analyses ofVibrioparahaemolyticusand development of a pandemic group-specific multiplex PCR assay[J]. J Clin Microbiol, 2003, 41(10): 4676-4782. DOI: 10.1128/JCM.41.10.4676-4682.2003
[16] 李薇薇, 梅玲玲, 唐震, 等. 2007-2009年中国副溶血性弧菌临床分离株分子特征分析[J]. 中华预防医学杂志, 2014, 48(1): 44-52. DOI:10.3760/cma.j.issn.0253-9624.2014.01.010.
[17] 黄锐敏, 陈辉, 袁月明. 2004-2006年深圳南山区副溶血性弧菌菌群菌型分布及耐药分析[J]. 中国卫生检验杂志, 2007, 17(7): 1275-1276. DOI:10.3969/j.issn.1004-8685.2007.07.056.
[18] 谭海芳, 丁丽娜, 林凤, 等. 肇庆市副溶血性弧菌血清分型和耐药性研究[J]. 实用预防医学, 2010, 17(2): 349-352. DOI:10.3969/j.issn.1006-3110.2010.02.061
[19] 秦思, 沈赟, 马恺, 等. 2012年江苏省食源性致病菌耐药监测分析[J]. 江苏预防医学, 2014, 25(1): 28-30. DOI:10.3969/j.issn.1006-9070.2014.01.010
[20] 吕虹, 李莉, 黄玉兰, 等. 2006-2013年四川省副溶血性弧菌毒力基因及耐药分析[J]. 中国卫生检验杂志, 2015, 25(12): 2045-2048.
[21] Duval V, Nicoloff H, Levy SB. Combined inactivation oflonandycgEdecreases multidrug susceptibility by reducing the amount of OmpF porin inEscherichiacoli[J]. Antimicrob Agents Chemother, 2009, 53(11): 4944-4948. DOI: 10.1128/AAC.00787-09
[22] Schneiders T, Amyes SGB, Levy SB. Role of AcrR and RamA in fluoroquinolone resistance in clinicalKlebsiellapneumoniaeisolates from Singapore[J]. Antimicrob Agents Chemother, 2003, 47(9): 2831-2837. DOI: 10.1128/AAC.47.9.2831-2837.2003
[23] Henrichfreise B, Wiegand I, Pfister W, et al. Resistance mechanisms of multiresistantPseudomonasaeruginosastrains from Germany and correlation with hypermutation[J]. Antimicrob Agents Chemother, 2007, 51(11): 4062-4070. DOI: 10.1128/AAC.00148-07
