混合型高脂血症联合降脂治疗的研究进展
2018-06-04董鑫综述田文审校
董鑫 综述 田文,2 审校
(1.中国医科大学附属第一医院心血管内科,辽宁 沈阳 110001; 2.中国医科大学附属第一医院老年心血管内科,辽宁 沈阳 110001)
动脉粥样硬化性心血管疾病(arteriosclerotic cardiovascular disease,ASCVD)是全球范围内人类死亡的主要原因之一。血脂异常是动脉粥样硬化最重要的危险因素,也是ASCVD患者预测主要心血管不良事件的主要因素之一。众所周知,他汀类药物是降低血清胆固醇最有效的药物之一,在降低心血管事件风险方面起着重要作用。当前的多数血脂管理指南均推荐降低低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)达到目标值作为降低心血管事件风险的主要治疗策略。胆固醇治疗试验荟萃分析显示,LDL-C每减低1 mmol/L,5年的主要心血管不良事件(包括心源性死亡、非致死性心肌梗死、冠状动脉血运重建和卒中相对减少21%[1]。
但有证据显示,即使接受了最佳剂量的他汀类药物治疗,部分患者的心血管事件风险仍未能避免,即存在心血管事件残余风险。也就是说,即使LDL-C降到目标值,血清三酰甘油(triglyceride,TG)过高或高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)过低可能是引发心血管事件的危险因素[2];但是对心血管事件残余风险这一概念目前仍有一定争议[3]。研究表明,富含TG的脂蛋白(包括乳糜微粒、极低密度脂蛋白和中间密度脂蛋白)残粒具有明显的促炎作用,其水平升高与缺血性心脏病有关,这些脂蛋白颗粒所携带的胆固醇,即残余胆固醇每升高39 mg/dL,缺血性心脏病增加2.8倍[4]。此外,残余胆固醇升高也被认为是心肌梗死的独立危险因素之一[5]。相应的,2013年国际动脉粥样硬化学会(International Atherosclerosis Society,IAS)提出了非HDL-C这一概念,认为它是致动脉粥样硬化胆固醇的全部成分。2014年美国国家脂质协会(American National Lipid Association,NLA)甚至推荐将非HDL-C优先于LDL-C作为降脂治疗的主要目标[6]。在PROVE IT-TIMI 22研究中,即使LDL-C水平达到1.8 mmol/L以下,30个月内死于心血管疾病的人群仍占总人群的10%[7]。针对极高危患者的TNT研究也呈现相似的试验结果[8]。由此,残余的心血管病事件风险可能部分取决于较高的血清TG水平及较低的血清HDL-C水平[2,9]。
混合型高脂血症,定义为TG>150 mg/dL,HDL-C水平降低(男性<40 mg/dL,女性<50 mg/dL)伴或不伴有LDL-C的升高[10]。2016年中国成人血脂异常防治指南指出,混合型高脂血症为总胆固醇和TG水平升高。家族性混合型高脂血症是由遗传基因异常所致的血脂代谢紊乱,具有家族聚集性的特点。通常认为,其血脂水平较散发性混合型高脂血症更高。在《美国国家胆固醇教育计划成人高胆固醇血症检测、评估和治疗专家委员会》的第三次报告中指出混合型高脂血症作为增加心血管疾病风险的标志,并且独立于LDL-C水平。2016年中国成人血脂异常防治指南指出:血清TG轻至中度升高者患冠心病危险性增加。贝特类药物以其降低TG和升高HDL-C为主要特征而被熟知。在他汀类药物治疗基础上联用烟酸或其衍生物的临床研究提示与单用他汀类药物相比无心血管保护作用[11]。目前认为,TG水平高于500 mg/dL开始应用贝特类药物,以预防胰腺炎;但是大多数临床实践中,因过分担忧二者合用的不良反应,故目前指南没有明确,已经服用他汀类药物的患者,TG达到什么水平应启动针对胆固醇和TG的联合降脂治疗。他汀类药物与贝特类药物联用可能进一步降低血清LDL-C水平,并同时降低TG和升高HDL-C,进而可能降低心血管事件风险。然而,某些他汀类药物与贝特类药物具有相近的药理学和药代学特点并有相似的不良反应(肌酶升高),因此他汀类药物与贝特类药物的联用也引发了有关安全性方面的担忧。
1 他汀类药物和贝特类药物的药理学特点及常见的不良反应
作为胆固醇合成的限速酶即羟甲基戊二酸单酰辅酶A还原酶的抑制剂,他汀类药物不仅能降低胆固醇的合成及刺激LDL受体上调,还具有抗炎、稳定斑块及改善内皮功能等作用[12]。他汀类药物大部分在肝脏代谢,经胆汁由肠道排出,少部分由肾排出。不同的他汀类药物药理学以及药物代谢特点不尽相同,这些特点决定了他汀类药物与其他药物的相互作用。常见他汀类药物的药物代谢特点见表1。
他汀类药物常见的不良反应包括他汀类药物相关性肌病和肝脏受损。他汀类药物导致肌病的机制尚未明确。一方面可能是他汀类药物影响了辅酶Q10及线粒体功能,不能为肌肉提供ATP[13]。另一方面可能阻断了胆固醇的合成,导致细胞膜的胆固醇与磷脂比例下降,细胞膜性质发生变化,从而影响细胞膜上的离子通道,致骨骼肌细胞发生损伤[14]。同时,基因也是他汀类药物导致肌病的关键因素。现有证据表明,SLCO1B1基因T521C多态性与增加他汀类药物相关肌病的风险呈相关性,尤其是接受辛伐他汀的人群[15]。
他汀类药物导致肝脏受损主要表现为肝酶升高,其机制可能与两方面因素相关。一为药物通过肝脏细胞色素(CYP)P450酶系代谢产生自由基等;二为药物通过干扰肝细胞代谢过程,使细胞结构发生改变。也有部分研究提示他汀类药物可能存在增加新发糖尿病和肿瘤的风险,但尚有争议。
研究证明,许多临床药物与他汀类药物的相互作用可能增加不良反应的风险。除了普伐他汀及瑞舒伐他汀,现有的他汀类药物都主要通过肝脏CYP450同工酶代谢,其中,CYP3A4同工酶表达最丰富。所以,主要通过CYP3A4代谢的药物可能与他汀类药物相互作用导致肌病和横纹肌溶解风险增高,例如伊曲康唑、红霉素、钙拮抗剂、胺碘酮和环孢霉素等。
贝特类药物激活核受体—过氧化物酶体增殖激活受体α,增强脂蛋白脂酶的活化,加速乳糜微粒和极低密度脂蛋白的分解代谢,增加HDL的合成,并使LDL亚型由小而密颗粒向大而疏转变。贝特类药物在血液中与血浆白蛋白结合,在肝细胞内主要与葡萄糖醛酸结合,少量以原型经肾排出。其中,非诺贝特是最常用的药物,除了具有调血脂作用外,还能明显降低血浆纤维蛋白原和血尿酸水平。非诺贝酸是非诺贝特经酶裂解形成的活性代谢产物,在胃肠道内被吸收。贝特类药物最常见的不良反应包括胃肠道症状和骨骼肌症状(肌痛及肌酸激酶的轻中度升高)。有研究表明重度肾功能不全[估算的肾小球滤过率(eGFR)<30 mL/min]的患者应用非诺贝酸增加血肌酐水平2.7倍,但是其导致肾功能恶化的确切机制尚未清楚[16]。
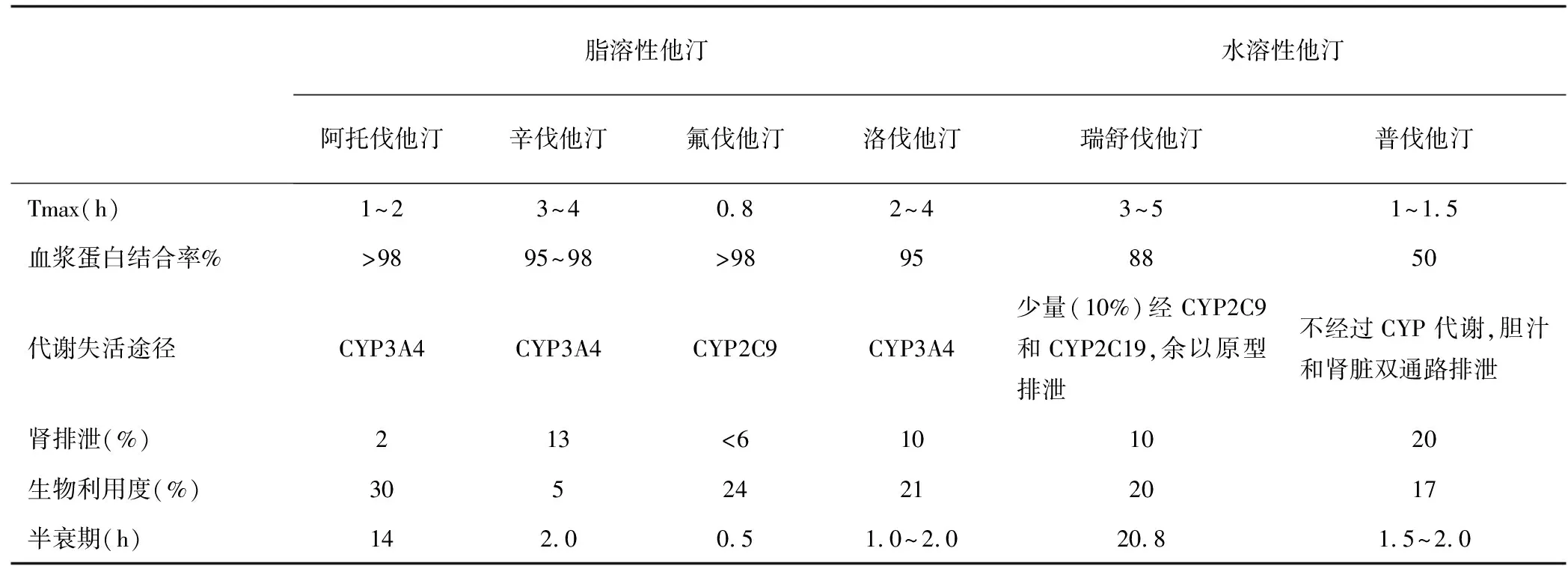
表1 常见他汀类药物药理学及药代动力学特点比较
注:Tmax:药物达到最高血浆浓度所需的时间;CYP:细胞色素P
2 有关指南及专家共识推荐
国内外指南及共识推荐在混合型高脂血症患者中他汀类药物与贝特类药物的联合应用。2011年欧洲动脉粥样硬化协会及欧洲心脏病学会(ESC/EAS)指南推荐:他汀类药物联用贝特类药物可有效改善混合型高脂血症预后(推荐级别Ⅱb,B级证据)。2014年中国胆固醇教育计划血脂异常专家防治建议:在ASCVD的二级预防中,若患者伴有高TG血症,经过适当强度的他汀类药物治疗后,非HDL-C仍不达标者,可在他汀类药物基础上加用非诺贝特或缓释烟酸。
因此,他汀类药物联合贝特类药物可能会降低混合型高脂血症患者的心血管事件风险。然而,仍存在一些担忧即他汀类药物联用贝特类药物会增加肌病、横纹肌溶解及肝肾功能损害等不良反应。
3 他汀与贝特类药物联合应用的有效性评价
迄今为止,在应用他汀类药物与贝特类药物联合治疗混合型高脂血症的临床研究中,以心血管事件作为试验终点的研究较为少见。大量的研究已经证明,他汀类药物能够降低心血管疾病事件和全因死亡率。为了明确强化血糖控制,升高HDL-C和降低TG能否降低心血管不良事件,ACCORD研究入选了5 518例2型糖尿病患者,在辛伐他汀20~40 mg/d的基础上加用贝特类药物或安慰剂治疗4.7年。在所有分组中,平均LDL-C水平由2.59 mmol/L降至2.07 mmol/L;非诺贝特组平均HDL-C升高水平较安慰剂组显著;同样地,非诺贝特药物组患者平均TG水平由2.13 mmol/L降至1.66 mmol/L,安慰剂组则降至1.92 mmol/L(P<0.001)。主要心血管不良事件在两组的发生率近乎相同。在亚组分析中,针对TG>204 mg/dL或HDL-C<34 mg/dL的高危人群,非诺贝特组与安慰剂组相比,主要终点事件的发生率分别是12.4%和17.3%(P=0.057)[17-18],提示非诺贝特联用辛伐他汀类药物有降低混合型高脂血症患者心血管事件发生率的趋势。进一步分析显示,非诺贝特组女性患者主要终点事件发生率相比安慰剂组显著降低(9.1% vs 6.6%,P=0.01)。ACCORD研究的主要终点是阴性的,但其入选人群为糖尿病患者而非混合型高脂血症患者,许多患者并无显著的高TG血症,因此在这一研究中尚不能充分体现他汀类药物与贝特类联合治疗对混合型高脂血症患者心血管事件的实际影响;但亚组分析结果提示非诺贝特可能会在他汀类药物的基础之上对糖尿病合并混合型高脂血症患者带来更多获益。
另外一项研究评估1 445例混合型高脂血症患者应用他汀类药物与非诺贝酸联合治疗的有效性及安全性。结果显示瑞舒伐他汀类药物10 mg联合非诺贝酸135 mg较单用瑞舒伐他汀10 mg在升高HDL-C(20.3% vs 8.5%)及降低TG(-47.1% vs -24.4%)方面具有明显的差异[19]。
实际上,他汀类药物与贝特类药物联合治疗已经广泛应用于实践,其结果已在小规模研究中所展示。尽管有一些较大的系列研究相继发表,但通常都是开放的、非随机的前瞻性试验设计[20-23]。这些研究提示,他汀类药物与贝特类药物联合治疗混合型高脂血症能更有效地降低LDL-C和TG以及升高HDL-C,并且是安全的。总之,联合治疗较单药治疗使血脂水平能得到更为有效的控制,这种针对混合型高脂血症的联合治疗可能是一个适当的选择。
4 他汀类药物与贝特类药物联用的安全性研究
4.1 他汀相关性肌病
他汀类药物与贝特类药物合用的最大障碍之一是存在肌病的潜在风险,由于他汀类药物和贝特类药物代谢途径相似,无论是他汀还是贝特,均可引起肌病甚至横纹肌溶解。不同的他汀类药物所致肌肉安全性存在差异:辛伐他汀最高(18.2%),氟伐他汀最低(5.1%)。2011年美国食品药品监督管理局(FDA)不良事件分析报告指出:水溶性的瑞舒伐他汀类药物并非更安全。他汀类药物所致肌肉不良事件中,瑞舒伐他汀与肌痛强相关。至于横纹肌溶解和肌酶升高,数据显示瑞舒伐他汀和辛伐他汀与其呈强相关性[24]。然而,联合治疗致肌病的风险同样存在差异性。任何他汀类药物与吉非贝齐联用导致横纹肌溶解的发生率是与非诺贝特联合的15倍,因为这两类药物都通过葡萄糖醛酸化酶代谢。在FIELD研究中,944例接受他汀与非诺贝特联合治疗的患者无横纹肌溶解的事件发生[24],相同的结果也在ACCORD研究中体现[25]。
4.2 肝功能损伤
由于部分他汀类药物与贝特类药物代谢途径相似,均有潜在损伤肝功能的影响,合用时发生不良反应的机会增多。一项荟萃分析显示:常规剂量他汀类药物治疗所致肝酶升高的发生率是1.17%,且与安慰剂相似(1.05%),二者没有显著性差异。那么,在临床工作中对基础肝功能异常的患者能否使用他汀治疗?GREACE研究的肝功能亚组分析共入选437例冠心病合并轻中度肝功能不全(血清转氨酶浓度小于正常上限的三倍)的患者,结果显示227例接受阿托伐他汀的患者肝功能明显改善;他汀类药物能够降低肝功能异常患者的心血管事件风险,且获益大于肝功能正常患者[26]。总之,服用他汀类药物的获益远大于风险,肝酶轻中度升高不应该成为他汀类药物治疗的障碍。
4.3 肾功能损伤
他汀类药物代谢途径不尽相同,阿托伐他汀对于肾功能不全患者无需调量,而瑞舒伐他汀在重度肾功能不全患者(eGFR<30 mL/min)禁用。FIELD研究结果提示非诺贝特增加血肌酐水平的同时降低eGFR[27]。然而,在整个试验研究过程中没有肾功能衰竭等主要不良事件发生。他汀类药物或贝特类药物血浆水平的增加可能加重肾功能损害的程度,故在此临床情况下联合应用需慎重。
目前在人群试验中没有观察到贝特类药物与辛伐他汀、普伐他汀、阿托伐他汀和瑞舒伐他汀在药代动力学上具有显著相互作用。例如体外研究表明,吉非贝齐和参与他汀类药物代谢的同族葡萄糖醛酸化酶具有相互作用,即与他汀类药物合用时会增加他汀类药物的药时曲线下面积,故与他汀类药物合用时需谨慎。与之相比,非诺贝特由不同的葡萄糖醛酸化酶代谢,与他汀类药物联用在相关临床方面不会导致药代动力学的相互作用。所以,非诺贝特被认为是与他汀类药物联用最合适的药物。
5 小结
ASCVD的一级或二级预防中,目前指南均建议将LDL-C作为防控ASCVD的首要靶点。然而,仍有许多患者已经达到LDL-C推荐的目标值,但是仍然存在心血管事件风险。非诺贝特在临床上广泛用于降低TG并升高HDL-C,然而,其降低心血管事件的证据尚不充分。目前国内外指南和专家共识均提出贝特类药物可作为他汀类药物的辅助治疗,可用于他汀类药物治疗LDL-C或非HDL-C没有达到目标值的患者。研究数据一致表明,他汀类药物与非诺贝特联用可进一步改善血脂谱、显著提高血脂达标率,且耐受性良好。尚无确切的临床证据提示他汀与贝特类药物联用的安全性问题。ACCORD研究也证实,非诺贝特与他汀类药物联合治疗具有良好的耐受性。因此,对于多数混合型高脂血症的ASCVD极高危或高危人群,如强化的生活方式干预不能使血脂达到理想目标时,他汀类药物与非诺贝特联合治疗是有效且安全的。
[ 参 考 文 献 ]
[1] Baigent C,Keech A,Kearney PM,et al.Efficacy and safety of cholesterol-lowering treatment:prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins[J].Lancet,2005,367(9509):469-470.
[2] Barter P,Gotto AM,Larosa JC,et al.HDL cholesterol,very low levels of LDL cholesterol,and cardiovascular events[J].N Engl J Med,2007,357(13):1301-1310.
[3] 张艳,蒋清安,杨龙,等.浅论心血管疾病残余风险[J].中国保健营养,2012,22(12):1925-1925.
[4] Varbo A,Benn M,Tybjaerg Rg-Hansen A,et al.Remnant cholesterol as a causal risk factor for ischemic heart disease[J].J Am Coll Cardiol,2013,61(4):427-436.
[5] Jørgensen AB,Frikkeschmidt R,West AS,et al.Genetically elevated non-fasting triglycerides and calculated remnant cholesterol as causal risk factors for myocardial infarction[J].Eur Heart J,2013,34(24):1826-1833.
[6] Jacobson TA,Ito MK,Maki KC,et al.National lipid association recommendations for patient-centered management of dyslipidemia:part 1--full report[J].J Clin Lipidol,2015,9(2):129-169.
[7] Miller M.Intensive versus moderate lipid lowering with statins after acute coronary syndromes[J].N Engl J Med,2004,351(7):714-717.
[8] Bangalore S,Fayyad R,Laskey R,et al.Lipid lowering in patients with treatment-resistant hypertension:an analysis from the Treating to New Targets(TNT)trial[J].Eur Heart J,2014,35(27):1801-1808.
[9] Barter P.HDL-C:role as a risk modifier[J].Atheroscler Suppl,2011,12(3):267-270.
[10] Buse JB,Ginsberg HN,Bakris GL,et al.Primary prevention of cardiovascular diseases in people with diabetes mellitus:a scientific statement from the American Heart Association and the American Diabetes Association[J].Diabetes Care,2007,30(1):162-172.
[11] HPS2-THRIVE Collaborative Group,Landray MJ,Haynes R,et al.Effects of extended-release niacin with laropiprant in high-risk patients[J].N Engl J Med,2014,371(3):203-212.
[12] 鄢华,高炜.他汀类药物作用和作用机制的新认识[J].临床内科杂志,2006,23(1):5-7.
[13] Nielsen ML,Pareek M,Henriksen JE.Reduced synthesis of coenzyme Q10 may cause statin related myopathy[J].Ugeskr Laeger,2011,173(46):2943-2948.
[14] Arora R,Liebo M,Maldonado F.Statin-induced myopathy:the two faces of Janus[J].J Cardiovasc Pharmacol Ther,2006,11(2):105-112.
[15] Hou Q,Li S,Li L,et al.Association between SLCO1B1 gene T521C polymorphism and statin-related myopathy risk:a meta-analysis of case-control studies[J].Medicine,2015,94(37):e1268.
[16] Tojcic J,Benoit-Biancamano MO,Court MH,et al.In vitro glucuronidation of fenofibric acid by human UDP-glucuronosyltransferases and liver microsomes[J].Drug Metab Dispos,2009,37(11):2236-2243.
[17] Lounsbery J,Prasad S,Rowland K.Add a fibrate to a statin?[J].J Fam Pract,2010,59(10):582-584.
[18] Reyes-Soffer G,Ngai CI,Lovato L,et al.Effect of combination therapy with fenofibrate and simvastatin on postprandial lipemia in the ACCORD lipid trial[J].Diabetes Care,2013,36(2):422-428.
[19] Jones PH,Davidson MH,Kashyap ML,et al.Efficacy and safety of ABT-335(fenofibric acid)in combination with rosuvastatin in patients with mixed dyslipidemia:a phase 3 study[J].Atherosclerosis,2009,204(1):208-215.
[20] Grundy SM,Vega GL,Yuan Z,et al.Effectiveness and tolerability of simvastatin plus fenofibrate for combined hyperlipidemia(the SAFARI trial)[J].Am J Cardiol,2005,95(4):462-468.
[21] Li XP,Gong HR,Huang XS,et al.The influence of statin-fibrate combination therapy on lipids profile and apolipoprotein A5 in patients with acute coronary syndrome[J].Lipids Health Dis,2013,12(1):133.
[22] Ellen RL,McPherson R.Long-term efficacy and safety of fenofibrate and a statin in the treatment of combined hyperlipidemia[J].Am J Cardiol,1998,81(4A):60B-65B.
[23] Farnier M,Dejager S.Effect of combined fluvastatin-fenofibrate therapy compared with fenofibrate monotherapy in severe primary hypercholesterolemia.French Fluvastatin Study Group[J].Am J Cardiol,2000,85(1):53-57.
[24] Sakaeda T,Kadoyama K,Okuno Y.Statin-associated muscular and renal adverse events:data mining of the public version of the FDA adverse event reporting system[J].PLoS One,2011,6(12):e28124.
[25] ACCORD Study Group,Ginsberg HN,Elam MB,et al.Effects of combination lipid therapy in type 2 diabetes mellitus[J].N Engl J Med,2010,362(17):1563-1574.
[26] Athyros VG,Tziomalos K,Gossios TD,et al.Safety and efficacy of long-term statin treatment for cardiovascular events in patients with coronary heart disease and abnormal liver tests in the Greek Atorvastatin and Coronary Heart Disease Evaluation(GREACE)Study:a post-hoc analysis[J].Lancet,2010,376(9756):1916-1922.
[27] Choi HD,Shin WG,Lee JY,et al.Safety and efficacy of fibrate-statin combination therapy compared to fibrate monotherapy in patients with dyslipidemia:a meta-analysis[J].Vascul Pharmacol,2015,65-66:23-30.
