大鼠血浆中非诺贝特活性代谢物含量测定及药代动力学研究
2016-12-21张媚媚柳晓蕊尹一子
张媚媚,林 蔚,柳晓蕊,尹一子
(广州医科大学附属肿瘤医院药学部,广东 广州 510095)
大鼠血浆中非诺贝特活性代谢物含量测定及药代动力学研究
张媚媚,林 蔚,柳晓蕊,尹一子
(广州医科大学附属肿瘤医院药学部,广东 广州 510095)
目的 建立测定非诺贝特在大鼠血浆中的活性代谢物非诺贝特酸含量的高效液相色谱(HPLC)法。方法 以乙腈沉淀蛋白、酮洛芬为内标,采用Acclaim®120 C18柱,流动相为乙腈-0.2%磷酸溶液(50∶50),检测波长为297 nm。结果 非诺贝特酸和酮洛芬保留时间为9.1,19.5 min;非诺贝特酸质量浓度在0.02~100.00 g/mL范围内与峰面积线性关系良好(r=0.999 4);提取回收率在97.74% ~104.13%范围内,日内和日间精密度的 RSD均小于7%(n=5),稳定性试验结果良好。结论 自制非诺贝特制剂在大鼠体内的生物利用度远高于非诺贝特原料药,为临床非诺贝特药物检测和体内药代动力学研究提供了有效的技术支持。
非诺贝特酸;高效液相色谱法;血药浓度
非诺贝特是第2代苯氧芳酸类调血脂药物,调脂作用确切,是降低三酰甘油(TG)的首选[1]。作为前药,非诺贝特在体内经酯酶作用下,可迅速代谢成非诺贝特酸而起调血脂作用,具有明显的降低血清总胆固醇(TC)、TG和升高高密度脂蛋白(HDL)的作用,适用于治疗高三酰甘油血症和高胆固醇血症,疗效优于氯贝特,且不良反应较少[2]。非诺贝特的水溶性非常差,在水中几乎不溶[3],属于生物药剂分类中的第2类药,溶解度低,渗透性高[4]。口服生物度低,直接影响了其临床疗效[5]。非诺贝特在体内代谢为非诺贝特酸后,在血浆中检测不到前者的原形[1]。为了解非诺贝特在大鼠体内的药代动力学过程,本研究中以酮洛芬为内标[6],建立了高效液相色谱(HPLC)法用作非诺贝特在大鼠体内药代动力学的研究方法,并对比了自制非诺贝特制剂与原料药在大鼠体内的生物利用度。现报道如下。
1 仪器、试药与动物
1.1 仪器
UltiMate®3000 Basic Automated型高效液相色谱仪;Chromeleon 6.8色谱数据分析系统(Dionex Corporation Bannockburn IL USA),包括四元梯度泵、在线脱气机、自动进样器、柱温箱(Timberline Instruments,Inc.);Denver TP-4101型电子天平(Denver Instrument);Millipore Milli Q UV Plus型纯净水装置 (American Instrument Exchange Inc.);Microfuge®高速离心机(Beckman Coulter);VX-100型涡旋混合器(National LabnetCo.,Inc.)。
1.2 试药
非诺贝特(美国药典标准,纯度为99.8%,香港先进技术工业有限公司);非诺贝特酸标准品(美国Biofine International<Vancouver,BC>公司);酮洛芬标准品(美国Hawkins Pharmaceutical<Minneapolis,MN>公司);乙腈、甲醇(美国FisherScientific<FairLawn,NJ>公司)。空白血浆(Fisher Scientific,Fair Lawn,NJ)取自健康Wistar大鼠,由美国LAMPIRE Biological Laboratories(Pipersville,PA)公司提供。乙腈、甲醇为色谱纯,其他试剂为分析纯。
1.3 动物
Wistar大鼠,动物实验符合动物实验伦理会《实验动物福利伦理原则》的要求,进行设计并开展,动物合格证编号为SYXK(粤)2010-0104,室温下单独饲养。
2 方法与结果
2.1 血药浓度测定
2.1.1 色谱条件
预柱:Phenomenex C18柱(12.5 mm×4 mm,5 μm);色谱柱:Acclaim®120 column C18柱(150 mm×4.6 mm,2.5 μm);流动相:乙腈-0.2%磷酸溶液(50∶50),用前经过0.5 μm微孔滤膜过滤脱气;流速:1.0 mL/min;柱温:30℃;进样量:20 μL;在线脱气;检测波长:297 nm。
2.1.2 溶液配制
非诺贝特酸标准贮备液:经过预试验,血浆样品中未出现非诺贝特的色谱峰。精密称取非诺贝特酸10 mg,置10 mL容量瓶中,用乙腈溶解并稀释至刻度,摇匀,配成质量溶度为1 g/L的非诺贝特酸母液;将非诺贝特酸母液逐级用乙腈稀释,得100,5,0.1 μg/mL的标准贮备液,-4℃冷藏备用。
内标溶液:精密称取酮洛芬标准品 8.0 mg,置100 mL容量瓶中,用乙腈溶解并稀释至刻度,摇匀,配成质量浓度为80 μg/mL的溶液,-4℃冷藏备用。
2.1.3 血浆样品处理
取血浆100 μL,加入内标酮洛芬溶液40 μL,混匀,加入乙腈 160 μL,涡旋混合2 min,10 000 r/min离心10 min,取上清液进样20 μL,记录色谱图,见图1。
2.1.4 方法学考察
专属性试验:取空白血浆100 μL,加入乙腈200 μL,按2.1.3项下方法操作,得空白血浆色谱图(图1 A);配置含非诺贝特酸和内标的空白血浆溶液,依法处理,得非诺贝特酸和内标提取后的血浆标准品色谱图(图1 B)。可见,内标和非诺贝特酸的保留时间分别为9.1 min和19.5 min,互不干扰出峰时间。结果表明,乙腈能够去除血浆中大部分杂质,不干扰色谱峰。拟订色谱条件下内标和非诺贝特酸方法专属性良好,可用于大鼠血浆样本中非诺贝特酸的测定。色谱图见图1。
绝对回收率:取空白血浆适量,制备低、中、高3个质量浓度非诺贝特酸血浆样品(质量浓度分别为0.05,2.50,80.00 μg/mL)和仅含内标(质量浓度为80 μg/mL)的血浆样品,按2.1.3项下方法操作,每个质量浓度进行5样品分析,获得相应的峰面积为 A1。同时,以流动相代替血浆制备低、中、高3个质量浓度的非诺贝特酸供试品溶液(质量浓度分别为0.05,2.50,80.00 μg/mL)和内标样品溶液(质量浓度为80.00 μg/mL),每个质量浓度进行5样品分析,获得标准溶液色谱峰面积为 A0,以相应浓度的 A1/A0×100比值计算非诺贝特酸和内标的回收率。结果见表1。结果表明,非诺贝特酸低、中、高质量浓度及内标的绝对回收率范围为99.82%~105.50%,RSD<5%(n=5),表明方法绝对回收率良好。
相对回收率:取空白血浆适量,制备低、中、高3个质量浓度非诺贝特酸血浆样品(质量浓度分别为0.05,2.50,80.00 μg/mL),按2.1.3项下方法操作,每个质量浓度进行5样品分析,计算相对回收率,评价方法的准确度。结果表明,非诺贝特酸的平均相对回收率均为99.26%~100.15%,表明方法的准确度良好。结果见表2。
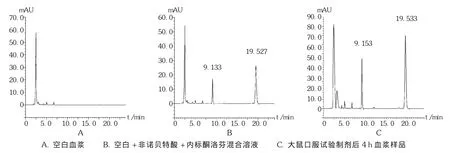
图1 高效液相色谱图
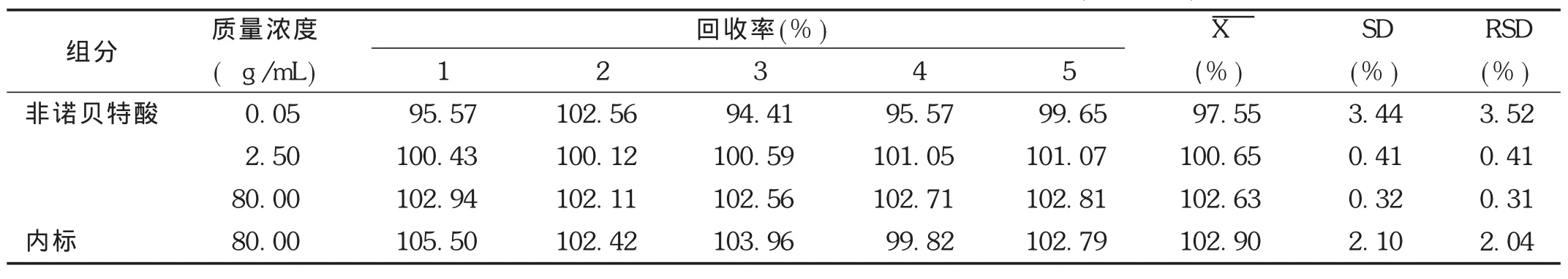
表1 非诺贝特酸和内标在Wistar大鼠血浆中的绝对回收率(%,n=5)
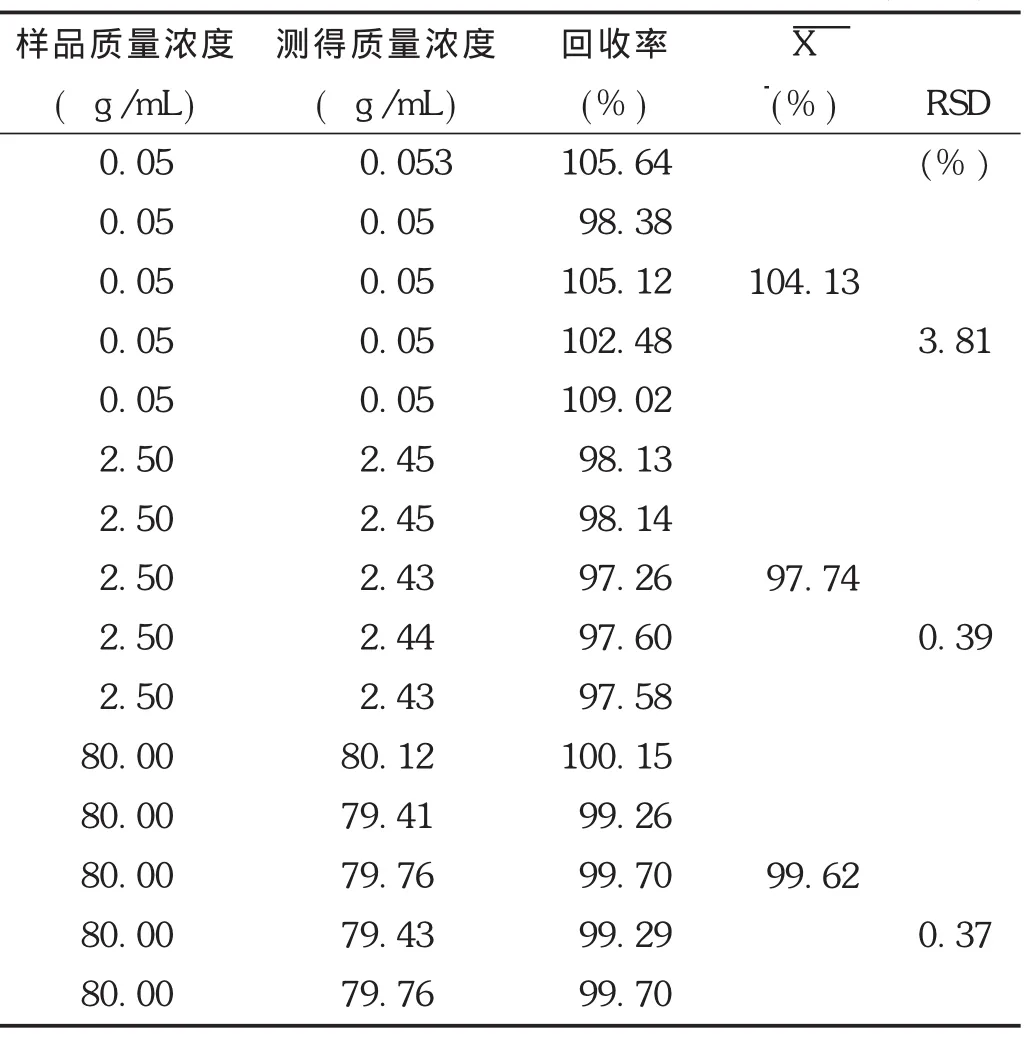
表2 非诺贝特酸在Wistar大鼠血浆中的相对回收率(n=5)
线性关系考察:取非诺贝特酸标准贮备液适量,氮气吹干,加入空白血浆100 μL,配制成相当于非诺贝特酸血浆质量浓度为0.02,0.05,0.10,1.00,2.50,5.00,20.00,50.00,100.00 μg/mL的系列溶液,按2.1.3项下方法操作,每个质量浓度进样5次,进样20 μL,记录色谱图。以非诺贝特酸与内标酮洛芬质量浓度比值(X)为横坐标、非诺贝特酸与内标酮洛芬峰面积比值(Y)为纵坐标,用加权(W=1/c2)最小二乘法进行回归运算,得直线回归方程,Y=24.230 34 X+0.001 8,r=0.999 4(n=9)。结果见表 3,表明非诺贝特酸质量浓度在0.02~100.00μg/mL范围内与峰面积比值线性关系良好。
最低定量限确定:用标准贮备液系列配制成相当于非诺贝特酸血浆质量浓度为0.02 μg/mL的供试品溶液,氮气吹干,取空白血浆适量,按2.1.3项下方法操作,进行5样品平行样本分析,进样20 μL。根据当天标准曲线计算每个样本测得质量浓度和相对偏差。结果见表4。结果表明,该方法所测非诺贝特酸的最低定量下限可达0.02 μg/mL,RSD为9.8%(n=5),小于15%。
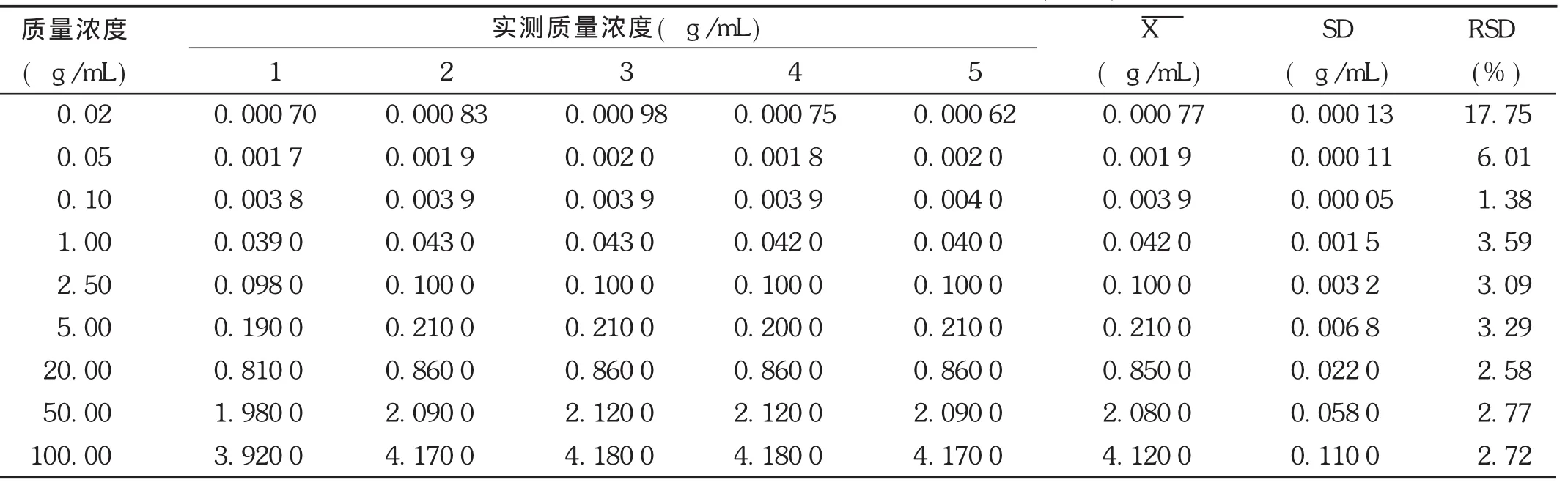
表3 非诺贝特酸在Wistar大鼠血浆中的线性关系(n=5)
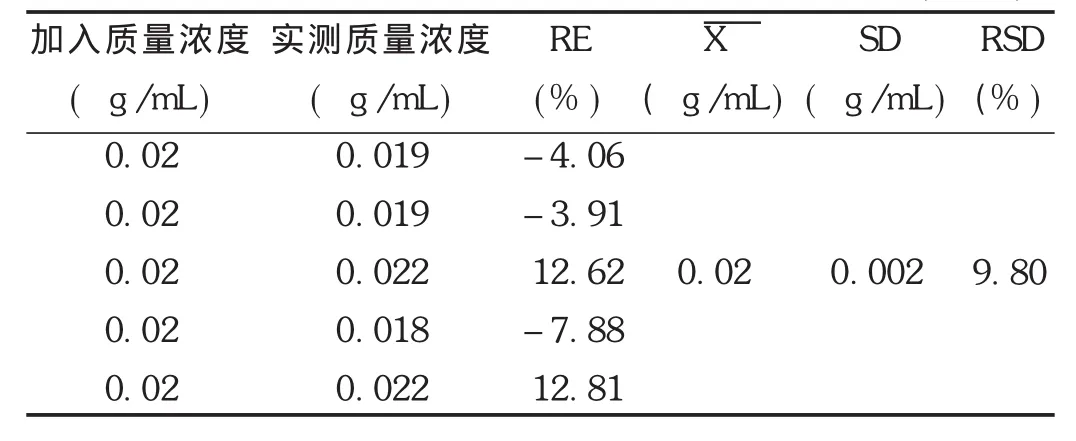
表4 非诺贝特酸在Wistar大鼠血浆中的最低定量限(n=5)
精密度试验:取空白血浆,按照标准曲线制备项下方法配制低、中、高3个质量浓度(非诺贝特酸质量浓度分别为0.05,2.50,80.00 μg/mL)的样品,按2.1.3项下方法操作,每个质量浓度进行5样品平行分析,连续3 d。当日制备当日测定,并根据当日标准曲线,计算样品测得质量浓度。结果见表5和表6。可见,非诺贝特酸的日内精密度在1.06%~5.67%范围内(n=5),日间精密度在2.16%~6.87%范围内,相对误差均在10%范围内,表明仪器精密度良好。
稳定性试验:取空白血浆,按线性关系考察项下方法配制低、中、高3个质量浓度,考察非诺贝特酸样品提取后室温放置12 h,-20℃放置1,7,14 d,以及血浆样品冷冻前、冻融1次、冻融2次的稳定性。结果见表7至表9。可见,非诺贝特酸血浆样品室温放置稳定性良好,冷冻1,7,14 d样品的稳定性良好。冻融2次试验结果良好,不影响测定结果,符合方法稳定性的要求。
2.1.5 质控样品含量测定
大鼠血浆样品分为6批进行测定,每批1条标准曲线,同时分析低、中、高质量浓度的质控样品(非诺贝特酸质量浓度为0.05,2.50,80.00 μg/mL)并随行于未知样品测试汇总。取空白血浆,按照标准曲线制备项下方法配制低、中、高3个质量浓度(非诺贝特酸浓度分别为0.05,2.50,80.00 μg/mL)的质量控制(QC)样品,每1个质量浓度进行5样品分析,连续测定3 d,根据当日标准
曲线,计算QC样品测得质量浓度。根据QC样品测定结果,计算测定方法的准确度和精密度。根据当批标准曲线求算大鼠血浆样品质量浓度和QC样品质量浓度,要求QC样品质量浓度偏差在±15%范围内,即回收率控制在85%~115%范围内,表示仪器检测正常,否则当批样品测定结果作废。结果见表10。QC样品结果表明,低、中、高QC样品相对偏差均在±15%范围内,表明大鼠血浆样品测定结果可信。

表5 非诺贝特酸在Wistar大鼠血浆中的日内精密度(n=5)
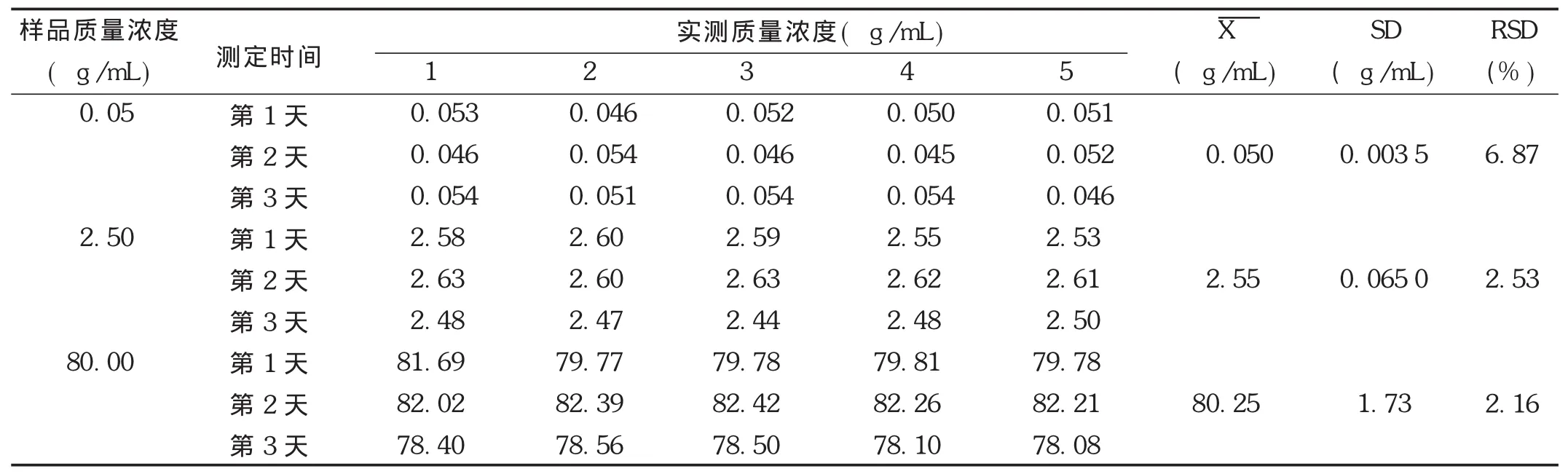
表6 非诺贝特酸在Wistar大鼠血浆中的日间精密度(n=5)
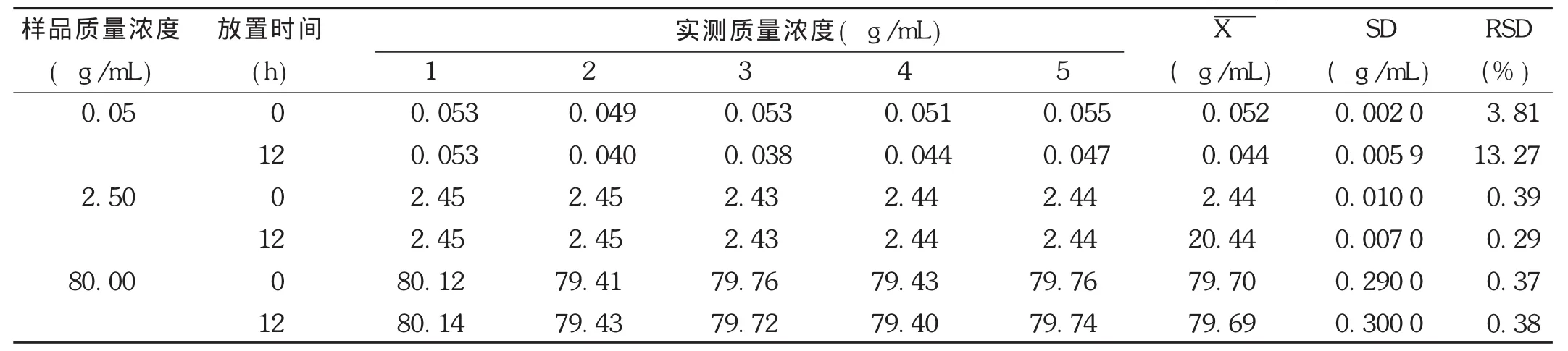
表7 Wistar大鼠血浆中的非诺贝特酸提取后室温放置12 h的稳定性试验结果(n=5)
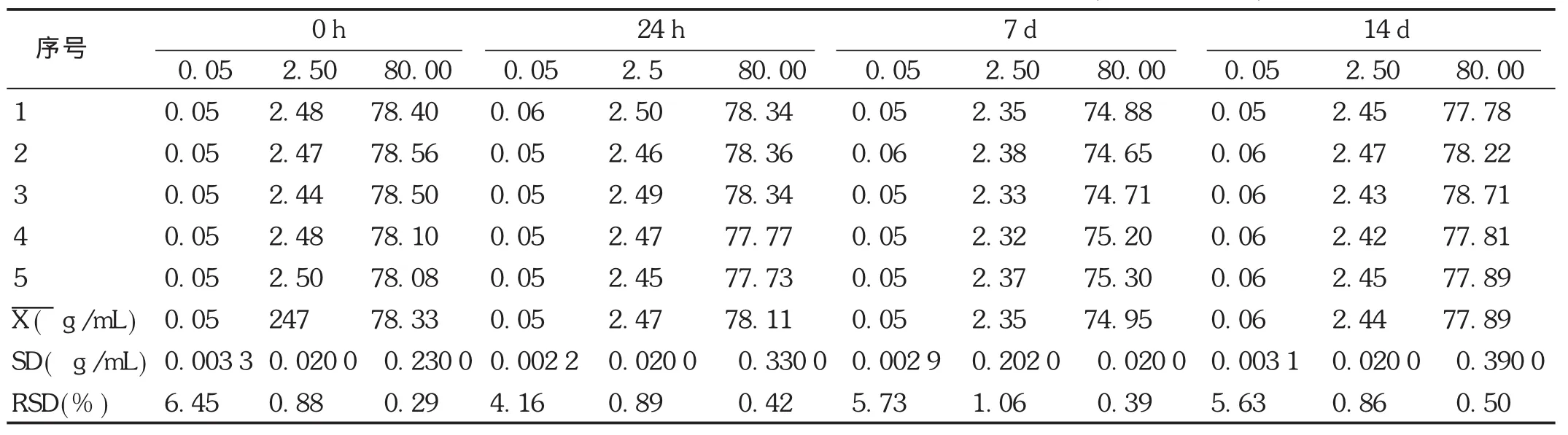
表8 Wistar大鼠血浆中非诺贝特酸的-20℃冷冻稳定性试验结果(n=5, g/mL)

表9 Wistar大鼠血浆中非诺贝特酸的-80℃冻融稳定性试验结果(n=5, g/mL)
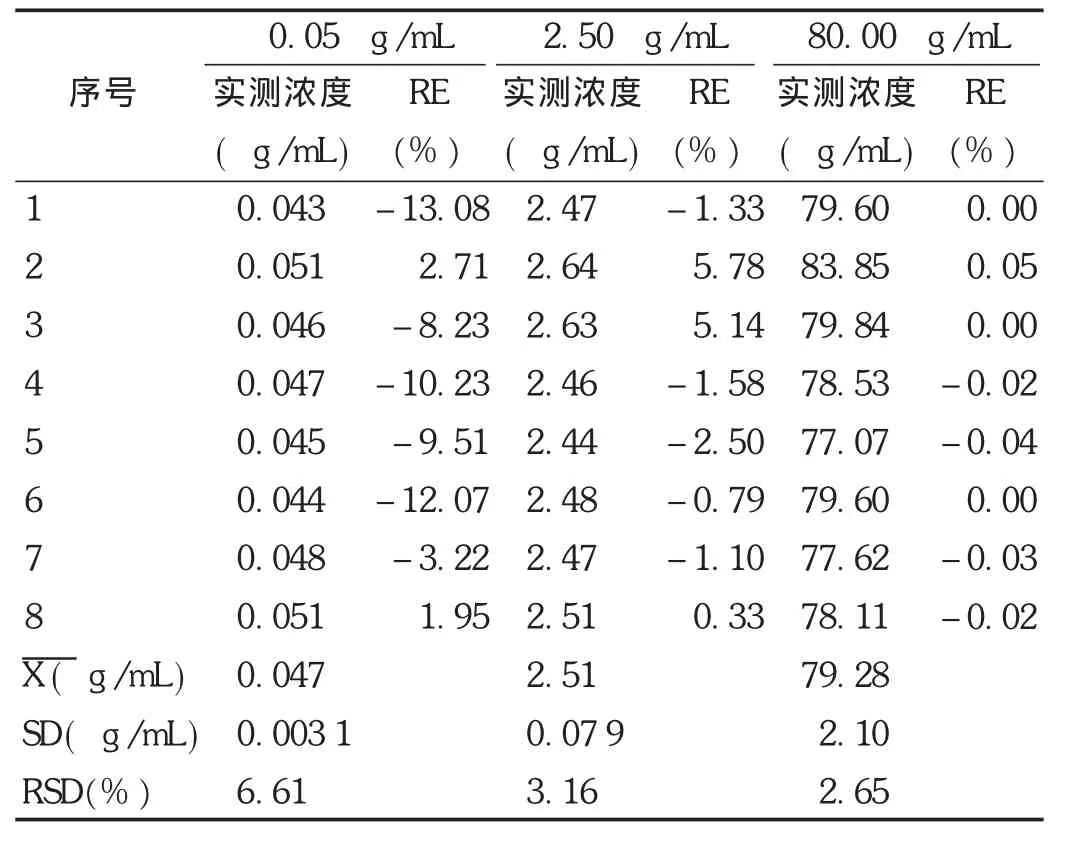
表10 Wistar大鼠血浆中的非诺贝特酸QC样品含量测定结果
2.2 大鼠单次口服药代动力学参数研究
2.2.1 大鼠单次口服试验
预先颈部插管雄性 Wistar大鼠 12只(体质量300~350 g),试验前3 d可自由饮食。在禁食12 h后,给药前称重标号,分为两组。分别向胃内灌注非诺贝特原料药、非诺贝特自制制剂混悬剂各 2 mL(溶剂为0.3%的CMC-Na溶液),给药量为27 mg/kg。分别于灌胃0.25,0.5,0.75,1,2,4,6,8,12,24,36,48 h后,从大鼠的颈部预插管取血0.3 mL,置肝素化离心管中,立即注射37℃保温的0.3 mL生理盐水和0.1 mL肝素。所取血样离心5 min(4 000 r/min),吸取上层血浆,置-20℃冰箱中保存,待测。按2.1.3项下方法制备血浆样品,采用HPLC法测定。
2.2.2 数据处理
药代动力学参数计算:根据所测非诺贝特酸血药浓度-时间数据,利用Winolin非房室模型计算主要药代动力学参数,包括半衰期(t1/2)、48 h血药浓度曲线下面积(AUC0-48)、平均滞留时间(MTR)、最大血药浓度(Cmax)和达峰时间(Tmax)。Cmax和 Tmax采用实测值,AUC为统计矩计算值。
相对生物利用度计算:非诺贝特酸相对生物利用度=AUC0-48(试验制剂)/AUC0-48(参比制剂)×100%。采取五样本平行测定,方法学标准偏差(SD)和相对标准偏差(RSD%)采用Excel软件计算结果。
2.2.3 测定结果与分析
大鼠体内药代动力学参数表明,非诺贝特的原料药吸收非常缓慢,口服生物利用度非常低,但自制制剂生物利用度得到明显提高。相同给药情况下,非诺贝特自制制剂 Tmax为1.42 h,达峰质量浓度为(58.17± 14.43)μg/mL,吸收速率大于原料药,血药浓度曲线下面积比为原料药的38倍(自制制剂 AUC0-48/原料药AUC0-48)。详见图2和表11。证明自制制剂对其口服吸收具有非常重要的改善作用,提高了难溶性药物非诺贝特的溶解度和吸收。
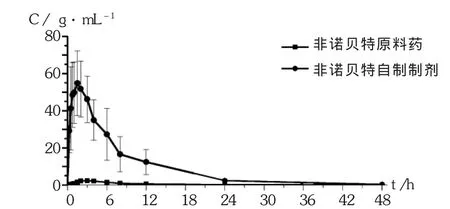
图2 Wistar大鼠单次口服非诺贝特原料药及自制制剂的混悬液后的平均血浆浓度-时间曲线(给药量27 mg/kg,n=6)
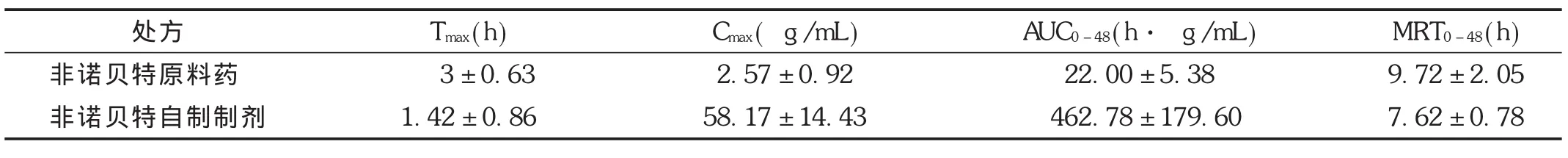
表11 Wistar大鼠单次口服非诺贝特原料药及自制制剂混悬液的动力学参数(给药量27 mg/kg,n=6)
3 讨论
调脂药非诺贝特口服后在胃肠道迅速吸收分布,分解代谢为活性代谢产物非诺贝特酸,转化为非活性代谢物后通过肾脏和粪便排除[7]。因此根据《化学药物非临床药代动力学研究技术指导原则》,并在文献[8]报道的基础上进行了改进,建立了非诺贝特酸在大鼠血浆中测定的HPLC法。文献[9-10]报道了气相色谱-质谱法、HPLC法[11-12]等用于非诺贝特口服后体内非诺贝特酸药代动力学的研究,但分离测定都较烦琐。本研究中采用HPLC法操作快速、简便,干扰少,影响因素少,分离度良好,灵敏度高,适合药代动力学或者毒代动力学研究中大量的样本分析。
文献[13]报道中建立了3倍量甲醇沉淀蛋白,高速离心后取上清液进样的方法,结果提取回收率为97.18% ~107.28%。本研究中采取了乙腈沉淀蛋白法提取,以血浆的2倍体积即可达到蛋白完全沉淀的效果,血样预处理的方法简便快捷,选择性好,提取率高,分析的效率高,方法绝对回收率为99.82%~105.50%,RSD<5%,且检出限低,测定过程稳定,分析费用低。本研究中,采用乙腈 ∶0.2%磷酸溶液(50∶50)为流动相系统,所得的样品保留时间合适,峰形对称,色谱分离度和重复性好,避免了流动相中加入缓冲盐残留在进样阀中对高效液相色谱泵、进样器和色谱柱的损伤,有利于样本快速、准确地检测。检测波长选择286 nm,为非诺贝特酸的最大吸收波长,灵敏度高,最低定量限达0.02 μg/mL,进样体积小[14]。选取了酮洛芬为内标,其溶解的特性及色谱行为与非诺贝特酸相似,具有合适的保留时间,提取回收率相近,血浆杂质对其无干扰,与非诺贝特酸峰之间无干扰,性质稳定,价廉易得,满足作为非诺贝特酸内标的要求。在方法学研究中分别对非诺贝特酸从样品采集、放置和配制等方面进行了稳定性研究,发现非诺贝特酸在样品提取后室温放置12 h,-20℃放置1,7,14 d,以及血浆样品冷冻前、冻融1次、冻融2次的稳定性均良好。
非诺贝特自制制剂大鼠灌胃给药后,其药代动力学参数 Tmax是原料药的0.5倍,而 Cmax是原料药的19倍,生物利用度是38倍,表明非诺贝特自制制剂在体内的吸收速度较原料药明显加快,吸收程度显著增加[15]。药-时曲线符合口服吸收的二室模型[16-17]。本研究中建立的HPLC法,成功地运用于检测大鼠血浆中非诺贝特的活性代谢产物非诺贝特酸,满足药代动力学研究的要求。在给药剂量范围内,非诺贝特酸在大鼠体内的药代动力学符合线性药代动力学规律。
综上所述,本研究中采用了比较简单的色谱条件检测了非诺贝特在大鼠血浆中的活性代谢产物非诺贝特酸的质量浓度,可及时、准确地计算非诺贝特的代谢率,为临床非诺贝特药物检测和体内药代动力学研究提供了有效的技术支持。
[1]刘秀美,王 凌,蒋学华.HPLC测定大鼠血浆中非诺贝特的活性代谢物及其药动学研究[J].华西药学杂志,2012,27(4): 424-427.
[2]Rosenson RS,Helenowski IB,Tangney CC.Heterogeneous Postprandial Lipoprotein Responses in the Metabolic Syndrome,and Response to Fenofibrate Therapy[J].Cardiovasc Drugs Ther,2010,24(5-6):439-447.
[3]郑 杨,张志丽,王立红,等.非诺贝特固体分散体制备工艺研究及比较[J].中国药剂学杂志(网络版),2012,10(2): 26-34.
[4]陈桂江.PEG化脂质纳米粒促进非诺贝特口服吸收的研究[D].广州:暨南大学,2015.
[5]陶小妹,孙路路,王淑梅,等.非诺贝特PEG_(2000)-DSPE胶束的制备及在大鼠体内的口服药动学研究[J].中国药师,2016,19(4):634-638.
[6]Zhang M,Li H,Lang B,et al.Formulation and delivery of improved amorphous fenofibrate solid dispersions prepared by thin film freezing[J].European journal of pharmaceutics and biopharmaceutics:official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik eV,2012,82(3):534-544.
[7]李 芳,俸灵林,阎 超.非诺贝特制剂研究进展[J].世界临床药物,2011,32(9):552-557.
[8]沈 敏,沈 腾,李中东,等.非诺贝特与代谢物的HPLC测定及在大鼠小肠淋巴转运中的应用[J].中国药学杂志,2011,46(9):686-690.
[9]张 丹,刘 曼,王晓琳,等.LC-MS/MS法测定人血浆中非
诺贝特酸[J].国际检验医学杂志,2013,34(13):1 688-1 690.
[10]马 飞,邢春宇,吴卓娜,等.HPLC-MS/MS测定比格犬血
浆中非诺贝酸浓度及其药代动力学研究[J].解放军药学学报,2013,29(3):196-199.
[11]赵燕燕,白 洁,苏 芳,等.高效液相色谱法同时测定体内辛伐他汀和非诺贝特酸的含量[J].中国医院药学杂志,2011,31(12):998-1 001.
[12]张 玮,刘守信.非诺贝特胶囊在健康人体内的药物代谢
动力学研究[J].中国现代医学杂志,2014,24(31):56-59.
[13]徐 帆,冯恩富,余 .HPLC法测定血浆中非诺贝特活性代
谢物非诺贝酸的浓度[J].中国药师,2007,10(6):530-532.
[14]冯沁心,黄琴琴,王永禄,等.非诺贝特纳米混悬剂大鼠体
内药动学及其与在体肠吸收动力学相关性[J].中国新药与临床杂志,2013,32(9):738-743.
[15]Zhu T,Aasquer JC,Kelly MT,et al.Comparison of the gastrointestinal absorption and bioavailability of fenofibrate and fenofibric acid in humans[J].Journal of Clinical Pharmacology,2010,50(8):914-921.
[16]Buch P,Languth P,Kataoka M,et al.IVIVC in Oral Absorption for Fenofibrate Immediate Release Tablets Using a Dissolution/Permeation System[J].Journal of Pharmaceutical Sciences,2009,98(6):2 001-2 009.
[17]费伟东,吴 超,邱 阳,等.介孔二氧化硅纳米粒增溶型非诺贝特片剂的制备及体内外研究[J].中国现代应用药学,2015,32(9):1 097-1 102.
Determination and Pharmacokinetic Study of Fenofibrate Active Metabolite in Rat Plasma by HPLC
Zhang Meimei,Lin Wei,Liu Xiaorui,Yin Yizi
(Affiliated Cancer Hospital of Guangzhou Medical University,Guangzhou,Guangdong,China 510095)
Objective To develop an HPLC method for determining the plasma drug concentration of fenofibrate active metabolitefenofibric acid.Methods Acetonitrile precipitated protei and ketoprofen were used as the internal standard.The column was Acclaim® 120 C18.The mobile phase consisted of acetonitrile-0.2% phosphoric acid solution(50∶50).The detection wavelength was 297 nm.Results The retention time of fenofibric acid and ketoprofen were about 9.1 min and 19.5 min,respectively.The standard curve was linear in the concentration range 0.02-100.00 μg/mL(r=0.999 4).The recoveries were 97.74% -104.13%.The RSD of intraand inter-day assays were both lower than 7%(n=5).Pretreated solution of fenofibric acid in human plasma was stable.Conclusion The bioavailability of self-made fenofibrate in rats is much higher than that of fenofibrate,which provides effective technical support for the clinical detection of fenofibrate and in vivo pharmacokinetics.
fenofibric acid;HPLC;plasma drug concentration
R965;R969.1;R972+.6
A
1006-4931(2016)21-0028-06
张媚媚(1984-),女,博士研究生,主管药师,研究方向为缓控释制剂与靶向制剂,(电话)020-66673666(电子信箱)zhmm03@hotmail.com;尹一子(1962-),女,硕士研究生,主任药师,研究方向为抗肿瘤药物的临床合理应用及个体化给药方案的设计,本文通讯作者,(电话)020-66673666(电子信箱)yinyizi6262@aliyun.com。
2016-07-13;
2016-08-22)
广州医科大学博士/出国留学启动基金,项目编号:2013C66。
