牛乳酪蛋白双联胶体金免疫层析试纸条的研制
2018-05-28薛海燕白文卿薛丽欢
薛海燕, 许 淼, 白文卿, 张 颖, 薛丽欢
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
乳及乳制品是人类生活中重要的营养来源.但婴幼儿易发生牛乳蛋白过敏症[1]从而引发腹痛、腹泻.乳制品中的αs1-酪蛋白(αs1-Casein,αs1-CN)是引起乳制品过敏的主要过敏原之一[2,3].在Muoz Martín T等[4]的研究中,羊乳的过敏发生率远远低于牛乳,羊乳中作为过敏原的αs1-CN含量较低,减少了过敏的可能性.其次羊乳中所含有的营养物质更加丰富,其中干物质营养含量一般比牛乳高10%左右,比母乳高5%左右[5],并且羊乳的各种营养物质相较于牛乳更接近于母乳且羊乳更易消化吸收[6].人体对于羊奶的吸收率在95%以上,对于乳糖不耐受人群也是更好的选择[7].但是乳羊是一种典型的短日照季节性动物,以农户散养为主,羊乳易受季节波动的影响[8],价格较高,所以一些不法商贩为了追求自身利益,在羊乳中掺入牛乳以降低成本.这种做法不仅是对消费者的欺骗,并且会对牛乳蛋白过敏者的身体健康造成威胁.
根据牛羊乳中主要成分蛋白质、脂肪和核酸的不同[9]可将牛羊乳区别检测方法分为三类.一是基于牛羊乳中蛋白质分子的构成不同利用反相高效液相色谱(RP-HPLC)[10],电泳、质谱[11]及免疫学方法进行检测,如SDS-聚丙烯酰胺凝胶电泳[12],酶联免疫吸附法(ELISA)[13,14];二是基于牛羊乳脂肪酸组成差异[15]的色谱及色谱-质谱(GC-MS)技术研究.三是基于牛羊乳中DNA利用PCR等[16,17]分子生物学技术方法.电泳及色谱方法区别检测牛羊乳时样品处理较费时,设备成本较高,在鲜奶收购现场时难以使用.因此,选择、建立一种快速检测羊乳中掺入牛乳的方法迫在眉睫.胶体金免疫层析技术是一种较为简便、快速的技术,是目前应用最为广泛的胶体金免疫检测技术模型.该技术操作简单,用时少,不需要其他仪器设备,且结果判断直观,适合于现场快速检测及大批量检测.
由表1可知,羊乳中总蛋白质含量高于牛乳,羊乳主要的蛋白质种类和牛乳大致相同[18],但相较羊乳,牛乳中αs1-CN含量较高,也有报道基于该蛋白的差异采用电泳方法进行检测[19].牛羊乳中β-乳球蛋白的含量虽然接近,但高级结构存在差别[20].因此,采用免疫学检测方法可以较好地进行鉴别.本文选择牛乳中α-CN及β-LG作为胶体金免疫层析中所应用的抗原,制备相应多克隆抗体,利用胶体金免疫层析技术制备试纸条,用于快速检测羊乳中牛乳掺假.

表1 羊乳与牛乳主要组分的含量
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料与试剂
雄性新西兰大白兔购自第四军医大学;鲜牛乳购自陕西西安草滩奶牛场;鲜羊乳购自陕西金牛乳业有限公司;标准β-LG、β-CN、α-LA、α-CN购自Simga公司;羊抗兔IgG、标准兔IgG购自北京博奥森生物技术有限责任公司;胶体金溶液购自上海杰一生物技术有限公司.
1.1.2 实验仪器
蛋白快速层析系统AKTAPURIFIER 100(GE Healthcare,各种凝胶介质)(北京百晶生物技术有限公司);Agilent1200 高效液相色谱系统(美国 Agilent 公司);400 MHz核磁共振波谱仪(德国--瑞士布鲁克公司 ADVANCEⅢ);酶标仪(芬兰 Wellscan-MK-3);凝胶电泳仪(Hoefer miniVE垂直电泳系统)与凝胶成像分析系统(南京捷达).
1.2 试验方法
1.2.1 多克隆抗体的制备及纯化
用牛α-CN、β-CN、κ-CN、α-LA、β-LG标准品免疫新西兰大白兔.期间采用酶联免疫法测定抗血清效价.用饱和硫酸铵盐析纯化抗体后,进行IgA亲和层析纯化从血清中提纯免疫球蛋白G(IgG). 具体方法参考文献[12].
1.2.2 金标抗体的制备
(1)最佳标记pH值的确定
用0.1 mol/L碳酸钾溶液调节胶体金溶液pH值至6.0、6.5、7.0、7.5、8.0、8.5、9.0,加入等量抗体,充分混合静置,平行试验3次,保持红色的最低 pH 值为最适 pH 值.
(2)最佳蛋白标记量的确定
将胶体金溶液调至最佳pH,分别加入0、2.5μL、5μL、7.5μL、10μL、12.5μL、15μL、17.5μL、20μL抗体蛋白,充分混合静置,平行试验3次,保持红色的最浅为最低蛋白标记量.最佳标记量为最低标记量加10%~30%.
(3)α-CN IgG与β-LG IgG最佳比例
根据金标抗体最佳pH及最佳蛋白标记量,按照β-LG IgG中α-CN IgG的掺入量为5%、10%、20%、30%、40%、50%配制金标溶液,平行试验3次,确定β-LG 和α-CN IgG的最适比例.
1.2.3 免疫层析试纸条的制备
(1)试纸条材料的选择
选用Millipore 135,Sartorius CN 95、140三种NC膜,用β-LG IgG、羊抗兔IgG分别包被检测线、质控线,然后将其浸入封闭液中进行处理,用处理过的三种NC膜分别组装试纸条,用PBS缓冲液、50μg/mL抗原标准溶液检测,平行试验3次,选择显色背景干净、灵敏性高、T线、C线显色清晰、层析速度快的NC膜进行试验.
选用封闭液处理过的玻璃纤维素膜VL68、VL78组装试纸条,检测PBS缓冲液、50μg/mL抗原标准溶液.观察NC膜上检测线的显色情况,平行试验3次,选择金标抗体释放完全,NC膜显色清晰的玻璃纤维素膜.
(2)质控线、检测线最佳包被抗体浓度的确定
质控线(C线)用浓度为0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL的羊抗兔IgG划线,检测线选择同系列的稀释浓度,将封闭处理后的NC膜组装成试纸条,用50μg/ml抗原标准溶液检测,比较不同包被浓度NC膜的显色情况,平行试验三次,选择浓度较低且显色较好的作为C线最佳包被浓度.
检测线(T线)分别用浓度为0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL的α-CN IgG(T1)、β-LG IgG(T2)划线,将封闭处理后的NC膜组装成试纸条,用50μg/mL抗原标准溶液检测,比较不同包被浓度NC膜的显色情况,平行试验三次,选择浓度较低且显色较好的作为T线最佳包被浓度.
(3)试纸条的组装
先将NC膜、玻璃纤维素膜、样品垫处理好备用,取专用的PVC板,先粘贴大小处理好的NC膜,再贴上适当大小的吸附有金标抗体的玻璃纤维素膜,玻璃纤维素膜与NC膜有约2 mm的重叠,以便溶液的层析.按相同方法,依次贴上吸水垫、样品垫,各材料相接处重叠约2 mm,最后采用手工切割的方法,试纸条按0.4 cm/支切割,制作好的试纸条加干燥剂一起装入密封内保存.
(4)试纸条检测方法
将抗原标准溶液或样品液放入微孔板内,将试纸条浸入溶液中,检测样品经样品垫、金标垫、NC膜最终被吸水垫吸收.5~15 min 后, 观察检测结果.若质控线有条带,说明试纸条有效,检测线T2有条带,说明检测样中含有乳源β-LG,检测线T1有条带,说明样品中牛乳掺入量大于可检测到的最低掺假浓度, 检测线T1没出现条带,说明样品中牛乳掺入量小于最低掺假浓度.
1.2.4 试纸条的特性检测
(1)试纸条灵敏性检测
向β-LG标准溶液中分别加入3%、5%、10%、20%、30%、40%、50%的α-CN标准溶液,用试纸条分别进行检测,平行试验3次,观察比较显色情况.
(2)试纸条特异性检测
选择牛源α-CN,β-CN,κ-CN,BSA、α-LA、β-LG标准品作为交叉反应原检测所制备试纸条,用PBS缓冲液配制50μg/mL的标准品,用试纸条检测不同蛋白标准品种,平行试验3次,观察比较显色情况.
1.2.5 牛羊乳混合样品检测
向羊乳中分别加入3%、5%、10%、20%、30%、40%、50%的牛乳构成牛羊乳混合样品10μL,用PBS缓冲液稀释为100μL的样品溶液,用试纸条分别进行检测,平行试验3次,观察比较显色情况.
2 结果与讨论
2.1 特异性多克隆抗体浓度及效价的测定
用考马斯亮蓝测得多克隆抗体α-CN IgG和β-LG IgG的蛋白质浓度分别为4.86 mg/mL和5.99 mg/mL.用间接ELISA法测定两种抗体的效价为1∶25 600和1∶204 800,见图1及图2所示.该抗体的特异性良好,无明显的交叉反应.

图1 α-CN抗体效价检测

图2 β-LG抗体效价检测
2.2 金标抗体的最佳条件
2.2.1 最佳标记pH
根据图3,在pH为8.0时,红色最浅且颜色不退去,故确定pH 8.0为最佳标记pH.

图3 最佳标记pH
2.2.2 最佳蛋白标记量的确定
根据图4,在加入量为7.5μL时红色最浅且颜色不退去,故以7.5μL为最低标记量,选择10μL作为最佳标记量.

图4 最佳蛋白标记量(单位: μL)
2.3 免疫层析试纸条的研制
2.3.1 试纸条材料的选择
(1)硝酸纤维素膜(NC膜)的选择
由表2及图5所示,硝酸纤维素膜Sartorius NC 95扩散时间短,且检测线和质控线颜色清晰,选择该NC膜做后续试验.

表2 不同NC膜检测
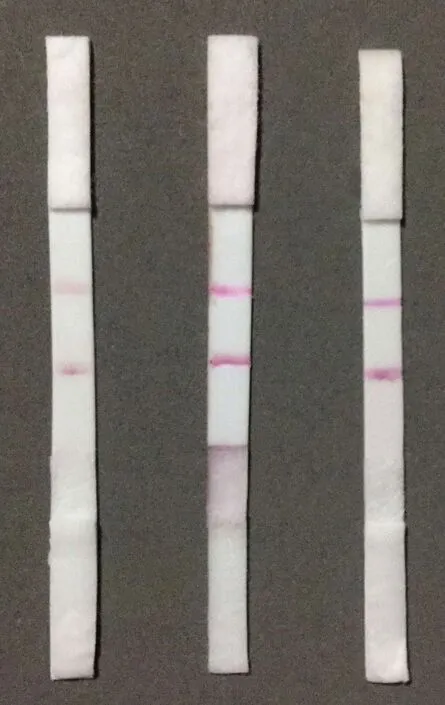
左:Millipore 135;中:Sartorius CN 95;右:Sartorius CN 140图5 不同NC膜检测结果图
(2)玻璃纤维素膜的选择
根据表3及图6,选择VL68作为金标垫.

表3 不同玻璃纤维素膜检测

左:VL68;右:VL78图6 不同玻璃纤维素膜检测结果图
2.3.2 检测线、质控线最佳包被抗体浓度的确定
(1)NC膜上质控线及检测线包被浓度的选择
根据表4,选择C线二抗最佳包被浓度为1.0 mg/mL.T线最佳包被浓度、α-CN及β-LG包被浓度均为1.0 mg/mL.以上最佳包被量均为6μL.
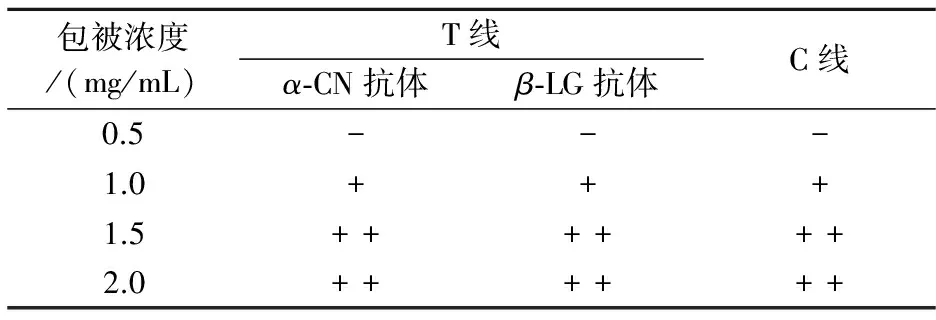
表4 检测线、质控线最佳包被抗体浓度
(2)α-CN IgG与β-LG IgG最佳比例
根据表5,金标垫上α-CN与β-LG最佳比例为20%.
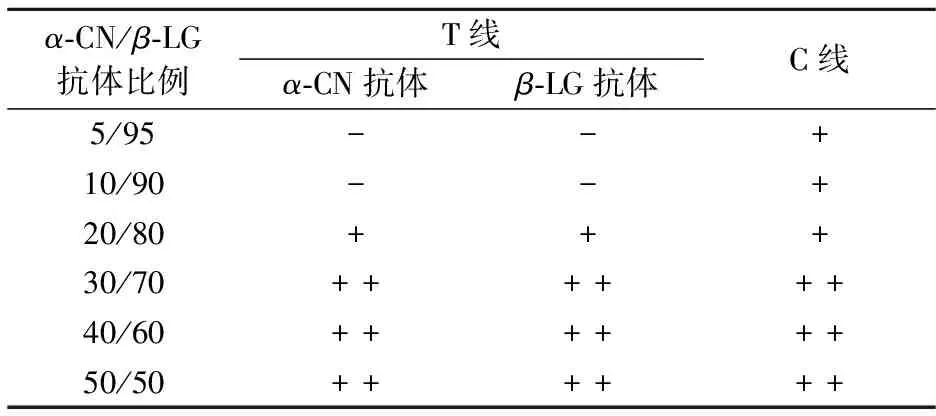
表5 α-CN与β-LG比例
注:“+ +”表示强阳性;“+”表示阳性;“-”表示阴性
2.4 试纸条的特性检测
2.4.1 试纸条灵敏性检测
根据表6,用试纸条检测抗原标准溶液,当β-LG标准溶液中α-CN标准液掺入量为5%时试纸条检测线T1(α-CN)即显色,且α-CN标准液掺入量低于5%时不显色,故试纸条的最低检测限为5%.

表6 试纸条灵敏度检测
注:“+ +”表示强阳性;“+”表示阳性;“-”表示阴性.
2.4.2 试纸条特异性检测
根据表7,试纸条检测α-CN、β-LG抗原溶液时显色,对其余抗原溶液不显色,无明显的交叉反应,表明该试纸条对牛乳α-CN具有良好的特异性.

表7 试纸条特异性检测
注:“+”表示阳性;“-”表示阴性.
2.5 牛羊乳样品检测
根据表8,用试纸条检测牛羊乳混合样品,当牛乳掺入量为5%时试纸条检测线T1(α-CN)即显色,且牛乳掺入量低于5%时不显色,故试纸条的最低检测限为5%.

表8 试纸条特异性检测
注:“+”表示阳性;“-”表示阴性.
由于羊乳和牛乳的性质和成分非常相似,所以对羊乳中掺入的牛乳检测较为困难.张歌[5]利用非变性电泳方法对酪蛋白进行分析比较,掺假在10%以上可以显著地将牛羊乳进行区别.但该种方法耗时,需要专业的仪器设备及实验条件,对于实验操作也有严格的要求.
随着检测技术的不断发展,出现了利用低场核磁共振检测牛羊乳的掺假.姜潮等[21]利用这一方法,并与PCA[22]主成分分析法进行结合,可以将牛乳中的不同掺假物质得到较好的鉴别.但该方法需要核磁共振分析仪,只适用于实验室的检测.同样,质谱法中所用到的样品也需要提前处理纯化至一定浓度后才可以进行检测.
分子生物学的发展使得牛羊乳掺假检测的方法更为多样.利用PCR[17,23](聚合酶链式反应)对牛羊的线粒体中的DNA序列进行分析,以此区分牛羊乳.该方法的特异性强,反应灵敏,检测线可低至1%,但乳中DNA含量非常低,因此该检测技术需稳定的DNA提取方法,且试剂成本昂贵.
基于两种乳在蛋白质上的差异,可建立免疫学方法进行两者的区别.可采用酶[13]、荧光[24]或胶体金[25]等对相应抗原抗体进行标记后检测.免疫学的检测方法特异性较好,检测结果较为准确.尤其是胶体金标记后,制备成试纸条,检测操作简便,时间短,显色即可辨别,非常不适用于现场检测.本文建立的方法,以α-CN、β-LG两种蛋白为检测目标,提高检测的准确性,检测限在5%,试纸条具有较好特异性,可用掺假样品的初步筛选中.但该试纸条仍存在一些问题,其中α-乳白蛋白会与β-LG发生一定交叉反应,还需进一步改进.若采用单克隆抗体,检测特异性和灵敏度会进一步提高.
3 结论
本实验利用胶体金免疫层析技术研制的试纸条用于检测羊乳中掺入牛乳的掺假中,相较于其他检测方法,该方法较为快速简便,不需要大型仪器,成本较低,可用于现场检测,且可在15min内得到检测结果.该实验制得多克隆抗体α-CN IgG和β-LG IgG的蛋白质浓度分别为4.86 mg/mL和5.99 mg/mL,两种抗体的效价为1∶25 600和1∶204 800,该抗体的特异性良好,无明显的交叉反应.该实验制备胶体金溶液最适pH值为8.0,最佳蛋白标记量为10μL,且β-LG IgG中α-CN IgG的最适掺入量为20%.该试纸条选择玻璃纤维素膜VL68做为金标垫,选择硝酸纤维素膜SarteriesCN 95作为NC膜,并分别用6μL,1 mg/mL的α-CN IgG,6μL,1 mg/mL的β-LG IgG包被T线,用6μL,1 mg/mL二抗包被C线.该试纸条可特异性的检测出α-CN和β-LG,可检出的牛乳最低掺入量为5%.
目前,该技术在国外应用更为普遍,而国内没有试纸条成品生产,市场上所应用的试纸条多为国外进口产品.而与此同时,国内食品安全检测急需加强,因此需要更快速更准确的方式来促进食品安全问题的解决.免疫层析技术在食品安全检测方面的应用在我国有一定的发展空间,应该得到更为深入的研究及广泛应用.
[1] 胡长利,陈历俊,宋小红,等.乳源过敏及低致敏乳制品的研究[J].中国乳品工业,2011,39(3):42-45.
[2] 毛露甜,向军俭,张在军.牛乳中主要过敏原组分的分离纯化及鉴定[J].食品科学,2007,28(5):305-308.
[3] 符海英.大肠杆菌O157∶H7和乳源蛋白胶体金免疫层析试纸条的研制[D].西安:陕西科技大学,2012.
[5] 张 歌.牛乳和羊乳蛋白质差异比较及检测方法的研究[D].西安:陕西科技大学,2013.
[6] Tomotake Hiroyuki,Okuyama Ryoko,Katagiri Mitsuaki,et al.Comparison between Holstein cow′s milk and Japanese-saanen goat′s milk in fatty acid composition,lipid digestibility and protein profile[J].Bioscience,Biotechnology,and Bio-chemistry,2006,70(11):2 771-2 774.
[7] 王逸斌,朱 晗,朱凌燕,等.全羊乳蛋白配方羊奶粉对婴儿生长发育的影响研究[J].中国食物与营养,2013,19(8):78-81.
[8] 张晓旭,葛武鹏,李宝宝,等.牛羊乳混掺检测鉴别技术研究进展[J].食品安全质量检测学报,2015,6(9):3 594-3 601.
[9] 薛建龙.牛羊乳中蛋白质和脂肪的差异比较研究[D].西安:陕西科技大学,2015.
[10] Chen R K,Chang L W,Chung Y Y,et al.Quantification of cow milk adulteration in goat milk using high-performance liquid chromatography with electrospray ionization mass spectrometry[J].Rapid Commun Mass Spectr,2004,18(10):1 167-1 171.
[11] 雷颖颖.乳制品中蛋白质RP-HPLC指纹图谱的建立及其在乳源分析和乳制品质量控制中的应用[D].杭州:浙江大学,2017.
[12] 程 妮.牛羊乳蛋白质的双向电泳分析及免疫检测技术研究[D].西安:陕西科技大学,2017.
[13] 袁耀武,李 聪,明若阳,等.利用竞争酶联免疫吸附法测定牛血清白蛋白鉴别掺假牛乳[J].食品科技,2017,42(3):290-293.
[14] 褚晓红.牛乳中α-酪蛋白三种ELISA检测方法的研究[D].长春:吉林大学,2014.
[15] 葛武鹏,李元瑞,陈 瑛,等.牛、羊乳及其制品的脂肪酸组成分析[J].西北农林科技大学学报,2008,36(7):173-178.
[16] 陈筱婷.乳及乳制品真实属性多重实时荧光PCR检测方法研究[D].广州:华南理工大学,2016.
[17] 李 洁,童 锐,李向伟.实时荧光定量PCR法鉴别生鲜羊乳中牛源性成分[J].中国乳品工业,2016:44(10):38-39,42.
[18] 宋 蓓,宋桂雪,宋 薇.羊乳制品中牛乳源成分的鉴别检测技术[J].食品科学技术学报,2016,34(6):69-74.
[19] 宋宏新,刘 静,张 歌,等.变性与非变性电泳对牛羊乳蛋白质差异比较研究[J].陕西科技大学学报(自然科学版),2013,31(6):109-113.
[20] Lin S,Sun J,Cao D,et al.Distinction of different heat-treated bovine milks by native-PAGE fingerprinting of their whey proteins[J].Food Chemistry,2010,121(3):803-808.
[21] 姜 潮,韩剑众,范佳利,等.低场核磁共振结合主成分分析法快速检测掺假牛乳[J].农业工程学报,2010,26(9):340-344.
[22] 常玉清,王 姝,王福利,等.基于多PCA模型的过程监测方法[J].仪器仪表学报,2014,35(4):901-908.
[23] A Di Pinto,V Terio,P Marchetti,et al.DNA-based approach for species identification of goat-milk products[J].Food Chemistry,2017,229:93-97
[24] L Dvorak,J Mlcek,K Sustova.Comparison of FT-NIR spectroscopy and ELISA for detection of adulteration of goat cheeses with cow′s milk[J].Journal of Aoac International,2016,99(1):180-186.
[25] P Galan Malo,I Mendiara,P Razquin,et al.Validation of a rapid lateral flow method for the detection of cows′ milk in water buffalo,sheep or goat milk[J].Food Additives & Contaminants.Part A,2018,35(4):599-604.
