乳酸菌生物富硒作用研究
2018-05-28吕嘉枥常若毅
徐 颖, 康 超, 吕嘉枥, 张 勇, 常若毅
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
硒是人体一种必需的微量元素,是谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)、 碘化甲腺氨酸脱碘酶(iodothyronine deiodinases,ID)、硫氧还蛋白还原酶(thioredoxin reductase,TR)等许多酶活性中心的必需组分,具有抗氧化、保护心血管和心肌的健康、抗肿瘤活性、调节免疫等[1-3]多种生理功能,近些年一直备受关注.流行病学研究显示,缺硒易患克山病,临床表现为气喘、呼吸困难、食欲不振、肝脏肿大等循环功能障碍[4].国内外专家称其为“生命的火种”、“抗癌之王”、“心脏的守护神”[5].补硒的来源主要有无机硒和有机硒,而无机硒的毒性比有机硒的毒性大,同时有机硒的安全性更高,不易发生硒中毒,也易被机体吸收,所以特别受青睐[6,7].乳酸菌因其突出的益生作用而被广泛用于食品领域,用来发酵食品及饮料.大量研究表明,通过微生物的生物转化作用,可以将无机硒转化为有机硒而更有利于机体吸收利用,相对于人工转化而言,既便宜又安全[8].本研究通过对乳酸菌富硒以及转化能力的研究,分析确定最佳富硒条件,以获得乳酸菌对硒富集作用的相关数据,为乳酸菌富硒产品的研究提供依据.
1 材料与方法
1.1 材料与试剂
菌种,保加利亚乳杆菌(Lactobacillus bulgaricus,LB)、鼠李糖乳杆菌(Lactobacillusrhamnosus,LR)、双歧杆菌(Bifidobacteria,B)、干酪乳杆菌(Lactobacilluscasei,LC)、副干酪乳杆菌(Lactobacillusparacase,LPC)、植物乳杆菌(Lactobacillusplantarum,LPA),均由实验室提供;亚硒酸钠,山东西亚化学工业有限公司;MRS培养基,北京陆桥技术股份有限公司.其他试剂均为分析纯.
1.2 仪器
722E型分光光度计,上海光谱仪器有限公司;VEGA-3-SBH扫描电镜-能谱仪,捷克TESCAN公司;SCIENTZ-18N压盖型冷冻干燥机,新芝冻干设备公司.
1.3 实验方法
1.3.1 菌种活化
为了提高菌种的活力,将各菌株接种到液体MRS培养基中,置恒温培养箱中37 ℃下培养24~48 h,连续活化三代.
1.3.2 筛选耐硒菌株
(1)亚硒酸钠浓度的初步确定
MRS液体培养基加入预先灭菌的100μg/mL的亚硒酸钠溶液,制成含亚硒酸钠 0μg/mL、5μg/mL、10μg/mL、15μg/mL、20μg/mL、50μg/mL的液体培养基,种子液以1 %(w/v)接种量接种至含硒培养基中,37 ℃适宜条件下培养24 h,观察菌体颜色变化,确定初始亚硒酸钠浓度.
(2)耐硒菌株的筛选
以初步确定的亚硒酸钠浓度,配制成含亚硒酸钠的MRS液体培养基,接种量为1%(w/v),置于恒温培养箱中37 ℃培养24 h.通过比较OD600nm值可以判断菌株间的生长差异,从而筛选出更耐硒的菌种.
1.3.3 富硒菌株培养条件的优化
(1)标准曲线的绘制
参考文献[9],采用3,3-二氨基联苯胺比色法测定硒含量.
(2)富硒菌株富硒率的计算
①残留无机硒含量的测定
取适量发酵液8 000 r/min离心20 min,取10 mL上清液于100 mL容量瓶中,蒸馏水稀释至刻度,取5 mL稀释液于50 mL烧杯中,加水至35 mL,加入5% EDTA-2Na溶液2 mL,以下步骤同标准曲线绘制,同时做空白对照.以空白对照调零,测定样品吸光值,所得数据在标准曲线上查出相应的硒含量,乘以相应的倍数,此为残留的无机硒含量.
②富硒菌株富硒率按式(1)计算:

(1)
(3)单因素实验
①最佳亚硒酸钠浓度的选择
配制含亚硒酸钠6μg/mL、8μg/mL、10μg/mL、12μg/mL、14μg/mL的液体培养基,种子液以1%(w/v)接种量接种,置培养箱中37 ℃下培养24 h.取出测定上清液中残留的无机硒含量,每组重复测定3次取平均值,按式(1)计算富硒率,根据富硒率的差异来确定最佳亚硒酸钠浓度范围.
②最佳培养温度的选择
以初始亚硒酸钠浓度配制成液体培养基,种子液以1%(w/v)接种量接种至液体培养基中,分别在33 ℃、35 ℃、37 ℃、39 ℃、41 ℃下培养24 h.取出测定上清液中残留的无机硒含量,每组重复测定3次取平均值,按式(1)计算富硒率,根据富硒率的差异来确定最佳培养温度范围.
③最佳硒添加时间的选择
100μg/mL亚硒酸钠溶液,灭菌后备用.种子液以1%(w/v)接种量接种于液体培养基中培养,在6 h、7 h、8 h、9 h、10 h加入100μg/mL亚硒酸钠溶液,使浓度稀释至初始亚硒酸钠浓度,培养至24 h.取出测定上清液中残留的无机硒含量,每组重复测定3次取平均值,按式(1)计算富硒率,根据富硒率的差异来确定最佳硒添加时间范围.
(4)响应面法优化培养条件
综合单因素实验的结果,选取亚硒酸钠浓度、加硒时间、培养温度3个因素为自变量,采用Design-Expert软件对实验数据进行回归分析,优化培养条件.
1.3.4 富硒量的测定
(1)样品处理
取优化条件下培养的菌悬液离心得菌体培养物,烘干置恒重,称重后放入带刻度具玻璃塞10 mL 试管中,加入硝酸-高氯酸溶液(5∶1,v/v)0.6 mL,放置过夜.然后将试管置于100 ℃水浴锅中加热 4 h.当试管内黄褐色气体排尽后,取出冷却,加入30%过氧化氢溶液2 mL,继续置于沸水浴中消化,至消化液呈现无色或淡黄色即达终点.取出试管冷却后,以超纯水定容至10 mL,同时做空白对照.
(2)测定菌体细胞内硒含量
以空白对照调零,测定方法同标准曲线的绘制.
(3)富硒量的计算
菌体细胞内富硒量的计算按式(2)进行:

(2)
1.3.5 扫描电镜-能谱分析菌体细胞硒形态
取20 mL菌悬液离心得菌体置于1.5 mL离心管中,加入2.5%(w/v)的戊二醛,在37 ℃下固定4 h,PBS(pH 7.2)清洗3次后,梯度乙醇脱水,并加入等体积的乙酸异戊酯置换乙醇,每次持续20 min.之后弃去乙酸异戊酯,将样品于-20 ℃条件下预冻12 h后,冻干.对样品进行喷金后,于扫描电镜-能谱仪下观察菌体表面状态[10,11].
2 结果与讨论
2.1 初始亚硒酸钠浓度结果分析
由表1可知,培养24 h后观察菌液,随着亚硒酸钠浓度的增加,菌体颜色逐渐加深,当亚硒酸钠浓度为10μg/mL时,部分菌株表面出现了红色,这是由于乳酸菌将无机硒转化为单质硒的结果,而非有机硒,而当浓度再增大时,所有菌株都出现了不同程度的红色,所以在初筛菌种时选择亚硒酸钠浓度为10μg/mL适宜.单质硒的形成机制可能为谷胱甘肽GSH介导的还原模式,GSH与SeO32-生成GS-Se-SG,GS-Se-SG在GSH还原酶的作用下生成GS-Se-,GS-Se-不稳定,最终分解成Se和GSH[12,13].
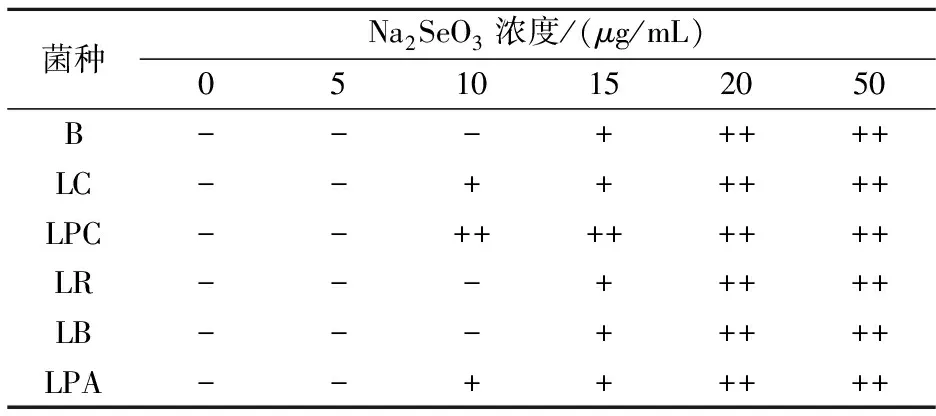
表1 菌株表面颜色变化情况
2.2 耐硒菌种筛选结果分析
由表2可知,经比较加硒与不加硒的乳酸菌OD600nm值发现,添加10μg/mL亚硒酸钠后,除了双歧杆菌、鼠李糖乳杆菌、植物乳杆菌的OD600nm值有增加外,其他菌株均有不同程度的降低,说明10μg/mL的亚硒酸钠的添加量能抑制其他3种菌株的生长,而促进了双岐杆菌、鼠李糖乳杆菌、植物乳杆菌的生长.OD600nm值增加的顺序为:鼠李糖乳杆菌>双歧杆菌>植物乳杆菌,而鼠李糖乳杆菌的OD600nm值明显高于其他两种菌,说明鼠李糖乳杆菌在含硒培养基中生长情况较其他两种菌好,确定鼠李糖乳杆菌为耐硒菌种.

表2 各菌种OD600nm值测定结果
2.3 单因素实验结果分析
2.3.1 亚硒酸钠浓度对富硒率的影响
由图1可知,培养基中亚硒酸钠的浓度会影响菌株的生长及对硒的富硒作用.浓度在6~12μg/mL范围内,菌株富硒率呈增加的趋势,即促进菌株的生长,从而提高菌株富硒率.当浓度超过12μg/mL时,富硒率下降较快,此浓度抑制了菌株的生长,不利于对硒的富集.浓度在8~12μg/mL范围内,富硒率趋于平稳,确定适宜的亚硒酸钠浓度应控制在8~12μg/mL范围内.杨鹤[14]在进行富硒研究时,将亚硒酸钠浓度应控制在10μg/mL.
2.3.2 培养温度对富硒率的影响
由图2可以看出,不同的培养温度对菌株富硒率有影响.随着温度的增加,菌株的富硒率先增加后降低,并且在37 ℃左右富硒率达到最大,确定培养温度应控制在37 ℃左右为宜.
2.3.3 加硒时间对硒富硒率的影响
由图3可以看出,加硒时间对菌株富硒率影响较大.随着加硒时间的延后,富硒率逐渐下降.加硒时间越迟,菌株对硒的利用越不充分,因此,选择乳酸菌对数生长期的初期加入亚硒酸钠,有利于菌株对硒的富集.

图1 亚硒酸钠浓度对菌株富硒率的影响
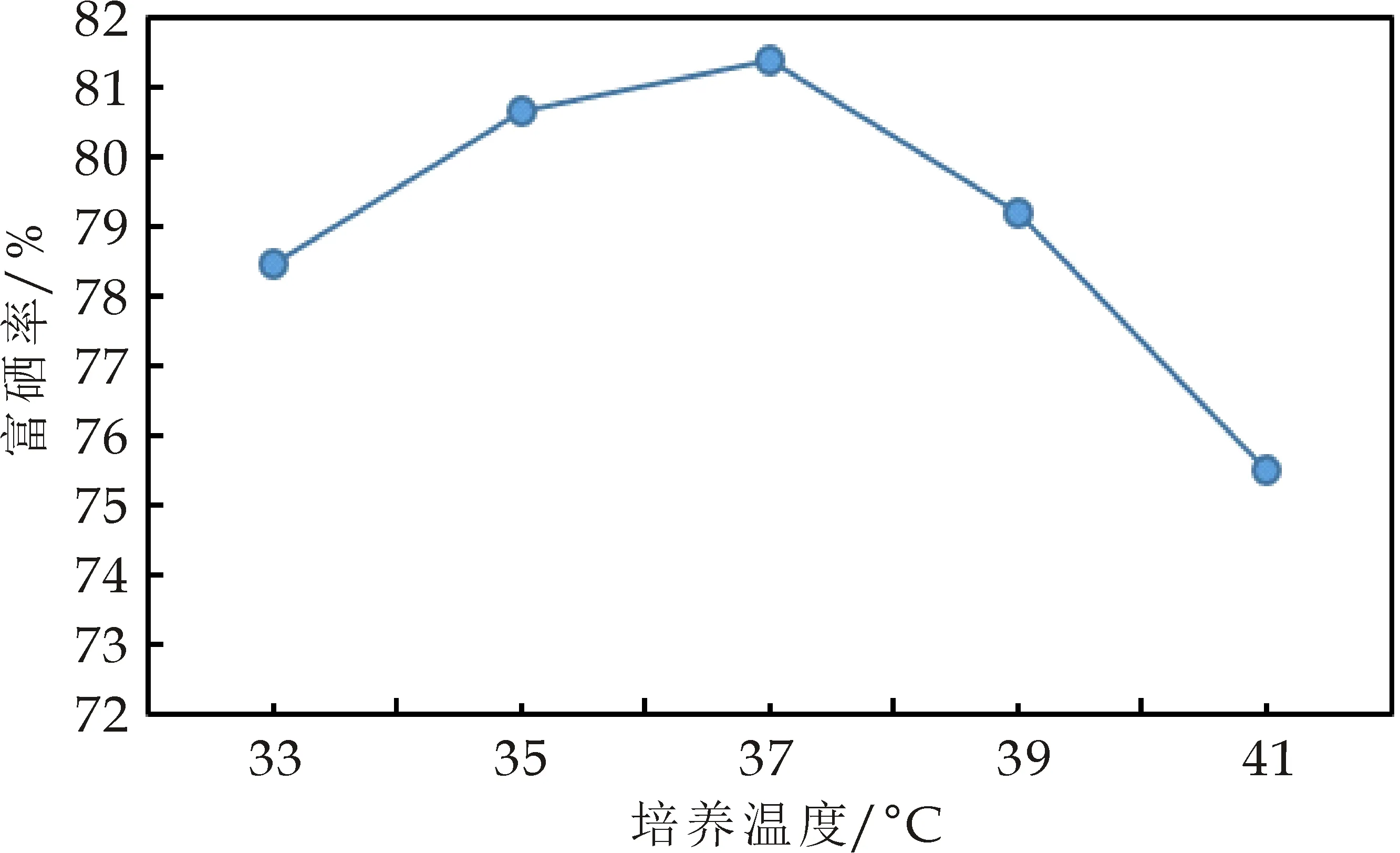
图2 培养温度对菌株富硒率的影响

图3 加硒时间对菌株富硒率的影响
2.4 响应面法优化结果的分析
综合单因素实验的结果,采用响应面法,依据Box-Behnken中心组合试验设计原理,对菌株培养条件进行优化,选择亚硒酸钠浓度、培养温度、加硒时间三个因素进行考察. 响应面试验各因素水平表如表3所示,试验设计方案及结果如表4所示.
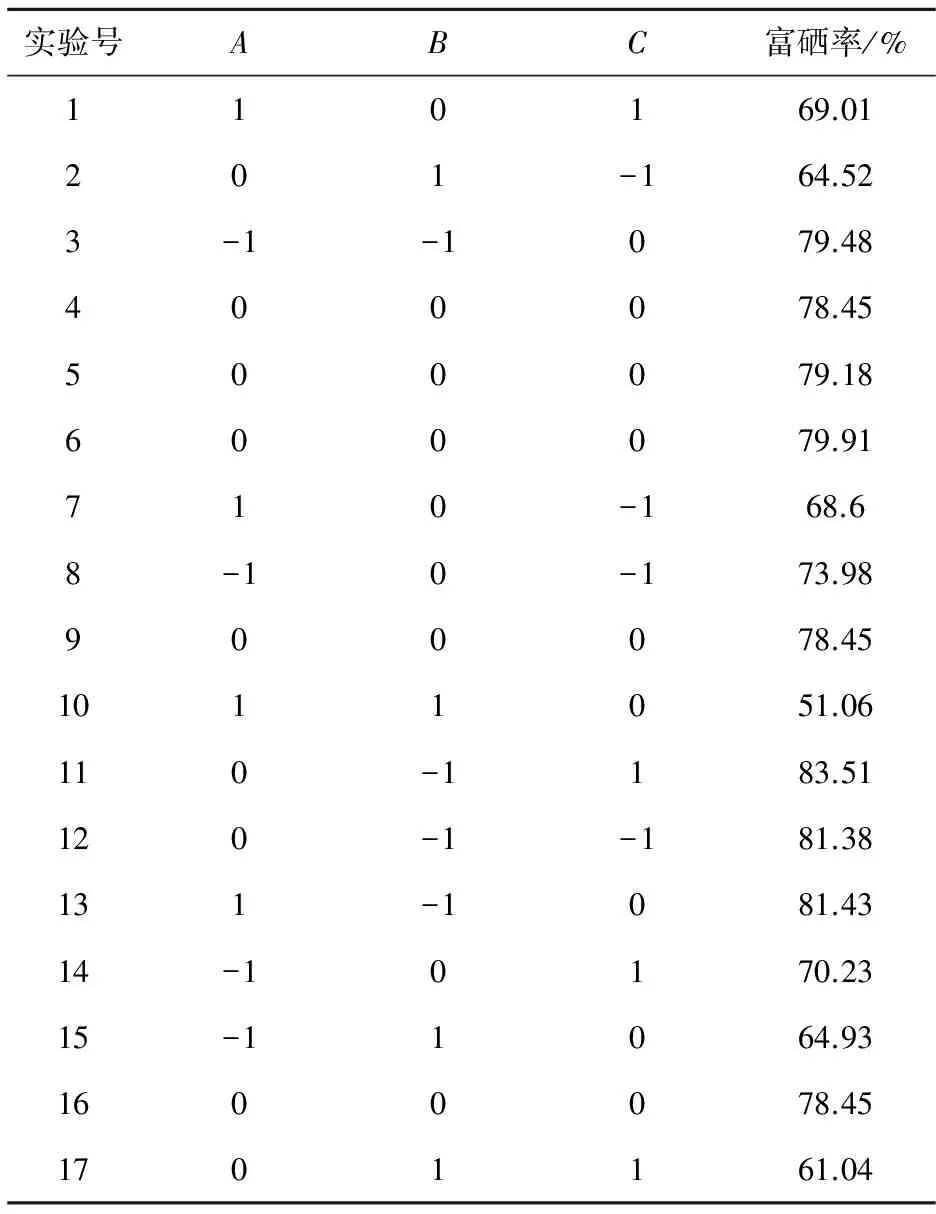
表4 试验设计方案及结果
2.4.1 回归模型的建立及显著性分析
利用Design-Expert 8.0.6软件,对多项式回归分析,得到的二次回归方程为:
富硒率=78.89-2.31×A-10.91×B-
0.21×C-3.96×A×B﹢1.04×A×C-
2.15×B×C-6.29×A2-3.38×B2-
2.15×C2
由上式可以看出,在各因素对富硒率的影响中,一次项的偏回归方程系数的绝对值从大到小依次为B>A>C,说明加硒时间对富硒率的影响最大,其次是亚硒酸钠浓度,而培养温度影响最小.回归模型的方差分析如表5所示.
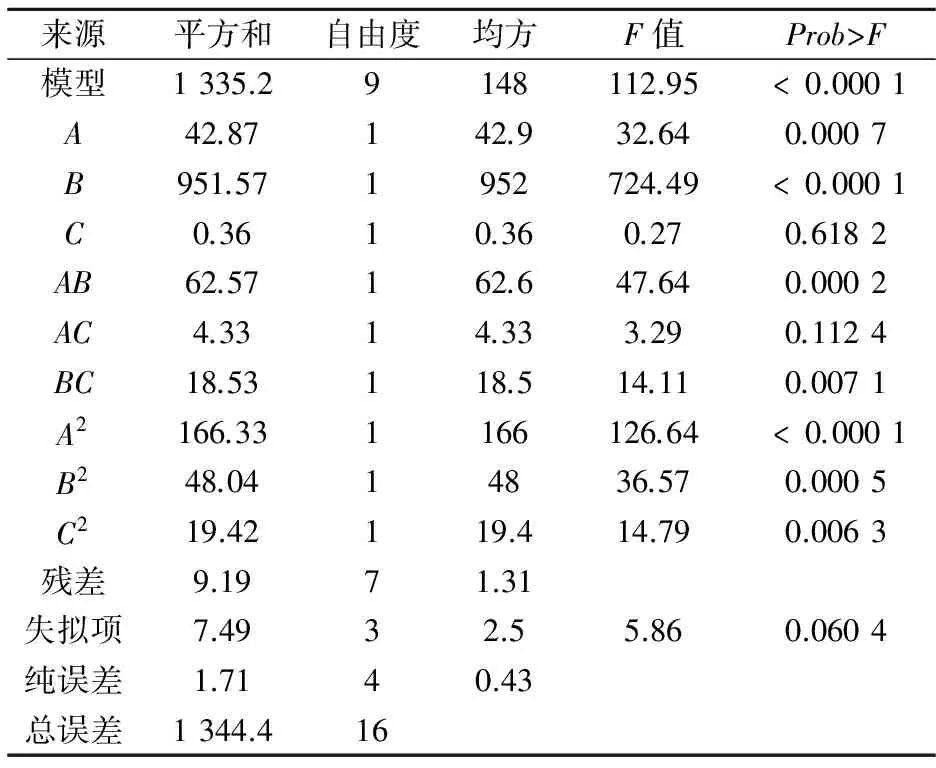
表5 方差分析表
注:Prob>F值小于0.05为影响显著,Prob>F值小于0.01为影响极显著,Prob>F值大于0.05 为影响不显著.
由表5可知,模型Prob>F值小于0.000 1,方程极其显著.模型的相关系数R2=0.993 2,表示可以使用该模型来分析响应值.失拟项的值大于0.05不显著,表示回归模型适合,实验数据可靠,分析结果可靠.
2.4.2 培养条件优化结果
通过Design-Expert 8.0.6软件进行分析,得到最佳培养条件为:亚硒酸钠浓度10μg/mL,加硒时间6 h,培养温度38 ℃,预期富硒率为83.03%.经验证实验得出富硒率为85.50%,与预期的结果相近,说明优化结果可靠.
2.5 扫描电镜-能谱结果分析
对菌株表面做扫描电镜及能谱分析,分别如图4和图5所示.不添加硒培养的菌株表面光滑,无其他物质附着,但在含10μg/mL亚硒酸钠的MRS培养基培养后,菌株表面附着有一些颗粒物质,通过能谱分析可知表面颗粒物质为硒单质.这就验证富硒培养菌体表面出现的红色硒单质是经生物转化而成的.杨靖鹏[15]对保加利亚乳杆菌(Lactobacillusdelbrueckiissp.bulgaricus)及嗜热链球菌(Streptococcusthermophilus)富硒后进行扫描电镜-能谱分析,同样发现菌体表面有硒的颗粒.有研究表明,无机硒还会进入到菌体内部被转化成硒代半胱氨酸,进而合成硒蛋白[16].但硒在菌体的分布规律尚不明确,有待进一步研究.

图4 菌株的SEM及能谱分析结果

图5 富硒菌株的SEM及能谱分析结果
3 结论
本研究从6株乳酸菌中筛选出具有较强耐硒能力的鼠李糖乳杆菌,响应面法优化菌株富硒的培养条件,最优条件为亚硒酸钠浓度10μg/mL,加硒时间6 h,培养温度38 ℃时,菌体富硒率可达85.50%,硒含量可达197.47μg/g.加硒时间对富硒率的影响最大,其次是亚硒酸钠浓度,培养温度影响最小.扫描电镜-能谱法表征说明鼠李糖乳杆菌将无机硒生物转化单质硒,并存在于菌体表面.对于菌体内富硒的规律及硒的分布有待进一步研究.
[1] Galano E,Mangiapane E,Bianga J,et al.Privileged incorporation of selenium as selenocysteine inLactobacillusreuteri proteins demonstrated by selenium-specific imaging and proteomics[J].Molecular & Cellular Proteomics,2013,12(8):2 196-2 204.
[2] Pieniz S,Andreazza R,Pereira J Q,et al.Production of selenium-enriched biomass by enterococcus durans[J].Biol.Trace Elem.Res.,2013,155(3):447-454.
[4] 颜 超,方 位,李小平,等.克山病病情现状和病因学进展[J].心血管病学进展,2017,38(2):225-229.
[5] El Ramady H R,Éva Domokos Szabolcsy,Abdalla N A,et al.Selenium and nano-selenium in agroecosystems[J].Environmental Chemistry Letters,2014,12(4):495-510.
[6] Liu H Y,Zhu W Z,Lu B Y,et al.Effect of feed selenium supplementation on milk selenium distribution and mozzarella quality[J].Journal of Dairy Science,2015,98(12):8 359-8 367.
[7] Pophaly S D,Poonam,Singh P,et al.Selenium enrichment of lactic acid bacteria and bifidobacteria: A functional food perspective[J].Trends in Food Science & Technology,2014,39(2):135-145.
[8] 杨善岩,李海龙,狄志鸿.硒元素生理功能及微生物富硒发酵研究现状[J].食品工业,2013,34(6):167-170.
[9] 曾议霆,郭溪浪,周 康,等.富硒乳酸菌的筛选及鉴定[J].食品科学,2015,36(3):178-182.
[10] 刘红芳.乳酸菌源纳米硒的表征及生物学效应研究[D].南昌:南昌大学,2014.
[11] 袁 峥,赵瑞香,牛生洋,等.酸胁迫下嗜酸乳杆菌菌体形态的扫描电镜观察[J].食品工业科技,2012,33(24):199-201.
[12] Kessi J,Hanselmann K W.Similarities between the abiotic reduction of selenite with glutathione and the dissimilatory reaction mediated by rhodospirillum rubrum and escherichia coli [J].Journal of Biological Chemistry,2004,279(49): 50 662-50 669.
[13] Eszenyi P,Sztrik A,Babka B,et al.Elemental,nano-sized (100-500 nm) selenium production by probiotic lactic acid bacteria[J].International Journal of Bioscience,Biochemistry and Bioinformatics,2011(2):148-152.
[14] 杨 鹤.五种乳酸菌富硒能力的研究[D].哈尔滨:东北农业大学,2015.
[15] 杨靖鹏.乳酸菌对微量元素的富集及其生物活性评估[D].杨凌:西北农林科技大学,2017.
[16] Bulteau A L,Chavatte L.Update on selenoprotein biosynthesis[J].Antioxidants & Redox Signaling,2015,23(10):775-794.
