基于课堂实证的分子间作用力对话式课堂构建
2018-05-03李发顺
摘 要:“分子间作用力”是化学学科的重要概念,既要知道其存在及对分子晶体物理性质的影响,又不探讨分子极性与溶解性关系和氢键种类,既把抽象的作用力用熟悉的电荷作用来解释,又将微观世界的作用宏观的表示,既学习看似独立的知识,又通过反刍将其系统化。在科学原理本质理解中构建“对话式”课堂。
关键词:分子间作用力;课堂实证;对话式课堂;模型构建
分子间作用力是微粒之间相互作用的反映,难以观察、测定与表达,怎样将微观世界的作用通过易于理解的途径表示出来?怎样实现学生对分子间作用力的认识?怎样用自己对分子间作用力的认识反刍自然现象与学过的知识?为有效解决上述问题,笔者基于必修要求对分子间作用力进行了设计与教学实施,下面对五个教学片段的课堂进行实证分析,向读者介绍“对话式”课堂模型[1]。
一、从共用电子对偏移认识分子间作用力
片段1:范德华力的成因与影响因素
以H2、Cl2、HCl、H2O、P4等分子内共用电子对与核电荷静电作用为情境,运用力的合成方法探讨H—Cl中共用电子对偏移为研究对象,引起δ+(H)和δ-(Cl),从而出现不同分子间H原子和Cl原子间的静电吸引(库仑力),认识分子间作用力(范德华力)。
师:H—H之间的共用电子对不偏向任何一个H原子,是非极性键,而H—Cl的共用电子对会在正中间吗?
生:因为Cl的核电荷大,产生相对较大(斥力和引力)的合力,使得共用电子对偏向Cl。
师:显示出较弱的负电性,而此时H原子呢?
生:显示出较弱的正电性。
生:这样第一个分子的Cl就可能吸引第二个分子的H,第二个分子的Cl又会吸引第三个分子的H。
师:以此类推,由于这样的合力(吸引力[F=KQ1Q2r2])的作用,因此大量分子间相互作用结合形成不同状态的物质,如图1。
投影:物质在固、液、气态分子间距大小,如图2。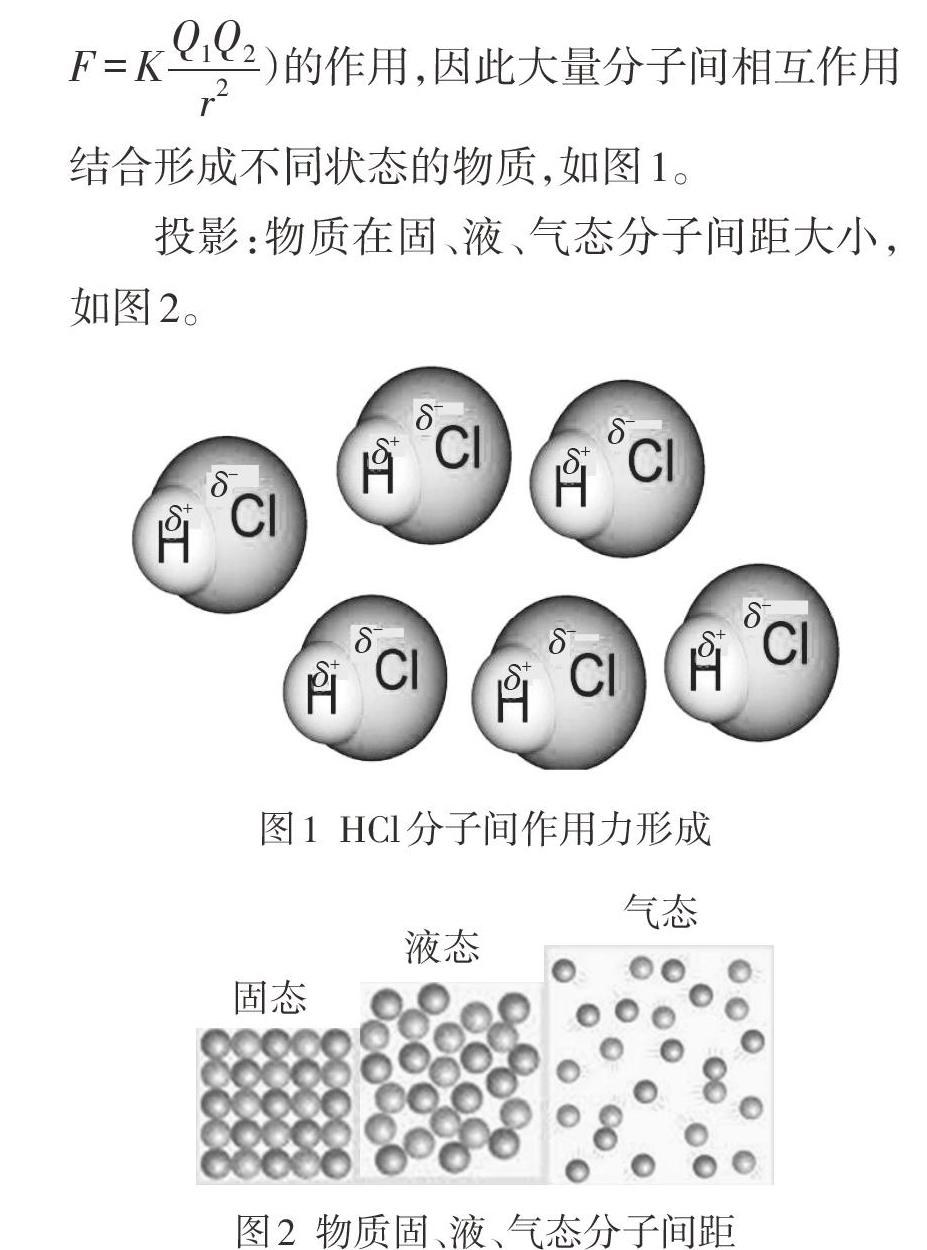
师:从上面公式中,我们发现分子间作用力F与分子间距有什么样的关系?与核电荷有什么样的关系?
生:F与核电荷大小成正相关,与分子间距成负相关。
师:其实核电荷的大小与相对分子质量也是正相关的,曾经的元素周期表就是按相对分子质量大小进行排列的(尽管现在看来不太合理),在结构相似的分子间,范德华力与核电荷和分子间距大小有关[2]。
分析与评论:上述教学过程既从本质上认识分子间作用力,又没有深入科学原理地分析范德华力的成因及影响因素,只是粗略地从电荷多少和分子间距来认识静电吸引(库仑力),让学生明白分子间存在力,而且受到分子间距、相对分子质量和分子结构影响,因为对分子结构与构型,没有作深层次探讨,所以只强调了结构相同。
片段2:氢键的成因与存在
以H2O分子间H—O共用电子对发生较强的偏移,使得H原子正电性更强,O原子负电性更强,从而使得分子间的静电吸引(库仑力)更大(比范德华力大,但比化学键弱得多),理解氢键的成因与存在。
师:若是H—O—H,存在H—O共价键,共用电子对偏移情况怎样?
生:O的非金属性(原理是电负性)比Cl更强,这对电子更加偏向O了,所以O原子的负电荷更多,而H原子的正电性也更强了,(教师引导观察)而且有两对。
师:这会不会导致第一个水分子中的δ-(O) 和δ+(H)更大?
生:会不会导致不同水分子之间的范德华力更大了?
师:是的,分子间距更小了。我们把这样一种分子间作用力叫( )力,是科学家鲍林发现的,但他在其他地方已经有命名了,所以暂时还空着,等待下一位有杰出贡献的科学家的名字填上去,或许就在我们班,如“小龙力”。目前我们称为特殊的分子间作用力——氢键,其表示如图3。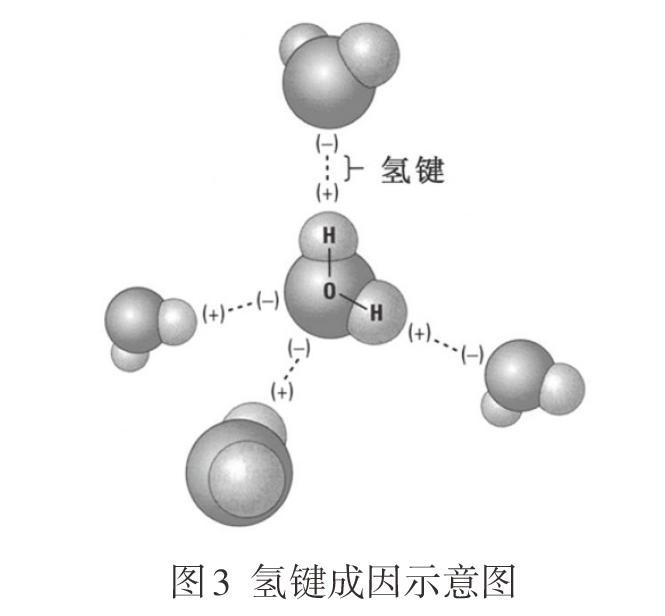
师:除了H—O有强极性外,还有H—N键也有很强的极性,所以NH3分子间同样存在氢键。这与和H结合的另一种非金属的非极性强弱(电负性)有关,非金属性越强,键的极性也越强,所以带电荷就越多,库仑力就越大,还有什么非金属与H形成的共价键也可能存在氢键吗?
生:F的非金属性最强,HF分子间应该也有氢键。
生:HF和H2O之间是否会存在氢键?
师:从氢键成因来看,完全可以啊。你们是否记得NH3和HCl都极易溶于水,而且NH3溶解度更大一些?
生:是的,好像NH3是1∶700,而HCl气体是1∶500,是什么原因?
师:NH3分子和H2O分子间会产生极强的分子间作用力(氢键),这样NH3分子被H2O分子吸入了,所以溶解性更强,虽然H—Cl键没有H—N键极性这么强,但也比较强,所以HCl气体也极易溶于水啊。
展示图4。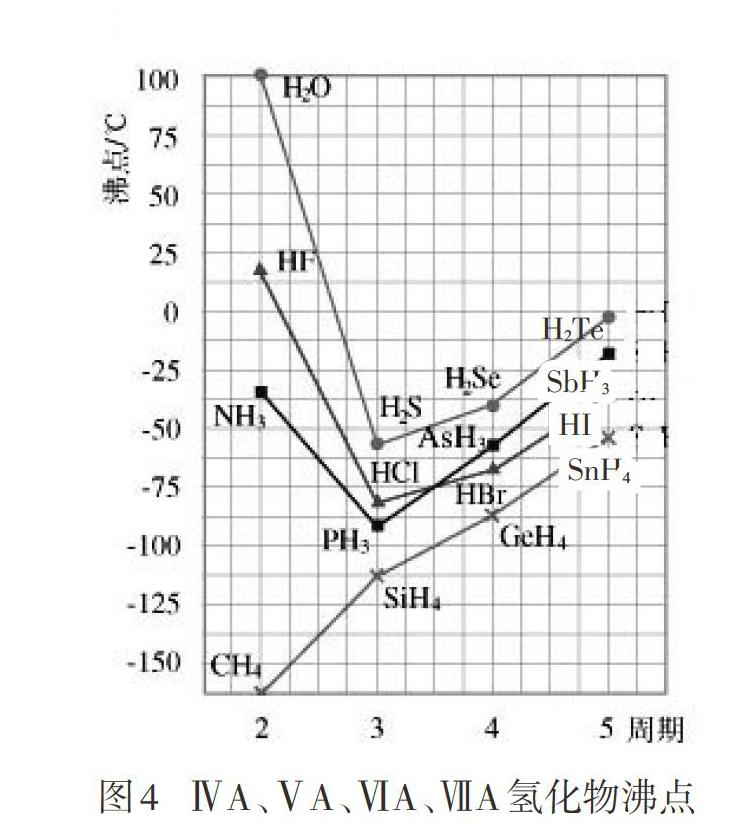
师:CH4、SiH4、GeH4、SnH4结构相似,相对分子质量增大,所以分子间作用力增大,导致沸点依次升高。而另外三组(第ⅦA、ⅥA、ⅤA)氢化物沸点中有个大折线,为什么?
生:因為H2O、HF、NH3分子间存在氢键。
师:其实除了上述三种物质间,很多物质,特别是有机物,分子中存在上述三种共价键中的某一种或几种,分子间往往也存在氢键。
分析与评论:氢键的教学过程,并没有显示神秘,也没有逐个分析,而是依着范德华力增强慢慢延伸出来,这样做可以让学生更加清晰地理解氢键也只是一种分子间作用力,只不过比范德华力更强一点。更有意义的是学生通过这一内容的学习,还知道了原来一些物质的溶解性特别好,与氢键的存在有着密切的关系。帮助学生建立了从非极性键到极性键,随着键的极性增强(这里没有深入分子极性增强,不作要求),分子间作用力也在增大,导致分子间结合更加紧密,熔沸点更高,水溶性更大。
二、分子间作用力对物质性质的影响
片段3:分子间作用力对物理性质的影响
问题1:H2O升温变成气态,降温结冰成固态,分子间距和分子间作用力怎样变化?
生:升温变气态,分子间距变大,分子间作用力变小,降温结冰,分子间距变小,分子间作用力变大。
问题2:家里用高压锅炖较难煮熟的食物原理是什么?試着从加压、分子间距、范德华力和水的沸点角度分析
生:加压使分子间距缩小了,范德华力增大了。
师:增大压强可以升高物质的沸点吧。
生:那水的沸点升高了,食物在里面炖的温度就肯定比100℃高了,这样食物容易熟了。
问题3:盛装可乐的易拉罐打开时,有什么变化?
生:有气体冲出来。
师:原因呢?
生:打开后减压,气体溶解度减小,所以冲出来了。
师:说明密封加压时,分子间距减小,范德华力增大,所以溶解了更多的CO2在里面,打开减压,溶解度减小,气体就冲出来了。
生:是的,就是这样。
问题4:水结冰后体积和密度怎样变化?
生:水结冰后体积变大,密度变小。
师:水结冰,分子间距变小,分子间作用力(氢键)变大,应该体积变小啊。
生:书上说是体积变大,密度变小的。
师:难道分子间作用力(氢键)研究得不准确?
学生茫然了。
生:按氢键分析,体积是减小的,会不会有其他变化?
师:由于分子间作用力特别强,导致H2O缔合成更大的(H2O)n,而这些大块头的分子堆积时,会出现很多的空隙,导致体积变大,密度变小。
生:(学生一脸的兴奋)原来如此。仅从分子间距看是缩小的,但由于堆积原因,体积变大了。
分析与评论:这里设计的四个问题,是为了引导学生认识分子间作用力(包括范德华力和氢键)对物质物理性质的影响。问题1是强化分子间作用力与分子间距的关系,老师同时也巩固与相对分子质量关系。而问题2从高压锅炖食物易熟的原理,让熟悉的环境引起学生讨论与思考,其原因是增大压强,缩小分子间距,增大分子间作用力,提高水的沸点,达到更高的温度,易煮熟食物。问题3对于每一位同学都有过亲身经历,所以这个问题出现时,学生更加容易积极思考,也有很多学生想过,加压可以增大气体溶解度,其实也正是加压,缩小了分子间距,增大了分子间作用力导致的。问题4,小学科学知道水结冰体积变大,初中科学知道体积变大,密度变小,到了高中,真正从本质上认识了其原因,原来就是因为分子间作用力(氢键)导致分子缔合,其实(等质量的)分子总体积是减小的,但由于缔合成的(H2O)n体积变大后,再堆积在一起时,大分子中存在很多的空隙,使得冰的体积变大,密度变小。
三、比较微粒间作用的相对强弱
片段4:范德华力、氢键、化学键的强弱比较
情境1:
师:水汽化过程其分子发生怎样的变化?
生:还是水分子啊,没有变。(教师引导下)状态变了,体积变大了(等质量),分子间距大了,分子间作用力也变了。
师:继续升温到1000℃,且持续加热,又发生怎样的变化?
生:共价键断了,变成自由移动的H、O原子了。
师:这两种变化,你感觉哪一种更容易进行?
生:肯定是汽化,而且看上去条件差异有点大,估计分子间作用力比共价键弱得多。
情境2:卤化氢分子的范德华力和化学键的比较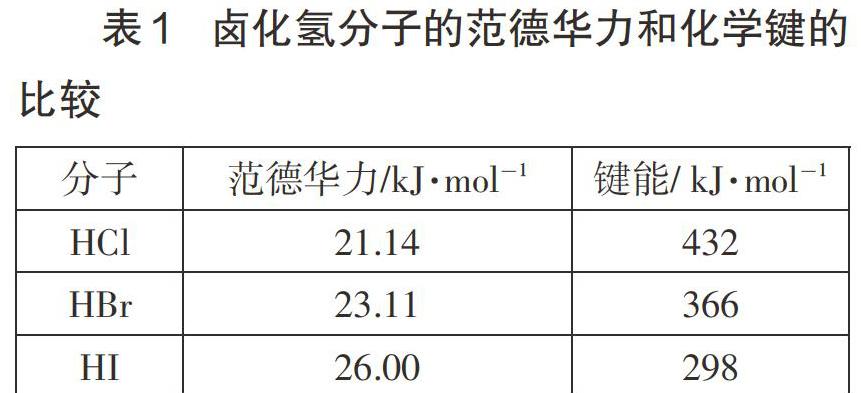
师:看表1中数据,这三种氢化物,结构相似,范德华力1也是一种能量,和键能一样。
生:这样看来,键能几乎是范德华力的二十倍。
师:是的,一般在十几倍到上百倍都有,氢键从成因来看,应该比范德华力大一些吧,但跟共价键键能相比还是要小很多。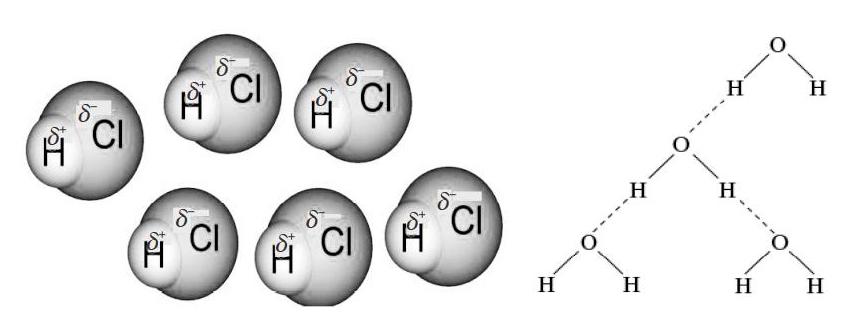
师:所以你们看我在表示时的差异了吧,如图5。范德华力没有任何点、线等表示,而氢键用虚线表示,共价键用实线表示,仅从这里就大致知道其结合强弱(能量)。
分析与评论:情境1的设计,让学生清楚H2O分子间作用力(氢键的破坏)同其共价键断裂相比,容易得多,这就从难易程度上帮助学生建立分子间作用力比共价键小得多。情境2给出定量的范德华力能量和共价键键能,更加直观地从数据上得出,共价键是范德华力的十几倍到上百倍之大。在氢键的形成过程中,氢键是范德华力大到一定值后的特殊分子间作用力,说明范德华力比氢键弱,两者与共价键相比弱得多。从能量上的差异比较,使学生有一个定量的数据观念,更能帮助学生从能量上区分分子间作用力与化学键。从表示方式上看,更加形象地说明共价键比氢键强得多(实线对虚线),范德华力更弱(没有特定的线条表示)。
四、HCl和NaCl发生物理变化和化学变化时微粒间相互作用的破坏
片段5:课堂小结检查学习效果
问题1:HCl从固态→液态→气态,破坏了何种微粒间作用力?NaCl从固态到液态,又破坏何种微粒间作用力?怎样实现?上述两种变化哪一种相对容易发生?为什么?
生:分子间作用力。
师:NaCl中存在“分子”?
生:没有分子,是Na+和Cl-,那就只有离子键了,只能破坏离子键。
生:(教师引导)NaCl从固态到液态,是熔化过程,看来是给了热量破坏了离子键。
师:对了,上述两种物质发生物态变化,哪一种更容易?
生:离子键有阴阳离子,静电作用应该更强,比分子间作用力大很多,所以HCl的变化更容易。
投影表2。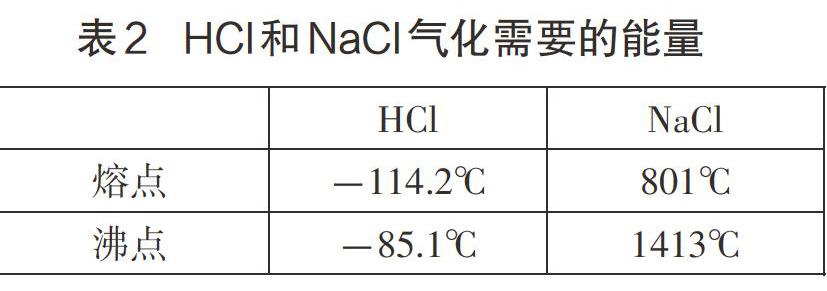
注:等物质的量,熔点、沸点越高,熔化和气化时需要吸收的能量越多。
师:这里就是让同学们知道化学键确实比分子间作用力强得多,而且分子间作用力只存在于分子构成的物质中。
问题2:若要让HCl液化,又会有怎样的能量变化?若要破坏HCl中的H—Cl共價键,怎么办?HCl溶于水,会发生怎样的变化?破坏了什么作用?
生:加压(其实降温也可以),可以缩小分子间距,增大分子间作用力。
师:从上面NaCl中离子键断裂需要吸收热量,推测只要给予足够的热量,相信也一定能断裂。还有什么办法也能使H—Cl共价键更容易断裂?
学生陷入沉思中。教师引导,如果用两个力分别向反方向拉H和Cl原子,拉断共价键后,共用电子对就被Cl给带走了,变成了Cl-。
生:我知道了,HCl溶于H2O,会产生H+和Cl-,H2O就是分别是拉H和Cl原子的物质,对吗?
师:(给予了充分肯定)水分子在这里起到了拉的作用,此时,没有加热,同样也破坏了共价键,这就是我们学过的电离。
分析与评论:问题1的设计,为达到四个检测目标:复习分子间作用力对物质状态的影响;知道只有分子构成的物质存在分子间作用力;离子化合物发生物态变化时,也是破坏了离子键;离子键和共价键一样,其结合(能量)比分子间作用力强很多。问题2的设计目的是:以HCl为素材,巩固分子间作用力影响因素,从比较中明确共价键断裂需要更多的能量,而且知道除了能量能破坏化学键,其他条件(如H2O分子作用)也能帮助破坏化学键,以此重新来看“电离”发生的原因。很多看似无关的知识,其实存在着必然的联系,这就是科学本质教学。
学习是引导学生发现知识的过程[3],这个过程包括学生与自然(文本、现象、实验)的对话,从自然变化中发现问题,提出思考;通过学生与同伴(老师和同学)对话,在引导下经历发现与实证(证实与证伪)过程,在同伴质疑与交流中获得对知识的理解,方法的领悟[4];通过反刍,自我对知识的理解,尤其是从知其然到知其所以然,这是与内心世界的对话,获得对科学本质的理解与认同。
参考文献:
[1]王云生.课堂转型与学科核心素养培养——中学化学课堂教学改革探索[M].上海:上海教育出版社,2016:51-56.
[2]何庆辉.促进学生学习微观抽象概念和理论的教学研究—— 以“分子间作用力与物质性质”为例[J].化学教育,2014(17):20-25.
[3]李发顺.教学是引导学生发现知识的过程[J].教育研究与评论(课堂观察),2015(7):封二.
[4]钟启泉.读懂课堂[M].上海:华东师范大学出版社,2017:92-94.
