人类WEE1与肿瘤关系研究进展
2018-05-02胡争波李文虎南方医科大学附属韶关医院韶关市第一人民医院骨科广东韶关512000
胡争波,李文虎,何 轩 [南方医科大学附属韶关医院(韶关市第一人民医院)骨科,广东韶关512000]
0 引言
Nurse等在1975年从裂殖酵母细胞(S.pombe)中分离出来WEE1蛋白激酶,它属于丝/苏氨酸蛋白激酶家族。由于其可以通过抑制CDC2的活性来抑制细胞进行有丝分裂[1],从而控制细胞周期生物钟,因此得名为“WEE”家族。WEE1激酶家族在进化上高度保守,在人体内也找到了WEE1的同源基因编码产物WEE1。研究[2]表明WEE1除了在胚胎发育、神经元极化、成骨分化、胃肠道生物钟、植物分化和根表型、细胞大小等方面具有重要作用外,WEE1在维持癌细胞生存方面的也具有不可或缺的作用。目前,以WEE1为治疗靶点的抗癌研究已经成为当前研究的热点。本文就WEE1的研究进展作一综述。
1 WEE1基因及其产物
WEE1是一个进化上高度保守的酪氨酸激酶。1991年,Igarashi首次克隆出与S pombe WEE1基因相似的人类WEE1基因,并发现二者功能相似,同时他们也确定人类细胞中存在WEE1基因(图1)。人类WEE1基因位于染色体上的11p15.4,最近DNA测序结果WEE1基因长度为21 Kbp,mRNA约有3300 bp,有12个外显子。在人体中,WEE1基因编码的核蛋白共有646个氨基酸残基。在哺乳动物中,Wee蛋白激酶家族包括WEE1、WEE2和MYT1三个成员,其中WEE1在体细胞中表达,WEE2在胚细胞中表达,MYT1在体细胞和胚细胞中都表达。
2 WEE1 mRNA转录和翻译调节
染色质重组因子ATP酶CHD5是NuRD整个转录因子复合物的组成部分,在细胞中过表达CHD5导致WEE1基因表达抑制[3]。人 Kruppel样因子2是一个cys2/His2含锌指结构的转录因子,在卵巢肿瘤细胞中KLF2通过直接结合到WEE1启动子抑制WEE1转录[4]。在人类类风湿滑膜细胞中,cFOS/AP-1可以直接激活WEE1基因[5]。另外,染色体免疫共沉淀实验还发现WEE1启动子上有转录因子TP53和MyoD结合位点,但功能是促进还是抑制未见报道。
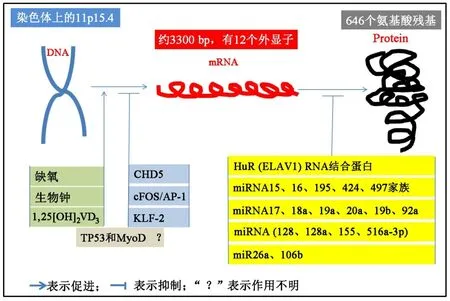
图1 WEE1基因表达和转录翻译调节因素和因子。1,25[OH]2VD3为人1,25二羟基维生素D3;TP53为抗肿瘤基因p53;MyoD 为 Myogenic Differentiation Antigen,即成肌分化抗原;染色体解螺旋酶DNA结合蛋白5;cFOS/AP-1为骨肉瘤病毒癌基因同源物/活化蛋白转录因子;KLF-2是Krppel样转录因子2;HuR,胚胎致死异常视觉基因家族中的成员,RNA结合蛋白;miRNA微小RNA。
WEE1基因转录mRNA后,很多因子包括蛋白和小分子miRNA调节其翻译过程。HuR是一种大量存在于肿瘤的RNA结合蛋白,在压力应激下从细胞核心转位到细胞质中调节mRNA。研究[6]发现HuR直接结合到WEE1 mRNA直接影响其蛋白水平,尤其是DNA损伤后。除了HuR蛋白对WEE1 mRNA调节,目前研究较多的是小分子miRNA。miRNA是一些单链小分子RNA,通过结合到靶基因mRNA上的3'末端非编码区调节mRNA翻译。用微芯片分析发现了 3 个 miRNA(128a/155/516a-3p)定位在 WEE1转录本的3'端非翻译区,表达这些miRNA导致了WEE1蛋白下调[7]。 功能促进和功能抑制试验[8]表明MiR15 家族 miRNA15/16/424/497 等在多种肿瘤细胞中调节 WEE1表达。在某些肿瘤中miR16/26a[9]、 miRNA17-92 基因丛编码的 miRNA17/18a/19a/20a/19b/92a[10]、 以 及 miR17/20a/106b[11]、 miRNA128[12]、miRNA195[13]、miRNA497[14]等也下调WEE1 mRNA。而虽有报道缺氧、维生素1,2[OH]2VD3、生物钟基因 Per1下调等均会导致WEE1在mRNA水平升高,但它们上调WEE1 mRNA的具体机制不明。
3 WEE1的蛋白水平调节
在正常酵母细胞中,WEE1的稳定性由组蛋白合成致死蛋白Hsl1和7调节,活性由CDC2和CDC25调节。在人WEE1蛋白的调节则更为复杂(图2)。
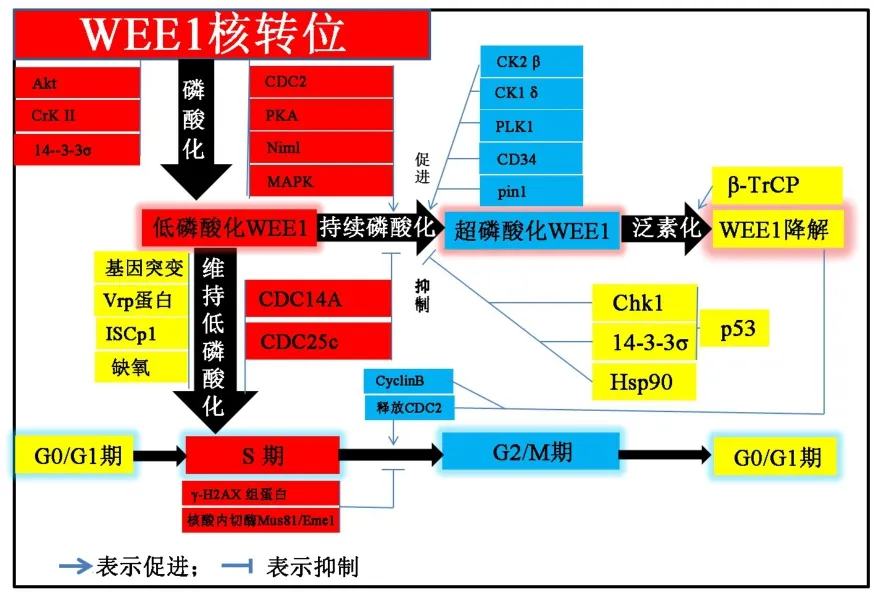
图 2 WEE1 蛋白活性与功能调节。 Akt、CrK II、14-3-3σ、Vrp、ISCp1、 CDC2、PKA、Niml、MAPK 、CK1 δ、CK2 β 、PLK1、CD34、pin1、CDC14A、 CDC25c、 β-TrCP、CyclinB、γ-H2AX、Mus81、Eme1、ChK1、Hsp90、p53 等为蛋白或基因名称;G0/G1、S、G2/M等细胞周期。
在细胞周期进展中,WEE1存在依赖于从低磷酸化激活到超磷酸化失活,再泛素化降解的反馈回路,以保证其下游因子CDC2快速激活以准备分裂。1993年,学者发现WEE1在分裂间期的107 KD的低磷酸化形式,而在有丝分裂期则是170 KD的超磷酸化形式。而超磷酸化形式催化CDC2磷酸化的活性显著减少。在M期CDC2催化WEE1的S123p位点,PLK1催化 S53p位点,后被 β-TrCP识别,使得WEE1被超磷酸化失活后降解下调[15]。而蛋白激酶CK2β亚基在核外通过WEE1上的结构域直接结合促成 PLK1-WEE1复合物形成,促进 G2/M期过渡[16]。CK2β 也可以与 WEE1在核内结合,CK2β 抑制WEE1催化H1组蛋白磷酸化,上调CDC2的活性[17]。也有研究证实CK1δ是泛素溶酶体途径降解WEE1所必需的[18-19],β-TrCP 复合物是 WEE1泛素化的 E3 泛素化连接酶[15,17],CDC2、PLK1 和 CK2 催化WEE1磷酸化形成降解体后才会被β-TrCP识别,其中WEE1中的S53和S123位点磷酸化是β-TrCp识别的重要位点。此外 CDC2还能够通过催化WEE1的T186磷酸化,并特异结合cis/tran羟脯氨酰异构酶 Pin1,导致 WEE1失活[20]。 CDC2也通过磷酸化激活CDC25,但CDC25会磷酸化失活WEE1,而CDC14A可结合到WEE1的N末端逆转CDC2磷酸化的WEE1,由此形成一个反馈调节[21]。WEE1是在核外降解,因此核转位对其降解非常重要[22]。有学者[23]发现与细胞内定位有关的核内信号蛋白CrkII可与WEE1结合;而Akt在S/G2期直接结合并磷酸化激活 WEE1的 Ser642位点[24],且 14-3-3σ 参与了WEE1从细胞核转出细胞质中定位[25]。说明这些也与WEE1降解有关。
另外,Hsp90是WEE1的分子伴侣[26],既可以结合 WEE1,又可以结合 Chk1[27],这个过程受 p53 调节[28-29];而 Chk1 磷酸化 WEE1 的 S549 位点[25,30],Chk1直接靶向作用于WEE1和CDC25[31],从而调节WEE1的功能活性。Tral1是负责ATM/ATR相关的假性激酶,也可通过有丝分裂变化应答激酶CDR1/2拮抗Chk1,进而抑制 WEE1蛋白活性[32-33]。此外,PKA催化亚基、Niml激酶、促分裂原活化蛋白激酶MAPK、病毒蛋白Vpr诱导WEE1磷酸化增加。抑制泛素结合激酶复合物CD34[34]、Rad24和14-3-3σ上调、高水平肌醇磷酸鞘磷脂酶 C1[35]等均可导致WEE1积累。其他能够上调或稳定WEE1蛋白还有缺氧、蛋白点突变、HIV 病毒蛋白 Vpr[36-37]。 这些与WEE1的细胞周期调节功能有关(图3)。
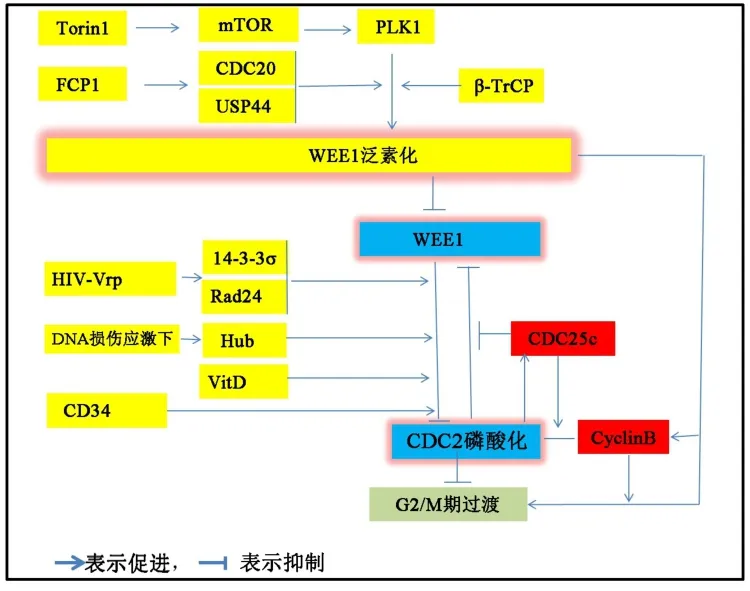
图 3 WEE1 与细胞周期调节。 CDC2、CDC20、CyclinB、FCP1、Hub、mTOR、PLK1、Rad24、Torin1、USP44、Vrp、VitD、β-TrCP、14-3-3σ等为蛋白或基因名称;G2/M等为细胞周期。
在WEE1下游,WEE1调节CDC2上Y15位点和CyclinB上的260和270位点磷酸化[38]。WEE1通过核酸内切酶Mus81/Eme1调节DNA复制与稳定性[39-40]。 此外,WEE1 还通过抑制 γH2AX 磷酸化[39],催化组蛋白 H2B 的 Y27 磷酸化[41],与 H3K36作用促进RRM2表达[42],从而保护基因组稳定。这些与WEE1的生理病理功能密不可分。
4 WEE1在癌组织中的表达和靶向治疗
4.1 WEE1在癌组织中的表达 WEE1是动物胚胎生存的必需基因,细胞中缺失WEE1基因则导致周期缺陷,异倍体和细胞凋亡。基因敲除老鼠胚胎在3.5天前因细胞凋亡死亡[43],因此 WEE1是小鼠胚胎植入前阶段必不可少的。有研究表明WEE1在非小细胞肺癌[44]和恶性黑色素瘤[13]中能够抑癌(图 4)。但与这些研究结论相反的是,又有研究表明在恶性黑色素瘤[45]、外阴鳞癌细胞[46]、骨肉瘤[47-48]、神经母细胞瘤[14]、恶性卵巢癌[49]、乳腺癌癌细胞[50]中,WEE1的表达增加与恶性程度一致。
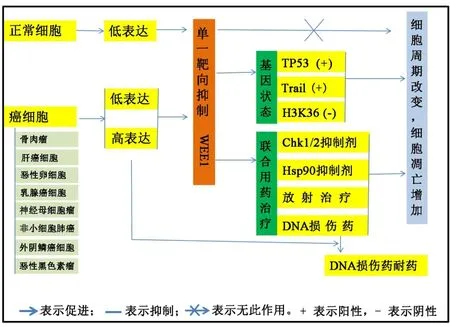
图4 WEE1在人体细胞中的表达及其与癌细胞靶向治疗。TP53,Trail,H3K36,Chk1/2,Hsp90 等为蛋白或基因名称。
4.2 WEE1单一靶点作用及与p53的关系 在髓母细胞瘤[51]、外阴鳞癌细胞[46]和恶性卵巢癌化疗后复发的癌细胞[49]中,单一WEE1抑制剂AZD1775就可以抑制肿瘤。在没有组蛋白H3K36癌细胞中,合成致死作用对WEE1抑制非常敏感,单纯抑制WEE1导致S期阻滞,细胞凋亡增加[42]。在基底乳腺癌细胞中,抑制WEE1能够增强TRAIL介导的细胞凋亡[52]。但在正常乳腺上皮中抑制WEE1后没有出现这些反应[50]。
p53是细胞周期G1检查站的关键因子和细胞凋亡的决定因子[9]。 很多研究[27-29]表明,WEE1 可通过p53途径调节细胞生存。研究[17]表明生物钟基因Per1下调后,导致WEE1上调而p53下调,其致瘤性增强,细胞凋亡抑制。在DNA损伤药物如阿霉素作用下,p53靶定WEE1和Chk1导致细胞阻滞在G1/S期,并增加细胞凋亡[9]。在p53wt和p53mt乳腺癌细胞系中,沉默WEE1后,p53蛋白上调,凋亡细胞增加,且WEE1的抑制效果与p53水平一致[28]。另一方面,也有研究[29,45,63]表明 WEE1 的作用与 p53 无关。因此,WEE1抑制与p53状态对癌细胞生存的影响还有待进一步阐明。
4.3 WEE1的协同效应 WEE1抑制剂AZD1775和Chk1抑制剂PD00477736对鞘细胞淋巴瘤细胞具有强烈的协同效应[54]。在黑色素瘤细胞中,WEE1抑制剂AZD1775和Chk1、2抑制剂AZD7762协同用药效果更好[55]。WEE1抑制与阿糖胞苷对急性髓系白血病AML也具有协同效果[56]。WEE1抑制剂增加了HSp90抑制剂的抗癌效果[57]。同时抑制 WEE1和Hsp90时,survivin和WEE1转录下调,内源性凋亡途径激活,在翻译水平,这两种蛋白的表达和Akt活化被抑制。单一抑制两者之一则没有这种效果。AZD1775抑制WEE1后可增强非小细胞肺癌对光子放射敏感性[58]。WEE1在大多数骨肉瘤标本中检测到有表达,抑制WEE1可增强骨肉瘤放疗敏感性[47]。4.4 WEE1与DNA损伤药及其耐药 癌细胞耐药和抗放疗是因为在S期能够很好地修复DNA的损伤,WEE1起了重要作用。顺铂处理miR497表达的细胞和WEE1抑制的细胞导致凋亡增加[14]。髓母细胞瘤中,虽然单一抑制WEE1就有抗癌效果,但抑制WEE1协同CDDP会有更好的抗癌效果[51]。在卵巢肿瘤中,转录因子KLF2显著下调,抑制WEE1后增加DNA损伤药物的效果。在顺铂耐药的细胞中经常发生 WEE1 和 Chk1 过表达[8],而 miRNA15、16、195、424、497家族通过调节WEE1和Chk1导致肿瘤细胞顺铂耐药[4,53]。 在胰腺导管腺癌中,DNA 损伤药刺激后HuR从细胞核转位到细胞质[6]。HuR快速上调WEE1蛋白水平,增加γH2AX水平和诱导CDK1磷酸化,促进G2/M过渡期停滞。多表达HuR导致肿瘤细胞耐药,沉默WEE1导致DNA药物更敏感。在胶质母细胞瘤中,WEE1抑制增强力DNA损伤药物的效果,也增强了γ射线的效果[59]。高表达叉头蛋白能够逃避抑制WEE1诱导肿瘤干细胞凋亡,异常表达T-box转录因子叉头在人肿瘤中驱动上皮间质转化以适应肿瘤转移、耐药和耐放疗等[60]。
5 存在问题与研究方向
WEE1与癌细胞生存密切相关,应用前景广泛,需进一步深入研究。目前对WEE1的研究还存在以下问题急需解决。其一,目前学者对WEE1蛋白的分子量还没有形成统一标准。多数学者倾向于接受人类内源性WEE1是含有647个氨基酸残基,在SDSPAGE电泳迁徙为94 KD的蛋白。但Igarashi等[61]在1991年基于cDNA克隆表达分析,认为WEE1是一个分子量为49 KD,含有432个氨基酸残基的蛋白。这个49 KD的WEE1蛋白在细菌、真菌、昆虫和哺乳动物细胞系中表达进行了实验研究[62]。然而根据WEE1含有647氨基酸残基计算,其分子量约为71 KD。实际上目前也有针对分子量为约为72 KD的WEE1的抗体研究。造成这种现象的原因可能与WEE1蛋白的结构、化学修饰等有关。因此,WEE1蛋白的分子量及分子结构还是需要进一步阐明。其二,以前的研究发现,很多因素如缺氧、光刺激和维生素D诱导都可以上调WEE1mRNA的表达,但WEE1基因究竟是如何被转录激活还不清楚。其三,WEE1及其家族基因MYT1都能后磷酸化周期依赖激酶2,从而调节细胞周期进展。有研究[63]表明WEE1家族基因MYT1是炎症因子NF-kB通路的抑制因子。细胞周期调节因子CylinD1被NF-κB通路和Rb1调节,WEE1 的稳定伴随着 Rb1[31]和 p53[27]的抑制,p53 状态也影响着 WEE1的功能[27]。因此 WEE1与 p53、Rb1和NF-κB之间相互影响的机制以及WEE1与其家族基因MYT1的分工也需要进一步阐明。其四,WEE1的经典作用是其通过磷酸化抑制CDC2从而抑制细胞进入M期。其次就是WEE1在S期的基因组DNA稳定性作用。但有研究[64]表明WEE1还能与其它细胞周期的关键调节因子p53、Rb1、CylinD1、PLK相互作用,因此WEE1对细胞周期的调节作用还有待进一步研究。其五,体外癌细胞实验表明H3K36、p53、DNA复制激活通路对WEE1抑制有明显影响[42],WEE1抑制剂在不同肿瘤中的抗癌效果也不一致。而目前WEE1抑制剂作为抗癌靶点进入临床Ⅱ期实验,但WEE1抑制剂敏感性的决定因子及肿瘤基因组特性还不清楚。这些都是后续研究需要解决的问题。
【参考文献】
[1] Geenen JJJ, Schellens JHM.Molecular pathways: targeting the protein kinase Wee1 in cancer[J].Clin Cancer Res,2017,23(16):4540-4544.
[2]Wright G, Golubeva V, Remsing Rix LL, et al.Dual targeting of WEE1 and PLK1 by AZD1775 elicits single agent cellular anticancer activity[J].ACS Chem Biol,2017,12(7):1883-1892.
[3] Quan J, Adelmant G, Marto JA, et al.The chromatin remodeling factor CHD5 is a transcriptional repressor of WEE1[J].PLoS One,2014,9(9):e108066.
[4] Wang F, Zhu Y, Huang Y, et al.Transcriptional repression of WEE1 by Kruppel-like factor 2 is involved in DNA damage-induced apoptosis[J].Oncogene,2005,24(24):3875-3885.
[5] Kawasaki H, Komai K, Nakamura M, et al.Human wee1 kinase is directly transactivated by and increased in association with c-Fos/AP-1:rheumatoid synovial cells overexpressing these genes go into aberrant mitosis[J].Oncogene,2003,22(44):6839-6844.
[6] Lal S, Burkhart RA, Beeharry N, et al.HuR posttranscriptionally regulates WEE1:implications for the DNA damage response in pancreatic cancer cells[J].Cancer Res,2014,74(4):1128-1140.
[7] Butz H, Likó I, Czirják S, et al.Down-regulation of Wee1 kinase by a specific subset of microRNA in human sporadic pituitary adenomas[J].J Clin Endocrinol Metab,2010,95(10): E181-E191.
[8] Pouliot LM, Chen YC, Bai J, et al.Cisplatin sensitivity mediated by WEE1 and CHK1 is mediated by miR-155 and the miR-15 family[J].Cancer Res,2012,72(22):5945-5955.
[9] Lezina L, Purmessur N, Antonov AV, et al.miR-16 and miR-26a target checkpoint kinases Wee1 and Chk1 in response to p53 activation by genotoxic stress[J].Cell Death Dis,2013,4:e953.
[10] Brockway S, Zeleznik-Le NJ.WEE1 is a validated target of the microRNA miR-17-92 cluster in leukemia[J].Cancer Genet,2015,208(5):279-287.
[11] Trompeter HI, Abbad H, Iwaniuk KM, et al.MicroRNAs,miR-17,miR-20a,and miR-106b act in concert to modulate E2F activity on cell cycle arrest during neuronal lineage differentiation of USSC[J].PLoS One,2011,6(1):e16138.
[12] Wuchty S, Arjona D, Li A, et al.Prediction of associations between microRNAs and gene expression in glioma biology[J].PLoS One,2011,6(2):e14681.
[13] Bhattacharya A, Schmitz U, Wolkenhauer O, et al.Regulation of cell cycle checkpoint kinase WEE1 by miR-195 in malignant melanoma[J].Oncogene,2013,32(26):3175-3183.
[14] Creevey L, Ryan J, Harvey H, et al.MicroRNA-497 increases apoptosis in MYCN amplified neuroblastoma cells by targeting the key cell cycle regulator WEE1[J].Mol Cancer,2013,12:23.
[15] Watanabe N,Arai H,Nishihara Y,et al.M-phase kinases induce phospho-dependent ubiquitination of somatic Wee1 by SCFbeta-TrCP[J].Proc Natl Acad Sci U S A,2004,101(13): 4419-4424.
[16] Olsen BB, Kreutzer JN,Watanabe N,et al.Mapping of the interaction sites between Wee1 kinase and the regulatory beta-subunit of protein kinase CK2[J].Int J Oncol,2010,36(5): 1175-1182.
[17] Olsen BB,Guerra B.Ability of CK2beta to selectively regulate cellular protein kinases[J].Mol Cell Biochem,2008,316(1-2):115-126.
[18] Penas C, Ramachandran V, Simanski S, et al.Casein kinase 1δ-dependent Wee1 protein degradation[J].J Biol Chem,2014,289(27):18893-18903.
[19] Owens L, Simanski S, Squire C, et al.Activation domain-dependent degradation of somatic Wee1 kinase[J].J Biol Chem,2010,285(9):6761-6769.
[20] Okamoto K, Sagata N.Mechanism for inactivation of the mitotic inhibitory kinase Wee1 at M phase[J].Proc Natl Acad Sci U S A,2007,104(10):3753-3758.
[21] Ovejero S, Ayala P, Bueno A, et al.Human Cdc14A regulates Wee1 stability by counteracting CDK-mediated phosphorylation[J].Mol Biol Cell,2012,23(23):4515-4525.
[22] Keaton MA, Szkotnicki L, Marquitz AR, et al.Nucleocytoplasmic trafficking of G2/M regulators in yeast[J].Mol Biol Cell,2008,19(9):4006-4018.
[23] Kar B, Reichman CT, Singh S, et al.Proapoptotic function of the nuclear Crk II adaptor protein[J].Biochemistry,2007,46(38):10828-10840.
[24] Katayama K, Fujita N, Tsuruo T.Akt/protein kinase B-dependent phosphorylation and inactivation of WEE1Hu promote cell cycle progression at G2/M transition[J].Mol Cell Biol,2005,25(13):5725-5737.
[25] Lee J, Kumagai A, Dunphy WG.Positive regulation of Wee1 by Chk1 and 14-3-3 proteins[J].Mol Biol Cell,2001,12(3):551-563.[26] Mollapour M, Tsutsumi S, Donnelly AC, et al.Swe1Wee1-dependent tyrosine phosphorylation of Hsp90 regulates distinct facets of chaperone function[J].Mol Cell,2010,37(3):333-343.
[27] Tse AN,Sheikh TN,Alan H,et al.90-kDa heat shock protein inhibition abrogates the topoisomerase I poison-induced G2/M checkpoint in p53-null tumor cells by depleting Chk1 and Wee1[J].Mol Pharmacol,2009,75(1):124-133.
[28] Ghiasi N,Habibagahi M,Rosli R,et al.Tumour suppressive effects of WEE1 gene silencing in breast cancer cells[J].Asian Pac J Cancer Prev,2014,14(11):6605-6611.
[29] Pappano WN, Zhang Q, Tucker LA, et al.Genetic inhibition of the atypical kinase Wee1 selectively drives apoptosis of p53 inactive tumor cells[J].BMC Cancer,2014,14:430.
[30] Stanford JS, Ruderman JV.Changes in regulatory phosphorylation of Cdc25C Ser287 and Wee1 Ser549 during normal cell cycle progression and checkpoint arrests[J].Mol Biol Cell,2005,16(12):5749-5760.
[31] Hashimoto O, Ueno T, Kimura R, et al.Inhibition of proteasomedependent degradation of Wee1 in G2-arrested Hep3B cells by TGF beta 1[J].Mol Carcinog,2003,36(4):171-182.
[32] Calonge TM, Eshaghi M, Liu J, et al.Transformation/transcription domain-associated protein (TRRAP)-mediated regulation of Wee1[J].Genetics,2010,185(1):81-93.
[33] Grallert A, Connolly Y, Smith DL, et al.The S.pombe cytokinesis NDR kinase Sid2 activates Fin1 NIMA kinase to control mitotic commitment through Pom1/Wee1[J].Nat Cell Biol,2012,14(7):738-745.
[34] Legesse-Miller A, Elemento O, Pfau SJ, et al.let-7 Overexpression leads to an increased fraction of cells in G2/M,direct down-regulation of Cdc34, and stabilization of Wee1 kinase in primary fibroblasts[J].J Biol Chem,2009,284(11):6605-6609.
[35] Matmati N,Kitagaki H,Montefusco D, et al.Hydroxyurea sensitivity reveals a role for ISC1 in the regulation of G2/M[J].J Biol Chem,2009,284(13):8241-8246.
[36] Sharma A, Madhunapantula SV, Gowda R, et al.Identification of aurora kinase B and Wee1-like protein kinase as downstream targets of(V600E)B-RAF in melanoma[J].Am J Pathol,2013,182(4):1151-1162.
[37] Tay YD, Patel A, Kaemena DF, et al.Mutation of a conserved residue enhances the sensitivity of analogue-sensitised kinases to generate a novel approach to the study of mitosis in fission yeast[J].J Cell Sci,2013,126(21):5052-5061.
[38] Hu F,Gan Y,Aparicio OM.Identification of Clb2 residues required for Swe1 regulation of Clb2-Cdc28 in Saccharomyces cerevisiae[J].Genetics,2008,179(2):863-874.
[39] Domínguez-Kelly R, Martín Y, Koundrioukoff S, et al.Wee1 controls genomic stability during replication by regulating the Mus81-Eme1 endonuclease[J].J Cell Biol,2011,194(4):567-579.
[40] Martín Y, Domínguez-Kelly R, Freire R.Novel insights into maintaining genomic integrity: Wee1 regulating Mus81/Eme1 [J].Cell Div,2011,6:21.
[41] Mahajan K, Mahajan NP.WEE1 tyrosine kinase, a novel epigenetic modifier[J].Trends Genet,2013,29(7):394-402.
[42] Pfister SX,Markkanen E,Jiang Y,et al.Inhibiting WEE1 selectively kills histone H3K36me3-deficient cancers by dNTP starvation[J].Cancer Cell,2015,28(5):557-568.
[43] Vassilopoulos A, Tominaga Y, Kim HS, et al.WEE1 murine deficiency induces hyper-activation of APC/C and results in genomic instability and carcinogenesis[J].Oncogene,2015,34(23): 3023-3035.
[44] Yoshida T, Tanaka S, Mogi A, et al.The clinical significance of Cyclin B1 and Wee1 expression in non-small-cell lung cancer[J].Ann Oncol,2004,15(2):252-256.
[45] Magnussen GI, Holm R, Emilsen E, et al.High expression of Wee1 is associated with poor disease-free survival in malignant melanoma:potential for targeted therapy[J].PLoS One,2012,7(6):e38254.
[46] Magnussen GI, Hellesylt E, Nesland JM, et al.High expression of wee1 is associated with malignancy in vulvar squamous cell carcinoma patients[J].BMC Cancer,2013,13:288.
[47] PosthumaDeBoer J, Würdinger T, Graat HC, et al.WEE1 inhibition sensitizes osteosarcoma to radiotherapy[J].BMC Cancer,2011,11:156.
[48] Beck H, Nähse-Kumpf V, Larsen MS, et al.Cyclin-dependent kinase suppression by WEE1 kinase protects the genome through control of replication initiation and nucleotide consumption[J].Mol Cell Biol,2012,32(20):4226-4236.
[49] Slipicevic A,Holth A,Hellesylt E,et al.Wee1 is a novel independent prognostic marker of poor survival in post-chemotherapy ovarian carcinoma effusions[J].Gynecol Oncol,2014,135(1):118-124.
[50] Murrow LM, Garimella SV, Jones TL, et al.Identification of WEE1 as a potential molecular target in cancer cells by RNAi screening of the human tyrosine kinome[J].Breast Cancer Res Treat,2010,122(2):347-357.
[51] Harris PS, Venkataraman S, Alimova I, et al.Integrated genomic analysis identifies the mitotic checkpoint kinase WEE1 as a novel therapeutic target in medulloblastoma[J].Mol Cancer,2014,13:72.[52] Garimella SV, Rocca A, Lipkowitz S.WEE1 inhibition sensitizes basal breast cancer cells to TRAIL-induced apoptosis[J].Mol Cancer Res,2012,10(1):75-85.
[53] Heijink AM,Blomen VA,Bisteau X,et al.A haploid genetic screen identifies the G1/S regulatory machinery as a determinant of Wee1 inhibitor sensitivity[J].Proc Natl Acad Sci U S A,2015,112(49):15160-15165.
[54] Chilà R, Basana A, Lupi M, et al.Combined inhibition of Chk1 and Wee1 as a new therapeutic strategy for mantle cell lymphoma[J].Oncotarget,2015,6(5):3394-3408.
[55] Magnussen GI, Emilsen E, Giller Fleten K, et al.Combined inhibition of the cell cycle related proteins Wee1 and Chk1/2 induces synergistic anti-cancer effect in melanoma[J].BMC Cancer,2015,15:462.
[56] Porter CC, Kim J, Fosmire S, et al.Integrated genomic analyses identify WEE1 as a critical mediator of cell fate and a novel therapeutic target in acute myeloid leukemia[J].Leukemia,2012,26(6):1266-1276.
[57] Iwai A, Bourboulia D, Mollapour M, et al.Combined inhibition of WEE1 and Hsp90 activates intrinsic apoptosis in cancer cells[J].Cell Cycle,2012,11(19):3649-3655.
[58] Ma H, Takahashi A, Sejimo Y, et al.Targeting of carbon ion-induced G2 checkpoint activation in lung cancer cells using Wee-1 inhibitor MK-1775[J].Radiat Res,2015,184(6):660-669.
[59] Mir SE, De Witt Hamer PC, Krawczyk PM, et al.In silico analysis of kinase expression identifies WEE1 as a gatekeeper against mitotic catastrophe in glioblastoma[J].Cancer Cell,2010,18(3):244-257.
[60] Hamilton DH, Huang B, Fernando RI, et al.WEE1 inhibition alleviates resistance to immune attack of tumor cells undergoing epithelial-mesenchymal transition[J].Cancer Res,2014,74(9):2510-2519.
[61] Igarashi M, Nagata A, Jinno S, et al.Wee1(+)-like gene in human cells[J].Nature,1991,353(6339):80-83.
[62] McGowan CH, Russell P.Cell cycle regulation of human WEE1[J].EMBO J,1995,14(10):2166-2175.
[63] So J, Pasculescu A, Dai AY, et al.Integrative analysis of kinase networks in TRAIL-induced apoptosis provides a source of potential targets for combination therapy[J].Sci Signal,2015,8(371):rs3.
[64] Xiaojuan F, Kai Y, Hanxue L, et al.Effects and mechanism of the circadian clock gene Per1 on the proliferation, apoptosis, cycle, and tumorigenicity in vivo of human oral squamous cell carcinoma[J].Hua Xi Kou Qiang Yi Xue Za Zhi,2016,34(3):255-261.
