三七多糖的微波辅助提取工艺
2018-04-17李佳笑胡宇琳乔春雷杨晓华张华峰
李佳笑, 胡宇琳, 乔春雷, 李 璐, 杨晓华, 张华峰,*
(1.陕西师范大学 中俄食品与健康科学国际联合研究中心/食品工程与营养科学学院, 陕西 西安 710062; 2.西安交通大学 医学部, 陕西 西安 710061)
三七(Panaxnotoginseng)又名田七,是国家卫生部(现国家卫生和计划生育委员会)批准的可用于保健食品的药用植物。据《本草纲目拾遗》记载,人参补气第一,三七补血第一。一般认为,三七的主要活性成分为皂苷和三七素[1]。近年来的研究发现,三七多糖也具有显著的生物活性。陈为等[2]给高强度微波辐射大鼠饲喂三七粗多糖,发现大鼠血清内丙二醛含量显著降低,羟基自由基清除能力显著提高。陈新霞等[3]研究发现,三七多糖能够增强小鼠脾淋巴细胞的增殖转化作用,促进迟发性变态反应,提高免疫力。姜文茹等[4]将三七多糖与自固化磷酸钙人工骨的复合物植入骨缺损模型大鼠,发现三七多糖具有促进骨缺损修复的作用。研究三七多糖的提取工艺、分析多糖的理化性质,对于三七多糖的科学开发以及三七资源的综合利用具有积极意义。微波辅助提取具有提取时间短、提取率高、操作简单等优点,在植物多糖提取方面具有较高的应用价值[5]。本研究采用微波辅助提取分离三七多糖,采用激光粒度分析法探讨提取机理,采用薄层色谱法分析多糖的单糖组成,并测定多糖的溶解性,为三七多糖的研究与开发提供参考。
1 材料与方法
1.1 材料与仪器
三七,2017年采收自云南文山,洗净阴干并于干燥阴凉处保存。硅胶G薄层板(预制板)购自青岛海洋化工厂分厂;葡萄糖、鼠李糖、木糖、阿拉伯糖、半乳糖标准品,分析纯,购自美国Sigma公司;无水乙醇、浓硫酸、苯酚、正丁醇、乙酸乙酯、吡啶、盐酸、NaOH、对氨基苯甲酸、冰醋酸、正磷酸等均为分析纯。
CW2000型超声-微波联合萃取仪(本实验中未使用超声功能),上海新拓仪器科技有限公司;BS224S型电子天平,德国Sartorius公司;722S型紫外可见分光光度计,上海仪电分析仪器有限公司;MS2000型激光粒度分析仪,英国Malvern仪器公司。
1.2 三七多糖的提取
1.2.1微波辅助提取
三七用自来水、蒸馏水依次清洗后晾干,研磨后过筛(20、40、80、120、160、200目),在50 ℃烘干。取4 g三七粉末,加入温度为30 ℃的蒸馏水(80、120、160、180、240 mL),混匀后浸泡(1.0、5.0、10.0、30.0、60.0 min)。然后将混合物移入超声-微波联合萃取仪,进行微波辅助提取(0.5、1.0、3.0、5.0、10.0、20.0 min)。提取结束后,在4 000 r/min条件下离心10 min。取上清液,加入4倍体积的无水乙醇,在4 ℃冰箱放置12 h。而后在4 000 r/min条件下离心15 min,取沉淀,冷冻干燥后即得三七多糖样品。
1.2.2传统提取
除不施加微波辐照外,传统提取的操作条件与微波辅助提取相同。三七清洗、晾干后,研磨过筛200目得到粉末。取4 g三七粉末,加入120 mL蒸馏水(30 ℃),混匀后浸泡60.0 min,提取8.0 min(无微波处理)。离心,取上清液,醇沉后再次离心,取沉淀,冷冻干燥后得到多糖样品。
1.3 三七多糖的定性分析
1.3.1Molish反应
参考Caunii等[6]的方法,取α-萘酚3.75 g,用95%乙醇溶解,定容至25 mL,制得Molish试剂。取1 mg多糖,倾入试管,加蒸馏水1 mL溶解,然后加入Molish试剂2 mL,混匀后沿着试管壁缓缓加入1 mL浓硫酸,观察颜色变化。
1.3.2单糖组分分析
参考Chang等[7]的方法,采用薄层色谱法测定三七多糖样品的单糖组成。在安瓿瓶中加入1 g多糖和10 mL 4 mol/L三氟乙酸的水溶液,充氮气5 min后封口,摇匀,置120 ℃烘箱中水解3 h。然后冷却至室温,将水解液转移到50 mL的圆底烧瓶中,用2 mL蒸馏水洗涤安瓿瓶,洗涤液并入圆底烧瓶,在60 ℃减压蒸干,所得固体用2 mLφ=70%的乙醇充分溶解,用0.45 μm滤膜过滤后即得多糖水解物样品溶液。以0.1 mg/mL的葡萄糖、鼠李糖、木糖、阿拉伯糖、半乳糖的乙醇溶液作为单糖标准品溶液。吸取多糖水解物样品溶液和标准品溶液各3 μL,分别点于同一硅胶G薄层板上,用展开剂V(正丁醇)∶V(乙酸乙酯)∶V(吡啶)∶V(水)=6∶1∶5∶4展开,待展开剂渗透至距离薄层板上缘2 cm左右时取出薄层板,晾干后用相同展开剂进行二次展开。展开结束后将薄层板取出晾干,喷以对氨基苯甲酸溶液(0.5 g对氨基苯甲酸溶于9 mL冰醋酸中,依次加入10 mL水和0.5 mL 85%磷酸溶液,混匀),置105 ℃烘箱中加热10 min后观察。
1.4 三七多糖的定量分析
参考本实验室建立的苯酚硫酸比色法[8],以葡萄糖为对照单糖测定多糖含量。
1.5 激光粒度分析
参考Kwak等[9]的方法,对微波辅助提取、传统提取处理后的三七粉末样品以及未处理样品进行激光粒度分析,得到样品粒度分布图。
1.6 三七多糖溶解性的测定
采用本实验室方法[10]测定多糖溶解性。用盐酸和NaOH配制pH值为1、3、5、7、9、11和13的水溶液。将45 mg三七多糖样品分别倾入30 mL不同pH值的水溶液中(25 ℃),立即以100 r/min的速度搅拌,记录完全溶解所需时间。
1.7 实验设计与数据分析
采用单因素试验方法考察浸泡时间、微波处理时间、液固比(即水体积与三七样品质量的比例)和粒度对三七多糖提取率的影响。在单因素试验基础上,采用4因素3水平即L9(34)正交试验方法优化微波辅助提取的工艺条件,见表1。使用Yang等[10]方法计算多糖提取率。所有实验重复2~5次,求平均值。使用Microsoft Excel和SPSS 12.0软件对实验数据进行统计分析,其中多重比较采用One-Way ANOVA分析,p<0.05、p<0.01分别表示差异显著、极显著。
2 结果与讨论
2.1 微波辅助提取工艺优化
2.1.1单因素实验
2.1.1.1 微波辅助提取时间对多糖提取率的影响
在浸泡时间为60 min、液固比为50 mL/g、粒度为80目的条件下,微波辅助提取时间对三七多糖提取率的影响如图1。可以看出,微波辅助提取时间短于10 min时,随着提取时间的延长,多糖提取率显著升高(p<0.01),在10 min时达到峰值;微波辅助提取时间超过10 min时,提取率显著下降(p<0.01)。这可能是由于三七样品中的多糖在微波辅助提取10 min后,大多数已经溶出,继续延长微波处理时间加剧了微波对多糖的降解[5],从而使提取率明显下降。综合考虑提取率、提取时间和能耗等因素,将微波辅助提取时间控制在10 min左右较适宜。
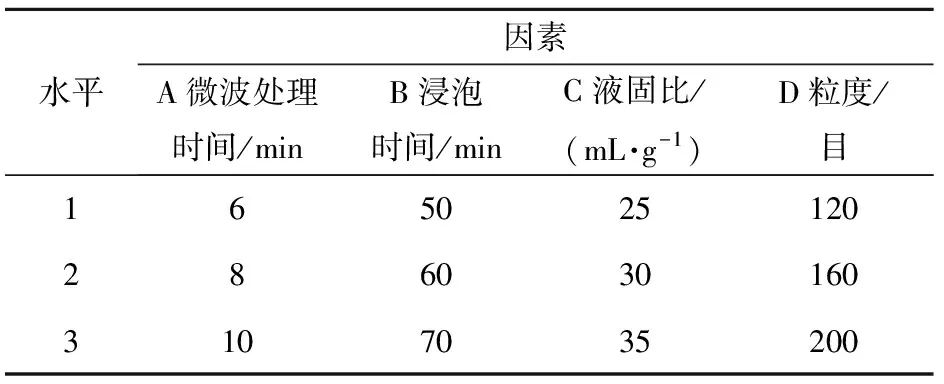
表1 正交试验的因素水平
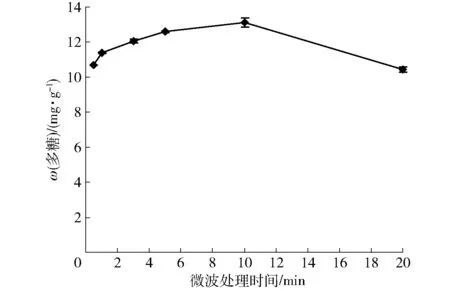
图1 微波处理时间对多糖提取率的影响Fig.1 Effect of microwave duration on extraction yield of polysaccharides
2.1.1.2 浸泡时间对多糖提取率的影响
在微波处理时间为10 min、液固比为50 mL/g、粒度为80目的条件下,浸泡时间对三七多糖提取率的影响如图2。三七多糖的提取率随着浸泡时间的延长而升高。当浸泡时间为60 min时,提取率最高(p<0.05)。为了增加多糖提取率,浸泡时间维持在60 min左右为宜。

图2 浸泡时间对多糖提取率的影响Fig.2 Effect of soaking time on extraction yield of polysaccharides
2.1.1.3 液固比对多糖提取率的影响
在微波处理时间为10 min、浸泡时间为30 min、粒度为80目的条件下,液固比对三七多糖提取率的影响如图3。由图3可知,当液固比小于30 mL/g时,随着液固比的增加,三七多糖的提取率显著升高(p<0.01);当液固比大于30 mL/g时,提取率明显下降(p<0.01);当液固比为30 mL/g时,提取率最高(11.5 mg/g)。Li等[11]在研究文冠果种子的微波辅助提取时发现,液固比对三萜皂苷提取率的影响也呈现出先增加后降低的趋势。在常规的溶剂提取过程中,液固比越高,提取溶剂越多,提取率通常就越大[5]。但是,在微波辅助提取过程中,如果液固比超过一定范围,提取溶剂的体积过大,可能会带来以下问题:1)提取溶剂吸收微波能量后的升温幅度减小;2)搅拌混匀效果变差,不利于植物材料与提取溶剂的充分接触,也不利于目标化合物的扩散、溶出[5]。这可能是液固比过高时三七多糖提取率反而降低的原因。综合考虑提取率、溶剂用量等因素,将液固比控制在30 mL/g较为合适。

图3 液固比对多糖提取率的影响Fig.3 Effect of ratio of liquid to solid on extraction yield of polysaccharides
2.1.1.4 粒度对多糖提取率的影响
在微波处理时间为10 min、浸泡时间为30 min、液固比为30 mL/g的条件下,粒度对三七多糖提取率的影响如图4。当粒度在20~160目区间内逐渐增加时,三七多糖的提取率不断升高(p<0.01);但是,当粒度超过160目时,增加粒度不会使提取率明显提高(p>0.05)。因此,粒度选在160目左右较好,不宜超过200目。
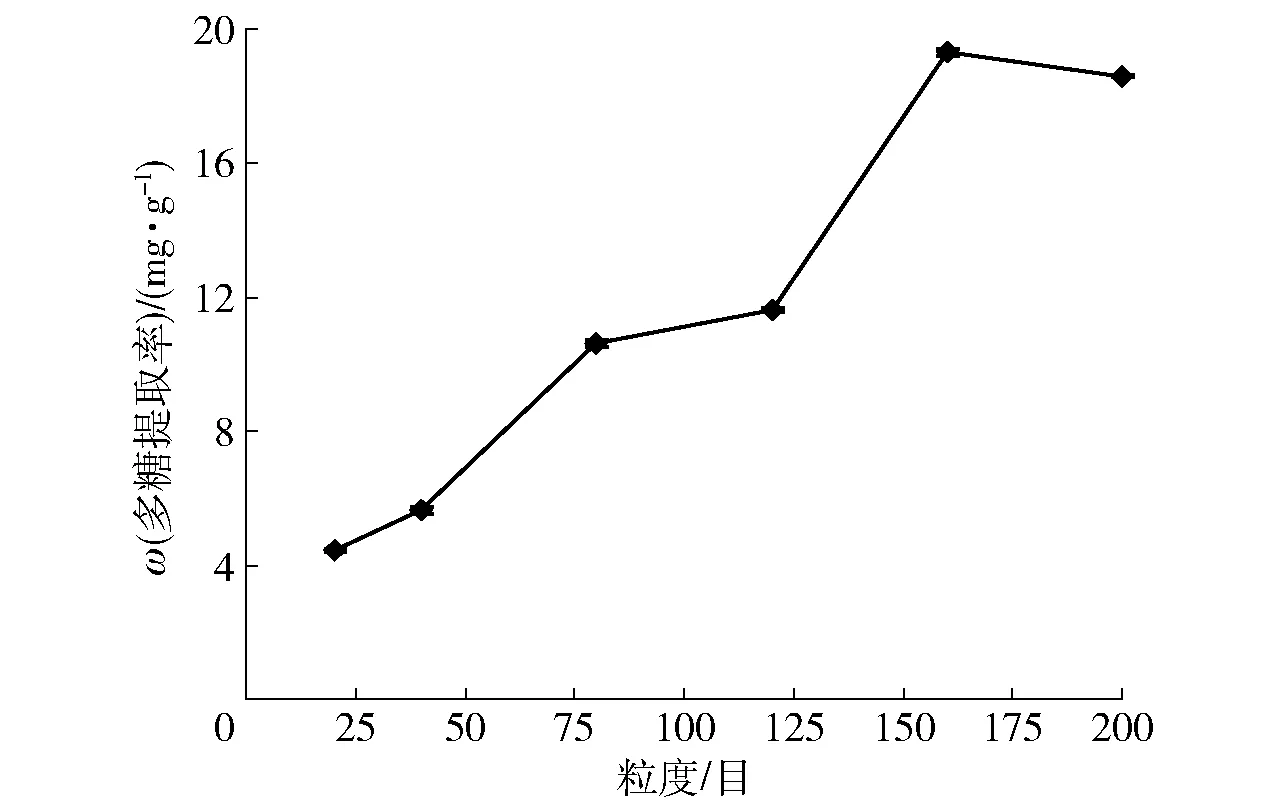
图4 粒度对多糖提取率的影响Fig.4 Effect of particle sizes on extraction yield of polysaccharides
2.1.2正交试验
由单因素实验可见,微波处理时间、浸泡时间、液固比、粒度对三七多糖的提取均有较大影响。为了进一步优化微波辅助提取工艺,选择微波处理时间(A)、浸泡时间(B)、液固比(C)、粒度(D)4个因素进行L9(34)正交试验,见表2。由表2的极差分析结果可知,三七多糖的优化提取工艺方案为A2B2C2D3,即微波处理时间为8 min,浸泡时间为60 min,液固比为30 mL/g,粒度为200目。方差分析结果见表3,可知4个因素对三七多糖的提取都具有极显著影响(p<0.01)。虽然优化提取方案(A2B2C2D3)在正交试验的9次实验中并未出现,但是与优化提取方案最为接近的第4次实验(A2B1C2D3)的提取率(20.4 mg/g)显著高于其他8次实验(p<0.01),提示优化提取方案很可能是较佳工艺条件。为了进一步验证优化提取方案,在该提取条件(A2B2C2D3)下进行了提取实验,所得多糖提取率为21.0 mg/g,显著高于正交试验中的最高提取率(20.4 mg/g)(p<0.05),证明正交试验优选的提取方案的确为较佳工艺条件。
2.2 微波辅助提取机理探究
为了比较微波辅助提取与传统提取的提取效果,在浸泡时间为60 min、提取时间为8 min(无微波处理)、液固比为30 mL/g、粒度为200目的条件下进行了5次传统提取实验,所得平均提取率为12.7 mg/g,显著低于微波辅助提取的平均提取率(21.0 mg/g)(p<0.05)。
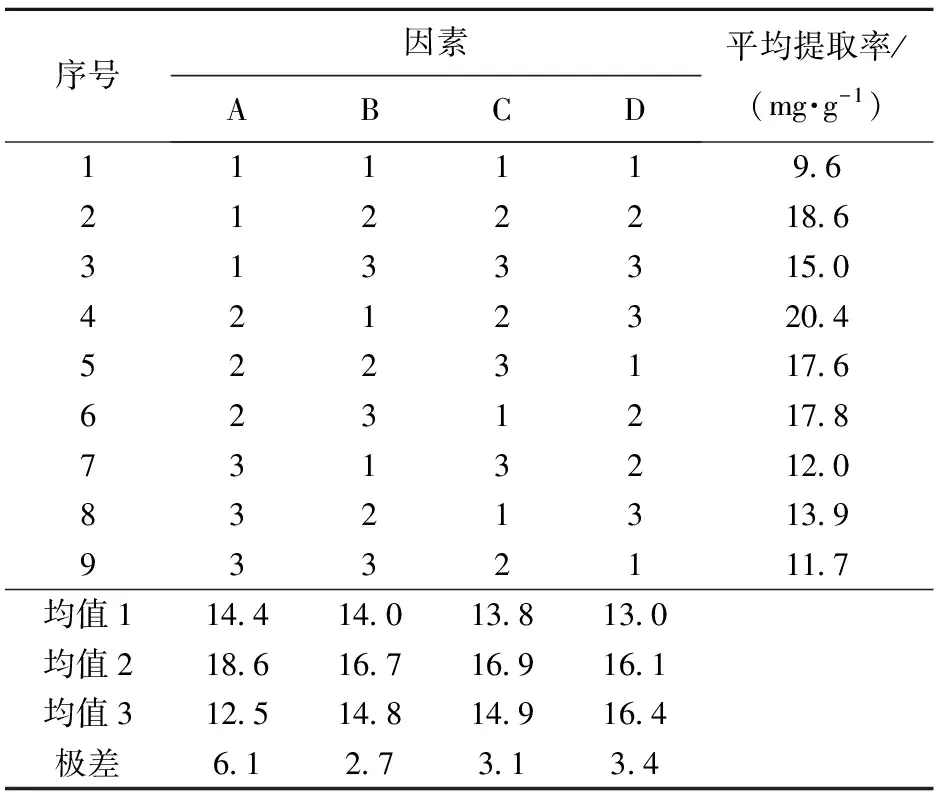
表2 正交试验极差分析
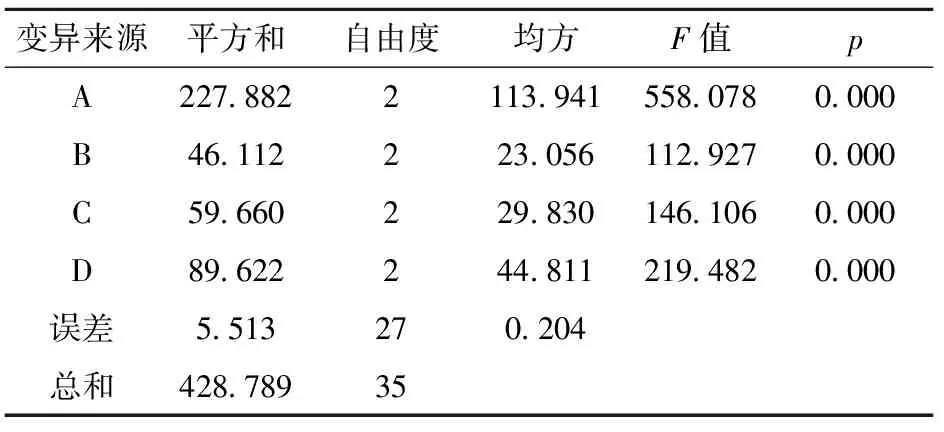
表3 正交试验方差分析
为了探讨微波辅助提取的机理,采用激光粒度分析法比较分析了微波辅助提取处理后的三七样品、传统提取处理后的三七样品和未经处理的三七样品粉末的粒度分布,见图5。结果发现,在小粒度范围内(0~50 μm),传统提取处理后样品粉末的分布频率高于微波辅助提取;在大粒度范围内(50~2 000 μm),微波辅助提取处理后样品粉末的分布频率普遍高于传统提取。可见,同传统提取相比,微波辅助提取可使三七样品的粒度普遍增大。微波处理可能促进了样品粉末的水化和溶胀过程,使样品结构变得松散、膨胀,促进了多糖从样品中扩散和溶出,从而提高了多糖的提取率。

图5 不同方法制得样品的激光粒度分布Fig.5 Particle sizes distribution of samples obtained from different extraction methods
2.3 多糖性质表征
2.3.1Molish实验
采用较佳微波辅助提取工艺条件制得的多糖样品为浅黄褐色固体,其Molish反应呈阳性,证明其含糖类物质。
2.3.2单糖组成分析
三七多糖经过酸水解后,其薄层色谱呈现出3个斑点,分别与葡萄糖、半乳糖和阿拉伯糖相对应。这说明,微波辅助提取得到的三七多糖主要由葡萄糖、半乳糖和阿拉伯糖3种单糖构成,这与盛卸晃等[12]采用传统提取得到的三七多糖的单糖组分相一致。
2.3.3溶解性分析
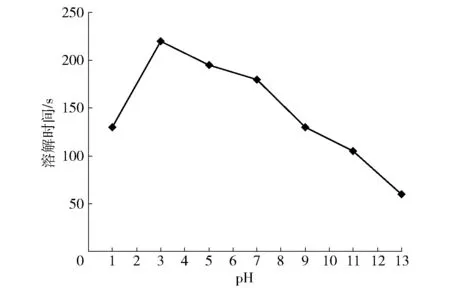
图6 pH值对三七多糖溶解时间的影响Fig.6 Effect of different pH values on solubility of polysaccharides from Panax notoginseng
研究pH值对多糖溶解性的影响,对于多糖研究与开发具有重要的参考意义[10]。pH值对三七多糖溶解时间的影响见图6,可以看出,pH值对三七多糖样品的溶解性影响较大。pH=3时,多糖的溶解时间最长;pH>3时,溶解时间随着pH值的增加而减少;pH=13时,溶解时间最短(60 s)。可见,碱性环境比酸性环境可能更有利于三七多糖的溶解,原因可能是碱性环境下溶液中的氢氧根离子较多,使得富含羟基的多糖更易与水结合[13],其具体机制需要进一步探讨。
3 结 论
微波处理时间、浸泡时间、液固比、粒度4个因素对三七多糖的微波辅助提取具有显著影响。三七多糖的较佳微波辅助提取工艺条件为:微波处理时间,8 min;浸泡时间,60 min;液固比,30 mL/g;粒度,200目。微波辅助提取的多糖提取率显著高于传统提取。同传统提取相比,微波辅助提取可使三七样品的粒度普遍增大,说明微波处理可能促进了样品粉末的水化和溶胀过程,使样品结构变得松散、膨胀,从而促进了多糖从样品中扩散和溶出。三七多糖主要由葡萄糖、半乳糖和阿拉伯糖3种单糖构成,pH值对其溶解性影响较大。本研究为三七资源的开发与利用提供了参考。
致谢:实验材料中的三七由云南七丹药业股份有限公司高明菊总工程师赠送,在此表示衷心感谢。
参考文献:
[1] 谭礼浩,贺丽苹,曹庸,等.络合萃取降低三七中的重金属及其萃取前后形态分析[J].食品与机械,2014,30(5):30-35.
TAN L H, HE L P, CAO Y, et al. Study on speciation analysis and heavy metals reducing inPanaxnotoginsengby complex extraction[J]. Food and Machinery, 2014, 30(5): 30-35.
[2] 陈为,张友成,周苗苗,等.三七多糖对微波辐射大鼠血清氧化指标的影响研究[J].中国辐射卫生,2009,18(2):184-185.
CHEN W, ZHANG Y C, ZHOU M M, et al.Experimental study on effect of the polysaccharides inPananxnotoginsengon oxidation index of the rat serum under the microwave radiation[J]. Chinese Journal of Radiological Health, 2009, 18(2): 184-185.
[3] 陈新霞,顾呈华,杨明晶,等.三七多糖对小鼠免疫功能调节的研究[J].江苏预防医学,2007,18(3):10-12.
CHEN X X, GU C H, YANG M J, et al.Study on the immunoregulation effect ofPanaxnotoginsengpolysaccharides on mice[J]. Jiangsu Journal of Preventive Medicine, 2007, 18(3): 10-12.
[4] 姜文茹,毕良佳,赵尔镲.三七多糖复合自固化磷酸钙人工骨修复骨缺损的实验研究[J].中国中医药科技,2008,15(5):355-356.
[5] ZHANG H F,YANG X H,WANG Y. Microwave assisted extraction of secondary metabolites from plants: current status and future directions[J]. Trends in Food Science & Technology, 2011, 22(12): 672-688.
[6] CAUNII A,BUTU M,RODINO S, et al. Isolation and separation of inulin fromPhalarisarundinacearoots[J]. Revista de Chimie, 2015, 66(4): 472-476.
[7] CHANG X L, FENG Y M, WANG W H. Comparison of the polysaccharides isolated from skin juice, gel juice and flower of aloe arborescens tissues[J]. Journal of the Taiwan Institute of Chemical Engineers, 2011, 42(1): 13-19.
[8] ZHANG H F, NIU L L, YANG X H, et al. Analysis of water-soluble polysaccharides in an edible medicinal plantEpimedium: method development, validation, and application[J]. Journal of AOAC International, 2014, 97(3): 784-790.
[9] KWAK B M, LEE J E, AHN J H, et al. Laser diffraction particle sizing by wet dispersion method for spray-dried infant formula[J]. Journal of Food Engineering, 2009, 92(3): 324-330.
[10] YANG J, ZHANG H F, CAO X Y, et al.Enzymatic water extraction of polysaccharides fromEpimediumbrevicornuand their antioxidant activity and protective effect against DNA damage[J]. Journal of Food Biochemistry, 2017, 41(1): e12298.
[11] LI J, ZU Y G, FU Y J, et al. Optimization of microwave-assisted extraction of triterpene saponins from defatted residue of yellow horn (XanthocerassorbifoliaBunge.) kernel and evaluation of its antioxidant activity[J]. Innovative Food Science & Emerging Technologies, 2010, 11(4): 637-643.
[12] 盛卸晃,王健,郭建军,等.三七多糖的分离纯化及理化性质研究[J].中草药,2007,38(7):987-989.
[13] 刘晓连,李亚蕾,罗瑞明,等.灵武长枣水提多糖结构特征及理化性质[J].食品科学,2013,34(15):120-125.
LIU X L, LI Y L, LUO R M, et al.Structural characterization and physio-chemical properties of Lingwu long jujube polysaccharide[J]. Food Science, 2013, 34(15): 120-125.
