高压热水提取灵芝多糖及对其抗氧化活性的影响
2018-04-17操丽丽姚江奇姜绍通
操丽丽, 周 俊, 郑 峰, 姚江奇, 王 涛, 姜绍通, 庞 敏,*
(1.合肥工业大学 食品科学与工程学院/安徽省农产品精深加工重点实验室, 安徽 合肥 230009; 2.安徽黄山云乐灵芝有限公司, 安徽 宣城 242609)
灵芝(Ganodermalucidum)是我国一种重要的药用真菌,具有很高的药用价值,素有“仙草、瑞草”之美誉,作为民间药方延年益寿和滋补身体已经有上千年历史。灵芝含有多糖、核苷、三萜化合物、生物碱、不饱和脂肪酸、甾醇、有机锗等活性成分[1-2]。灵芝多糖是灵芝中主要的生物活性成分,具有抗肿瘤[3-4]、免疫调节[5]、抗氧化[6]等多种药理活性,因此灵芝多糖是灵芝研究的一个热点。
灵芝子实体多糖属于胞内多糖,存在于细胞壁或细胞间质中,而灵芝子实体的细胞壁是由纤维素、半纤维素和木质素组成的致密结构,导致灵芝多糖不易从细胞内提取出来。利用多糖易溶于热水、稀酸、稀碱等极性溶液的特性,目前提取灵芝多糖的方法主要有热水浸提法[7]、超声协助水提法[8]、微波提取法[9]、酶法[10]、微波辅助超声提取法[11]等。热水浸提法提取多糖是工业生产常用的方法,但提取时间长、能耗大、得率低、活性差,限制了灵芝产业的发展。超声协助水提法以超声波的高频振荡及其产生的“空穴效应”破坏细胞结构,有利于多糖从细胞内溶出;酶法提取是以酶来降解细胞壁,使得胞内多糖溶出,可提高灵芝多糖的得率;微波提取法是通过微波破坏细胞壁和细胞膜的结构,从而使胞内多糖快速溶出[12],但这些方法因成本高,在工业上难以大规模的应用。高压热水法是利用高压对细胞的破碎作用,有利于热水从胞内溶出多糖,此提法方法简单可行、适用性强,可用于大批量的工业生产[13]。
由于高温高压的提取强度会对多糖的结构和活性产生影响,且抗氧化性是灵芝多糖的主要药理活性之一,因此,本文通过正交试验对高压热水提取灵芝多糖的工艺进行了优化,并分析提取工艺对其抗氧化活性的影响,期望获得的结果能为灵芝的开发利用提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
灵芝子实体超微粉由安徽黄山云乐灵芝有限公司提供。
葡萄糖、蒽酮、浓硫酸、无水乙醇、正丁醇、氯仿等试剂均为分析纯,中国国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),梯希爱(上海)化成工业发展有限公司。
1.2 仪器与设备
TU-1901型双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;MLS-3780型高压蒸汽灭菌锅,日本SANYO公司;AL104型电子天平,梅特勒-托利多仪器(上海)有限公司;CR22GⅡ型高速冷冻离心机,日本日立公司;CR22GⅡ型超滤设备,美国Pall公司;FD-1A-50型冷冻干燥机,北京博医康实验仪器有限公司。
1.3 检测方法
1.3.1还原糖的检测
采用3,5-二硝基水杨酸(DNS)法[14]。以葡萄糖质量浓度(x,mg/mL)为横坐标、吸光度(y)为纵坐标,绘制葡萄糖标准曲线,对其进行线性回归后得到方程y=1.404 2x-0.017 7,该方程的相关系数为0.999 2,葡萄糖浓度的线性检测范围为0.10~0.70 mg/mL。还原糖的质量浓度计算见式(1)。

(1)
式(1)中ρ为根据葡萄糖标准曲线计算得到待测提取液中葡萄糖质量浓度,mg/mL;V为灵芝多糖提取液体积,mL;n为稀释倍数;m为灵芝子实体超微粉质量,g。
1.3.2多糖的检测
采用蒽酮-硫酸法[15]。以葡萄糖质量浓度(x,mg/mL)为横坐标、吸光度(y)为纵坐标,绘制葡萄糖标准曲线,对其进行线性回归后得到方程y=5.420 6x-0.077 3,该方程的相关系数为0.999 1,葡萄糖浓度的线性检测范围为0.04~0.18 mg/mL。总糖的质量浓度和多糖的提取率计算分别见式(2)和(3)。

(2)
ω(多糖)=[ω(总糖)-ω(还原糖)]×0.9×100%。
(3)
式(2)和(3)中,0.9为葡萄糖换算成葡聚糖校正系数,其他参数同1.3.1节。
1.3.3DPPH自由基清除率的测定
根据文献[16],称取一定量的DPPH,用无水乙醇配制成0.2 mmol/L的DPPH溶液。取2 mL待测液,加入 2 mL 0.2 mmol/L DPPH溶液,混合均匀,室温放置30 min后,于波长525 nm处测吸光度(Ai)。以2 mL待测液和2 mL无水乙醇混合作为对照组(Aj),另外2 mL 0.2 mmol/L DPPH溶液和2 mL无水乙醇混合后测吸光值(Ac)。DPPH自由基清除率计算见式(4)。

(4)
1.4 高压热水提取灵芝多糖工艺优化
1.4.1单因素实验
精确称取灵芝子实体超微粉末 1.00 g,以蒸馏水为提取溶剂,分别研究提取温度(110、115、120、125、130 ℃)、料液比 (即灵芝子实体超微粉质量与提取溶剂体积的比例)(1∶30、1∶40、1∶50、1∶60、1∶70 g/mL)、提取时间(20、30、40、50、60 min)对灵芝总糖含量、还原糖含量和DPPH自由基清除率的影响。每组实验重复3次,取平均值。
1.4.2正交试验
根据单因素实验结果,用L9(34)设计正交试验研究提取温度、提取时间、料液比对灵芝多糖提取的影响,对灵芝多糖高压热水提取工艺进行优化。每组实验重复3次,取平均值。
1.4.3提取次数对灵芝多糖提取率影响的研究
根据正交试验优化确定的工艺,提取灵芝多糖。高压热水灵芝多糖提取液经5 000 r/min离心20 min,测定上清液中的总糖和还原糖含量。取弃去上清液后的固体多次重复提取,测定上清液中的总糖和还原糖含量。
1.5 灵芝多糖的纯化
称取50.00 g灵芝子实体超微粉,在较佳高压热水提取条件下提取多糖,5 000 r/min离心20 min后收集上清液,经过3 000 Da膜超滤浓缩后,向溶液中加入其体积1/3的Sevag试剂(V(氯仿)∶V(正丁醇)=4∶1)混合震荡后静置30 min,离心(4 000 r/min,5 min),除去有机层及水层和有机层交界处的变性蛋白质,重复多次至无蛋白质产生。除蛋白后的多糖,冷冻干燥保存,测定DPPH自由基清除率。
2 结果与分析
2.1 提取温度对灵芝多糖提取的影响
以料液比1∶50 g/mL、提取时间为30 min,考察110、115、120、125和130 ℃的提取温度对灵芝多糖提取的影响,结果见图1。

图1 提取温度对灵芝多糖提取的影响Fig.1 Effect of temperature on extraction efficiency of polysaccharides from Ganoderma lucidum
由图1可以看出,随着提取温度的升高,灵芝多糖提取液中总糖含量和还原糖含量不断增加,对DPPH自由基清除率不断下降,当温度达到125 ℃时,总糖含量的增加不显著,而还原糖含量显著增加。这说明随着温度的升高,有助于多糖从细胞中的溶出,但高温也导致多糖发生降解,其抗氧化活性也降低了。因此,选择125 ℃作为较佳提取温度。
2.2 料液比对灵芝多糖提取的影响
以提取温度120 ℃、提取时间为30 min,考察1∶30、1∶40、1∶50、1∶60和1∶70 g/mL的料液比对灵芝多糖提取的影响,结果见图2。

图2 料液比对灵芝多糖提取的影响Fig.2 Effect of solid-to-liquid ratio on extraction efficiency of polysaccharides from Ganoderma lucidum
由图2可以得知,在料液比为1∶30~1∶50 g/mL时,灵芝多糖提取液中总糖含量和对DPPH自由基清除率随提取用水量的增加而增大;当料液比为1∶50 g/mL时,总糖的含量和灵芝多糖提取液对DPPH自由基清除作用达到最大。而当继续增加提取用水量时,总糖含量反而有着缓慢下降。这可能的原因是,在1∶50 g/mL的料液比时,灵芝多糖的浸出已比较充分,继续增加提取用水,含量没有多大的变化,反而增加了升温的时间。此外,提取用水的增加会增加其他组分(如蛋白质)的溶出,对于多糖的溶解可能存在一定影响。同时,在不同的料液比下,灵芝多糖提取液中还原糖含量变化不明显,说明料液比对灵芝多糖的降解影响不显著。因此,选择1∶50g/mL作为灵芝多糖提取的较佳料液比。
2.3 提取时间对灵芝多糖提取的影响
以料液比1∶50 g/mL、提取温度120 ℃,考察20、30、40、50和60 min的提取时间对灵芝多糖提取的影响,结果见图3。

图3 提取时间对灵芝多糖提取的影响Fig.3 Effect of time on extraction efficiency of polysaccharides from Ganoderma lucidum
由图3可以看出,在20~60 min内,灵芝多糖提取液中还原糖含量随着时间的增加不断升高,呈线性增长;而总糖含量的增长在30 min后趋于平缓。这可能是因为高压热水提取灵芝多糖是一个固液非均相的提取过程,需要一定的时间才能使多糖从固体内部传递到液体,因此总糖含量随时间的增加而增大;而在30 min后,固液体中多糖达到平衡,继续增加提取时间对总糖含量的影响较小,但时间的延长存在多糖的分解。同时,在20~40 min内,灵芝多糖提取液对DPPH自由基清除率不断增加,而在40 min后,灵芝多糖提取液对DPPH自由基清除作用不断下降。因此,选择30 min作为较佳的提取时间。
2.4 正交试验
在单因素实验结果的基础上,选用L9(34)正交表,对高压热水提取灵芝多糖提取工艺进行正交试验优化,实验结果和分析结果见表1。

表1 正交试验设计及结果
从表1中极差分析结果可以看出,3个因素对灵芝多糖提取率的影响由大到小依次为料液比(B)、提取时间(C)和提取温度(A)。在实验设计范围内,优化得到高压热水提取灵芝多糖的较佳条件为A2B2C2,即提取温度为125 ℃、料液比1∶50 g/mL、提取时间30 min。该组合没有在正交试验的9个组合中出现,验证实验结果表明,在此条件下高压热水提取灵芝多糖的提取率为4.54%。相比较常压热水(在料液比1∶50 g/mL、提取温度95 ℃、提取时间30 min条件下,多糖的提取率为3.01%)来说,高压热水提取灵芝多糖的提取率提高了50%以上。
2.5 提取次数对灵芝多糖提取的影响
以提取温度为125 ℃、料液比1∶50 g/mL、提取时间30 min,考察高压热水提取次数对灵芝多糖提取的影响,结果见表2。
从表2可以看出,随着抽提次数的增加,多糖的提取率越来越低,第一次提取的多糖占4次提取多糖总量的53.47%,2次提取的多糖含量可达6.78%,占总提取量的80%以上,3次提取的多糖占总提取量的93%以上,因此可见在高压热水条件下,灵芝子实体多糖提取只需提取 2~3 次,即可提取出绝大部分多糖。
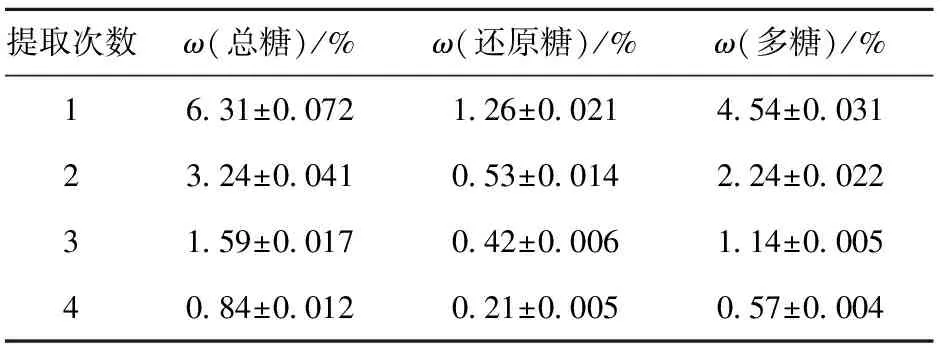
表2 提取次数对灵芝多糖提取率的影响
2.6 灵芝多糖对DPPH自由基清除率的影响
灵芝多糖对DPPH自由基的清除作用如图4。
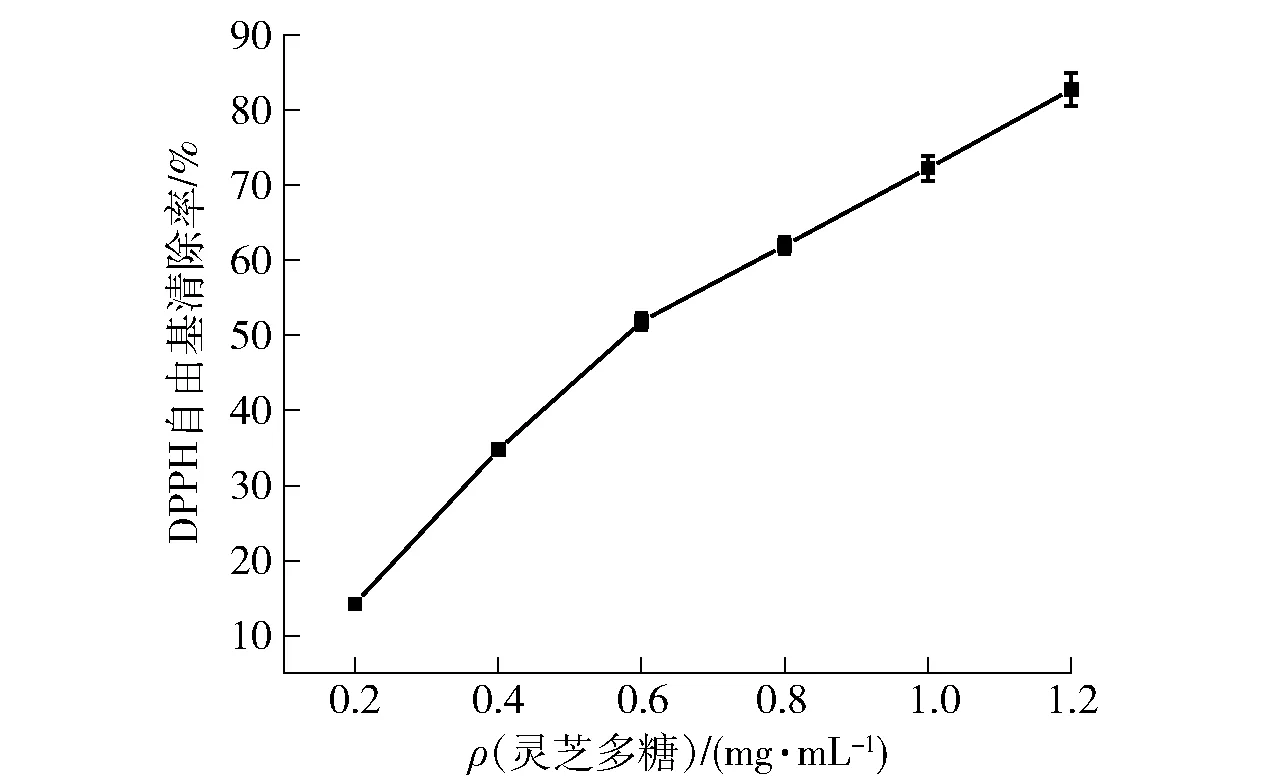
图4 灵芝多糖对DPPH·消除率的影响Fig.4 Effect of polysaccharides from Ganoderma lucidum on scavenging activity of DPPH radicals
由图4可知,灵芝多糖具有清除DPPH自由基的能力,而且清除能力随多糖浓度的增加逐渐增强,表明灵芝多糖对DPPH自由基的清除率与多糖含量存在量效关系。
3 结 论
灵芝子实体细胞的细胞壁具有细胞壁是由纤维素、半纤维素和木质素组成的致密结构,通过高压热水提取,可以提高水对细胞穿透力和细胞破坏力,能有效加快多糖的释放。以灵芝子实体超微粉为原料,研究了在高压热水条件下提取温度、时间和料液比对灵芝多糖的提取以及提取液对DPPH自由基清除率的影响。结果显示,在一定范围内,灵芝多糖提取率随着提取温度升高、时间增加和料液比增大而增大,但高温高压也会促进灵芝多糖分解,影响其对DPPH自由基清除作用。通过正交试验优化,得到灵芝多糖高压热水提取优化条件为料液比1∶50g/mL、提取温度125 ℃、提取时间为30 min,在此条件下,一次高压热水提取灵芝多糖提取率达到4.54%,相较于常压热水提取法来说,多糖提取率显著提高。抗氧化实验结果表明,灵芝多糖对 DPPH 自由基有一定的清除能力,且与多糖质量浓度存在一定的量效关系。
参考文献:
[1] ZHOU X W, SU K Q, ZHANG Y M. Applied modern biotechnology for cultivation ofGanodermaand development of their products[J]. Applied Microbiology & Biotechno-logy, 2012, 93(3):941-963.
[2] 毛健, 马海乐. 灵芝多糖的研究进展[J]. 食品科学, 2010, 31(1):295-299.
MAO J, MA H L. Research progress ofGanodermalucidumpolysaccharides[J]. Food Science, 2010, 31(1):295-299.
[3] ZHANG J, CHEN J M, WANG X X, et al. Inhibitor or promoter? The performance of polysaccharides fromGanodermalucidumon human tumor cells with different p53 statuses[J]. Food & Function, 2016, 7(4):1872-1875.
[4] SLIVA D, LOGANATHAN J, JIANG J, et al. MushroomGanodermalucidumprevents colitis-associated carcinogenesis in mice[J]. Plos One, 2012, 7(10):e47873.
[5] WANG J, YUAN Y, YUE T. Immunostimulatory activities of β-d-glucan fromGanodermalucidum[J]. Carbohydrate Polymers, 2014, 102:47-54.
[6] SHI M, ZHANG Z, YANG Y. Antioxidant and immunoregulatory activity ofGanodermalucidumpolysaccharide (GLP)[J]. Carbohydrate Polymers, 2013, 95(1):200-206.
[7] 白凤岐, 牟建楼, 陈志周,等. 水提法提取灵芝多糖及其体外抗氧化研究[J]. 食品工业, 2015(3):143-146.
BAI F Q, MOU J L, CHEN Z Z, et al. Study on extraction and antioxidant activity ofGanodermalucidumpolysaccharides by water method[J]. Food Industry, 2015(3):143-146.
[8] SHI M, YANG Y, HU X, et al. Effect of ultrasonic extraction conditions on antioxidative and immunomodulatory activities of aGanodermalucidumpolysaccharide originated from fermented soybean curd residue[J]. Food Chemistry, 2014, 155(10):50-56.
[9] 张妙彬, 潘丽晶, 陈继敏,等. 灵芝多糖的微波法提取及抗氧化活性研究[J]. 中国食用菌, 2013, 32(4):35-37.
ZHANG M B, PAN L J, CHEN J M, et al. Study on extraction and antioxidant activity ofGanodermalucidumpolysaccharides by microwave method[J]. Edible Fungi of China, 2013, 32(4):35-37.
[10] 董玉玮, 苗敬芝, 曹泽虹,等. 酶法提取灵芝多糖的工艺研究[J]. 食品科技, 2009(6):217-220.
DONG Y W, MIAO J Z, CAO Z H, et al. Extraction of polysaccharide inGanodermalucidumby enzymatic method[J]. Food Science and Technology, 2009(6):217-220.
[11] 黄生权, 李进伟, 宁正祥. 微波-超声协同辅助提取灵芝多糖工艺[J]. 食品科学, 2010, 31(16):52-55.
HUANG S Q, LI J W, NING Z X. Ultrasonic-microwave synergistic extraction of polysaccharides from cultivatedGanodermalucidum[J]. Food Science, 2010, 31(16):52-55.
[12] 王波. 灵芝多糖提取、分离纯化、表征及体外抗氧化活性探究[D]. 郑州: 郑州大学, 2016.
WANG B. Extraction, isolation, purification, characteri-zation andinvitroantioxidant activity of polysaccharide fromGanodermalucidum[D]. Zheng Zhou: Zhengzhou University, 2016.
[13] MATSUNAGA Y, WAHYUDIONO, MACHMUDAH S, et al. Hot compressed water extraction of polysaccharides fromGanodermalucidum, using a semibatch reactor[J]. Asia-Pacific Journal of Chemical Engineering, 2014, 9(1):125-133.
[14] 张青, 潘英, 童本定. 3,5-二硝基水杨酸法测定灵芝多糖的含量[J]. 中国老年保健医学, 2013, 11(5):7-9.
ZHANG Q, PAN Y, TONG B D, et al. Determination ofGanodermalucidumpolysaccharide content by 3,5-dinitrosalicylic acid method[J]. Chinese Journal of Geriatric Care, 2013, 11(5):7-9.
[15] 郭晓蕾, 朱思潮, 翟旭峰,等. 硫酸蒽酮法与硫酸苯酚法测定灵芝多糖含量比较[J]. 中华中医药学刊, 2010(9):2000-2002.
GUO X L, ZHU S C, ZHAI X F, et al. Comparison of methods in determination of polysaccharide inGanodermalucidum[J]. Chinese Archives of Traditional Chinese Medicine, 2010(9):2000-2002.
[16] 朱尚彬, 聂少平, 朱盼,等. 黑灵芝不同溶剂提取物抗氧化活性比较研究[J]. 食品科学, 2009, 30(17):98-101.
ZHU S B, NIE S P, ZHU P, et al. Comparative study of antioxidant activity of different solvent extracts ofGanodermalucidum[J]. Food Science, 2009, 30(17):98-101.
