植物乳杆菌Y42无细胞培养上清抑制单增李斯特菌生物膜形成研究
2018-04-17李福赞牟光庆李新玲妥彦峰
宋 杏, 尤 宏, 李福赞, 牟光庆, 李新玲, 妥彦峰,*
(1.大连工业大学 食品学院/大连市益生菌功能特性研究重点实验室, 辽宁 大连 116034; 2.新疆天润生物科技股份有限公司, 新疆 乌鲁木齐 830088)
生物膜是附着于活性或惰性实体表面的菌体及由菌体自身分泌的水合多糖、蛋白质、核酸、脂质包裹而形成的大量微生物聚集体[1]。生物膜态的单增李斯特菌的生物学特性、形态结构、致病性及对环境因子的敏感性等均与浮游菌有很大差异[2],对常规药物和宿主免疫防御机制的耐受能力增强了2~1 000倍,是菌体产生耐药性难以控制的主因[3]。
单核细胞增生李斯特菌(Listeriamonocytogenes, LM)简称单增李斯特菌,是李斯特菌属中对人致病性最强的菌种[4]。一般情况下,孕妇、老年人、幼儿等机体免疫力低下的人群易出现李斯特菌病,严重时可导致脑膜炎、败血症、流产、中枢神经系统感染等临床并发症[5],住院患者致死率高达30%~40%[6]。多项研究证实,单增李斯特菌能在短时间内黏附于聚苯乙烯、玻璃和不锈钢表面并形成生物被膜[7]。目前,李斯特菌感染只能用抗生素类药物进行治疗,然而单增李斯特菌对抗生素产生了耐药性,使得单增李斯特菌生物膜感染具有长期性和反复性,难以根除[8]。
如何有效控制LM生物膜形成日益成为研究的热点。研究表明,乳杆菌代谢产生有机酸、过氧化氢、细菌素等物质对腐败菌和致病菌及其生物膜具有良好的抑制作用[9]。文章分析了非杀菌剂量的Y42上清对LM生物膜形成的抑制作用,为LM生物膜的控制提供了新选择。
1 材料与方法
1.1 实验菌株和培养条件
植物乳杆菌Y42与LM的纯化菌种均采用甘油冷冻法保存,置于大连工业大学大连市益生菌功能特性研究重点实验室-80 ℃超低温冰箱。植物乳杆菌Y42接种于MRS液体培养基中,于37 ℃恒温培养箱活化培养。LM接种于LB肉汤培养基中,置于37 ℃恒温培养箱中活化培养, 培养结束后,将LM浓度调为1.0×107CFU/mL。
1.2 仪器与设备
PL303型电子分析天平,梅特勒-托利多仪器(上海)有限公司;SW-CJ-1FD型超净工作台,苏州安泰空气技术有限公司;SX-500型自动高压灭菌器,日本Tomy Digital BioLogy公司;DNP-9082型电热恒温培养箱,上海精宏实验设备有限公司;Z326K型冷冻离心机,德国HERMLE Labortechnlk GmbH公司;ALpha 1-2型真空冻干机,德国Marin Christ公司;BPH-9082型精密恒温培养箱,上海一恒科学仪器有限公司;Multiskan GO-1510型酶标仪,Thermo Fisher Scientific公司;KQ5200D型数控超声清洗器,昆山市超声仪器有限公司;DGG9070型电热恒温鼓风干燥箱,上海森信实验仪器有限公司。
1.3 实验方法
1.3.1Y42上清的制备及冷冻干燥
活化的植物乳杆菌Y42菌株接种在30 mL MRS液体培养基中,37 ℃培养24 h后,使用冷冻离心机在4 ℃ 8 000 r/min条件下离心10 min,收集上清液,然后再经0.22 μm无菌滤膜除去菌体,收集得到的滤液即为植物乳杆菌Y42无细胞培养上清液(简称Y42上清)。将Y42上清在真空冻干机中冷冻干燥24 h后称重,并于-20 ℃冰箱保存,使用时重溶于蒸馏水中配制成所需的质量浓度。
1.3.2Y42上清最小抑菌质量浓度的确定
根据美国临床和实验室标准协会所述的建议,采用96孔酶标板刃天青显色法测定Y42上清对LM的最小抑菌质量浓度,并根据需要稍作修改[10-11],具体操作如下:Y42上清的冻干物重溶于蒸馏水中配制成240、120、60、30、15 mg/mL连续2倍稀释的复溶液。 96孔酶标板中,实验组加入160 μL LM(1×107CFU/mL)和20 μL Y42上清,设置只有LB培养基和刃天青的阳性对照组以及只有LM菌悬液和刃天青的阴性对照组。实验组和对照组都设置6个复孔,37 ℃培养24 h。培养结束后,观察各孔颜色变化,并在激发波长为530 nm、吸收波长为590 nm下用荧光酶标仪测定荧光值。与阴性对照组荧光值有显著性差异且未变色的孔对应的Y42上清的质量浓度被定义为Y42无细胞培养上清液的最小抑菌质量浓度(minimal inhibit concentration,MIC)。从每孔内取出100 μL涂布到LB营养琼脂板上,37 ℃培养24 h,菌落数不超过5个的平板所对应的上清液质量浓度被定义为Y42无细胞培养上清液的最小杀菌质量浓度(minimum bactericidal concentration,MBC)。配置质量浓度为1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC和1/32 MIC的Y42上清。
1.3.3LM在1/2 MIC Y42上清作用下生长曲线的测定
测定浮游LM在1/2 MIC Y42上清作用下的生长曲线[12]:将LM(100 μL,1×107CFU/mL)接种于5 mL无菌LB培养基中,实验组加入12 μL 1/2 MIC Y42上清,对照组加入12 μL无菌LB培养液,置于37 ℃培养箱中培养24 h。每隔3 h收集等分试样测定OD600,以培养时间为横坐标,OD600为纵坐标绘制生长曲线。
1.3.4Y42上清对LM生物膜形成的抑制作用

(1)
1.3.5LM生物膜的显微镜观察
根据回丽媛等[14]所述的方法通过光学显微镜观察LM在盖玻片上形成的生物膜,并根据需要稍作修改,具体操作如下:将1 cm×1 cm无菌盖玻片置于含有2 mL新鲜LB培养基的6孔酶标板内,所述LB培养基内补充有200 μL浓度分别为1/2 MIC,1/4 MIC,1/8 MIC,1/16 MIC、1/32 MIC的Y42上清和20 μL(1×107CFU/mL)LM菌悬液悬液。对照孔内只含有2 mL LB培养基,37 ℃孵育24 h,然后用0.1 mol/L PBS(pH值7.3)冲洗3次,除去未黏附的菌体,用质量浓度0.1 g/mL结晶紫染色5 min,再次洗去盖玻片上未结合的染液,晾干后在光学显微镜10×40放大倍数下观察在盖玻片上形成的生物膜。
1.3.6Y42上清对LM爬行运动性的影响测定
实验采用Li等[15]所述的软琼脂法分析植物乳杆菌Y42无细胞培养上清液对LM爬行运动性的影响,并稍作修改:将50 μL过夜培养的LM(1×107CFU/mL)菌悬液接种于5 mL含1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC和1/32 MIC Y42上清的LB培养基中,以未加入上清液的一组作为对照,37 ℃培养24 h。培养结束后,4 ℃ 1 000 r/min 条件下离心10 min,收集菌体,用无菌PBS(pH值7.3)洗3次并制成5 mL PBS重悬液。取10 μL重悬液接种于软琼脂平板(体积分数0.3%琼脂)的中心进行斑点接种,37 ℃培养24 h后,用游标卡尺测量LM的爬行运动直径。
1.3.7数据分析
数据采用IBMSPSS20.0软件进行统计,差异显著性检验采用单因素方差分析(ANOVE,LSD)。所有数据均表示为平均值±标准误差,在95%水平用ANOVA分析方法进行数据显著性分析,p<0.05表示差异显著。
2 结果与分析
2.1 Y42上清MIC和MBC的测定结果
通过96孔酶标板刃天青显色法和涂布法得到的植物乳杆菌Y42无细胞培养上清液对LM的MIC和MBC结果如图1。由1(a)刃天青显色结果可知,经240、120和60 mg/mL Y42上清处理后,刃天青没有被LM还原为粉红色或粉紫色,而是保持刃天青和Y42上清混合后的颜色;而30 mg/mL Y42上清作用下的刃天青被LM菌体还原为粉红色。由图1(b)所示荧光检测结果可知,经15 mg/mL和30 mg/mL Y42上清荧光值与阴性对照组无显著性差异,而60 mg/mL Y42上清荧光值与阴性对照组存在显著性差异(p<0.05)。综合以上结果可以确定Y42上清对LM的MIC为60 mg/mL。由图1(c)所示涂布结果可知,120 mg/mL Y42上清作用下未看到LM单菌落的生长,因此120 mg/mL Y42上清可将LM完全致死,因此,Y42上清的MBC为120 mg/mL。
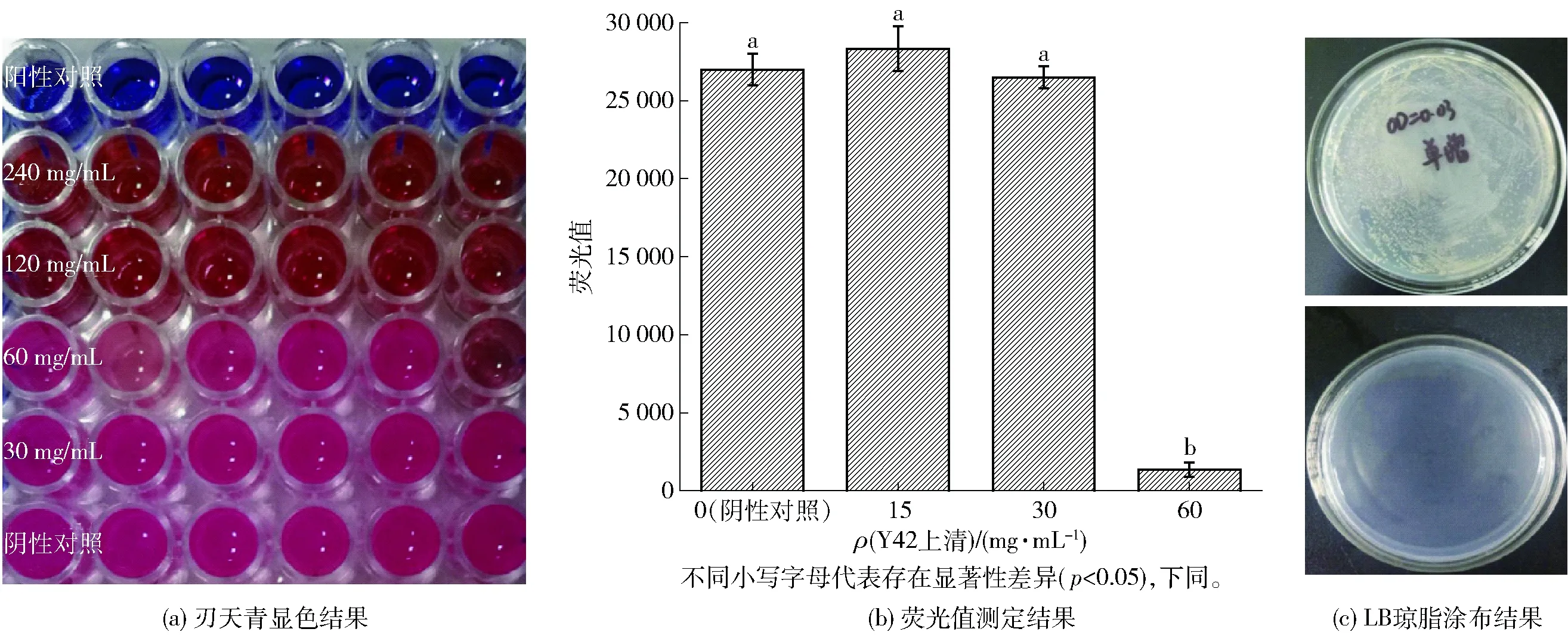
图1 Y42上清抑制LM的MIC和MBCFig.1 MIC and MBC of L. plantarum-Y42 cell free fermentation supernatant against LM
2.2 1/2 MIC Y42上清作用下LM生长曲线的测定结果
为了排除由于乳杆菌发酵上清液抑制浮游LM生长而导致生物膜形成量减少的干扰作用,选择质量浓度1/32 MIC、1/16 MIC、1/8 MIC、1/4 MIC和1/2 MIC的Y42上清作用于LM生物膜形成过程。浮游LM在1/2 MIC的上清作用下的生长曲线结果如图2。结果表明,1/2 MIC Y42上清作用下LM的生长虽然与对照组相比稍有滞后,但并没有受到显著抑制甚至致死,因此可将1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC及1/32 MIC等质量浓度用于非杀菌剂量的植物乳杆菌Y42无细胞培养上清液对LM生物膜的抑制研究。

图2 1/2 MIC Y42上清作用下LM的生长曲线Fig.2 Growth curves of LM in the presence or absence of 1/2 MIC of L. plantarum-Y42 fermentation supernatant

图3 Y42上清对LM生物膜形成的抑制率Fig.3 Biofilm formation inhibition rate of L. plantarum-Y42 fermentation supernatant on LM
2.3 Y42上清对LM生物膜形成抑制率的测定结果
采用微孔板结晶紫染色法测定了不同抑菌浓度植物乳杆菌Y42无细胞培养上清液对LM生物膜形成的抑制率,结果如图3。Y42上清的质量浓度分别为1/32 MIC、1/16 MIC、1/8 MIC、1/4 MIC、1/2 MIC时,对LM生物膜形成的抑制率分别为32.90%、30.81%、40.75%、39.93%、12.15%,LM生物膜的形成均显著低于对照组(p<0.05)。
之前已有研究表明,乳酸菌的无细胞发酵上清液具有抑制LM生物膜形成的作用。 Camargo等[16]发现含细菌素的乳酸菌无细胞上清液具有防止生物膜形成的潜力。Winkelströter等[17]发现植物乳杆菌FT259及其细菌素可降低LM生物膜的形成。本研究中植物乳杆菌Y42无细胞培养上清液中何种物质发挥了抑制单增李斯特氏菌生物膜的形成,还有待进一步研究。
2.4 LM生物膜的显微镜观察
通过光学显微镜定性观察不同浓度植物乳杆菌Y42无细胞培养上清液作用下,LM黏附在盖玻片上形成的生物膜(见图4)。在10×40的放大倍数下,未经Y42上清作用的LM菌体细胞中,一些分散的菌体相连接,大部分菌体细胞边界不清晰,彼此部分重叠,黏结成团块,形成生物膜的典型结构单元。而1/32 MIC、1/16 MIC、1/8 MIC、1/4 MIC及1/2 MIC Y42上清作用下的LM菌体间很少有黏结,大部分分散分布,且黏附在盖玻片上的菌体数量明显比不含Y42上清的一组少。由此可知,Y42上清能够抑制LM的聚集、黏附、生物膜的形成甚至能够使生物膜的三维结构坍塌,使膜内菌体从原生物膜中脱离,重新成为浮游菌体。
2.5 Y42上清对LM爬行运动性的影响
不同浓度植物乳杆菌Y42无细胞培养上清液作用下LM爬行运动直径的结果如图5,Y42上清的质量浓度分别为0、1/32 MIC、1/16 MIC、1/8 MIC、1/4 MIC和1/2 MIC时,LM的爬行运动直径分别为81.15、78.31、75.35、69.51、54.91、33.09 mm,均显著小于对照组(p<0.05)。
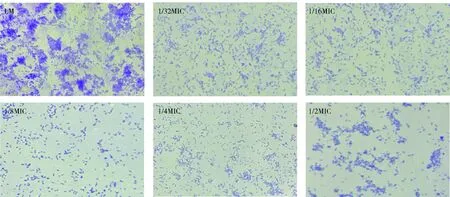
图4 显微镜下观察Y42上清对LM生物膜生物量的影响Fig.4 Effects of L. plantarum-Y42 fermentation supernatant on biofilm biomass of LM under microscope

图5 Y42上清对LM爬行运动性的影响Fig.5 Effects of L. plantarum-Y42 fermentation supernatant on swarming motility of LM
LM有4根周毛和1根端毛,对于LM来说,鞭毛并不是一个黏附器官,而是其重要的运动器官。菌体可依赖鞭毛朝向有高浓度营养物质的方向移动,而避开对其有害的环境,而且研究表明,LM的初始黏附、生物膜形成、入侵宿主及抗生素敏感性与LM的爬行运动性有关[18-19]。已有研究证明在LM生物膜形成的初始阶段,鞭毛的物理吸附十分重要。研究发现,细菌的鞭毛、纤毛、菌毛能够起到稳定基质的作用[20],对生物膜的形成起着重要的促进或抑制作用[21]。Gowrishankar等[22]研究海洋源环状二肽对LM生物膜形成和毒力的抑制作用,发现环状二肽作用于LM抑制其运动性后,LM黏附性降低,生物膜形成受到了抑制。此外,突变研究发现鞭毛减少和鞭毛瘫痪的突变体在LM的表面初始黏附和生物膜形成过程中具有类似的缺陷,表明鞭毛介导的运动性在LM生物膜形成过程中具有重要作用[23]。
研究发现,植物乳杆菌Y42无细胞培养上清液能够显著抑制LM的爬行运动性,由此推测,LM爬行运动受抑制可能是其生物膜形成量减少的一个原因。
3 结 论
文章研究发现植物乳杆菌Y42无细胞培养上清液可抑制单增李斯特氏菌生长,而在低于Y42上清最小抑菌质量浓度条件下,可抑制单增李斯特氏菌的运动性及生物膜的形成。植物乳杆菌Y42无细胞培养上清液中何种物质抑制单增李斯特氏菌生物膜形成及其机理还有待进一步研究。
参考文献:
[1] 刘伟杰, 刘聪, 蒋继宏. 枯草芽孢杆菌形成生物被膜的研究进展[J]. 微生物学报,2014,54(9):977-983.
LIU W J, LIU C, JIANG J H. Research progress of bio-film formation byBacillussubtilis[J]. Acta Microbiologica Sinica, 2014, 54(9):977-983.
[2] 朱小花, 李燕杰, 杜冰, 等. 食品工业中生物被膜态与浮游态单核细胞增生性李斯特菌的危害及其控制[J]. 食品研究与开发,2010,31(10):212-216.
ZHU X H, LI Y J, DU B, et al. Hazards and control of planktonic and biofilm ofListeriamonocytogeneson the food industry[J]. Food Research and Development, 2010,31(10):212-216.
[3] O’TOOLE G, KAPLAN H B, KOLTER R. Biofilm formation as microbial development[J]. Annual Reviews in Microbiology, 2000, 54(1): 49-79.
[4] 张子平. 李斯特氏菌:一种适冷性食物中毒细菌[J]. 肉类工业, 2000(4): 34.
ZHANG Z P.Listeria: a cold food poisoning bacterium[J]. Meat Industry, 2000(4): 34.
[5] DUSSURGET O, PIZARRO-CERDA J, COSSART P. Molecular determinants ofListeriamonocytogenesvirulence[J].Annual Review Microbiology, 2004, 58(1): 587-610.
[6] KLINGER G, BEYENE J, SHAH P, et al. Do hyperoxaemia and hypocapnia add to the risk of brain injury after intrapartum asphyxia?[J]. Archives of Disease in Childhood-Fetal and Neonatal Edition, 2005, 90(1): 49-52.
[7] DI BONAVENTURA G, PICCOLOMINI R, PALUDI D, et al. Influence of temperature on biofilm formation byListeriamonocytogeneson various food-contact surfaces: relationship with motility and cell surface hydrophobicity[J]. Journal of Applied Microbiology, 2008, 104(6): 1552-1561.
[8] 柯春林, 方维焕. 单增李斯特菌生物膜及其形成机制的研究进展[J]. 中国微生态学杂志, 2011, 23(6): 574-576.
KE C L,FANG W H. Research on the biofilm and its mechanism ofListeriamonocytogenes[J].Chinese Journal of Microecology, 2011, 23(6): 574-576.
[9] RENDUELES O, GHIGO J M. Multi-species biofilms: how to avoid unfriendly neighbors[J]. FEMS Microbiology Reviews, 2012, 36(5): 972-989.
[10] WAYNE P A. Performance standards for antimicrobial susceptibility testing[S]. Clinical and Laboratory Standards Institute, 2007:17.
[11] MELO T A, DOS SANTOS T F, DE ALMEIDA M E, et al. Inhibition ofStaphylococcusaureusbiofilm byLactobacillusisolated from fine cocoa[J]. BMC Microbiology, 2016, 16(1): 250.
[12] GOWRISHANKAR S, POORNIMA B, PANDIAN S K. Inhibitory efficacy of cyclo (l-leucyl-l-prolyl) from mangrove rhizosphere bacterium-Bacillusamyloliquefaciens(MMS-50) toward cariogenic properties ofStreptococcusmutans[J]. Research in Microbiology, 2014, 165(4): 278-289.
[14] 回丽媛, 李军, 朱明星, 等. 抗菌肽17BIPHE2对金黄色葡萄球菌生物被膜的抑制作用[J]. 微生物学通报, 2017, 44(4): 872-880.
HUI L Y, LI J, ZHU M X, et al.Inhibition ofStaphylococcusaureusbiofilm by antimicrobial peptide 17BIPHE2[J].Microbiology China, 2017, 44(4): 872-880.
[15] LI A Y J, LIN H H, KUO C Y, et al. High-mobility group A2 protein modulates hTERT transcription to promote tumorigenesis[J]. Molecular and Cellular Biology, 2011, 31(13): 2605-2617.
[16] CAMARGO A C, DE PAULA O A L, TODOROV S D, et al.Invitroevaluation of bacteriocins activity againstListeriamonocytogenesbiofilm formation[J]. Applied Biochemistry and Biotechnology, 2016, 178(6): 1239-1251.
[17] WINKELSTRÖTER L K, TULINI F L, DE MARTINIS E C P. Identification of the bacteriocin produced by cheese isolateLactobacillusparaplantarumFT259 and its potential influence onListeriamonocytogenesbiofilm formation[J]. LWT-Food Science and Technology, 2015, 64(2): 586-592.
[18] BIGOT A, PAGNIEZ H, BOTTON E, et al. Role of FliF and FliI ofListeriamonocytogenesin flagellar assembly and pathogenicity[J]. Infection and Immunity, 2005, 73(9): 5530-5539.
[19] O’NEIL H S, MARQUIS H.Listeriamonocytogenesflagella are used for motility, not as adhesins, to increase host cell invasion[J]. Infection and Immunity, 2006, 74(12): 6675-6681.
[20] ZOGAJ X, NIMTZ M, ROHDE M, et al. The multicellular morphotypes ofSalmonellatyphimuriumandEscherichiacoliproduce cellulose as the second component of the extracellular matrix[J]. Molecular Microbiology, 2001, 39(6): 1452-1463.
[21] 李彤, 庄辉. 细菌生物膜的研究进展[J]. 中华微生物学和免疫学杂志, 2002, 22(3): 343-346.
LI T,ZHUANG H.Research progress of biofilm formation[J].Chinese Journal of Microbiology and Immunology,2002, 22(3): 343-346.
[22] GOWRISHANKAR S, SIVARANJANI M, KAMALADEVI A, et al. Cyclic dipeptide cyclo (l-leucyl-l-prolyl) from marineBacillusamyloliquefaciensmitigates biofilm formation and virulence inListeriamonocytogenes[J]. Pathogens and Disease, 2016, 74(4):1-12.
[23] ZHANG T, BAE D, WANG C.ListeriamonocytogenesDNA glycosylase AdlP affects flagellar motility, biofilm formation, virulence, and stress responses[J]. Applied and Environmental Microbiology, 2016, 82(17): 5144-5152.
