一株嗜热链球菌乳糖酶的分离纯化及酶学特性研究
2018-04-17曹永强余志坚杨贞耐
曹永强, 余志坚, 陈 超, 张 健, 杨贞耐,*
(1.北京工商大学 北京食品营养与人类健康高精尖创新中心/食品质量与安全北京实验室, 北京 100048; 2.东君乳业(禹城)有限公司, 山东 德州 253000)
乳糖酶又称β-半乳糖苷酶或β-D-半乳糖苷半乳糖水解酶。乳糖酶可水解乳糖生成人体易于消化吸收的单糖即α-D-葡萄糖和β-D-半乳糖,还可促进半乳糖与乳糖连接生成低聚半乳糖,在乳品工业生产中具有重要的应用价值[1]。
当前,微生物来源的乳糖酶应用广泛,具有酶源丰富、产量高、生产成本低、周期短等特点,备受生产企业关注。食品添加剂联合专家委员会(JACFA)和美国食品药品管理局(FDA)认定乳糖酶为安全酶,我国食品添加剂使用卫生标准 GB2760 中也将乳糖酶列为其中[2]。
乳糖酶一般存在于植物、哺乳动物的肠道中,某些微生物也会产乳糖酶。当前,只有微生物来源的乳糖酶具有工业应用价值[3-4]。工业生产中常用产乳糖酶菌种来源主要有酵母、霉菌和嗜热菌[5]。嗜热菌产乳糖酶方式为胞外分泌表达,在 95~110 ℃时具有较好的热稳定性[6],其最适酶活性温度为 105 ℃,主要用于缩短工艺流程时间,减少工艺步骤。嗜热链球菌是一种原核微生物,链球菌属[7],它常与保加利亚乳杆菌共同用于酸奶生产,二者之间由于存在共生作用,可以大大减少工业流程所需时间[8]。研究食源性嗜热链球菌产乳糖酶,一方面可以保证乳糖酶的安全性,另一方面,可提高菌株的工业使用价值。
不同来源的微生物 β-半乳糖苷酶的酶学性质有很大差异,其生产和纯化工艺是影响酶广泛应用的关键步骤[9]。因此,研究可批量工业化应用的产乳糖酶微生物、乳糖酶高产菌和低成本的纯化方法具有重要意义。对乳糖酶酶学特性的研究,也可为乳糖酶生产应用提供切实可行的理论依据。
1 材料与方法
1.1 菌种与试剂
嗜热链球菌GST-6菌株(st.GST-6),现保存于本课题组实验室;邻硝基苯-β-D 半乳糖苷(2-NitropHenyl-beta-D-galactopyranoside-ONPG)、邻硝基苯酚(2-NitropHenol-ONP)、碳酸钠、氯化钠、十二水合磷酸氢二钠、两水合磷酸二氢钠,均为分析纯,国药集团化学试剂有限公司;M17液体培养基(1 L)有大豆蛋白胨(3.3 g)、酪蛋白胨(3.3 g)、鱼蛋白胨(3.3 g)、酵母浸粉(2.5 g)、牛肉膏(5 g)、吐温80(500 μL)、葡萄糖(5 g)、乳糖(5 g)、七水硫酸镁(0.2 g)、抗坏血酸钠(1.5 g)、β-甘油磷酸二钠(12 g);磷酸盐缓冲液的配方,参考GB/T 8276—1999。
1.2 实验仪器
CR21GⅢ型立式高速冷冻离心机,日本HITACHI公司;MLS-3750型高压蒸汽灭菌器,日本三洋公司;U3900型紫外分光光度计,日本HITACHI公司;S20数显pH计,梅特利-托利多仪器有限公司;THZ-D型电热恒温培养箱,上海一恒仪器科技有限公司。
1.3 实验方法
1.3.1粗酶液制备
菌种活化接种M17培养基中,42 ℃恒温培养8 h。取5 mL发酵液,在4 ℃以10 000 r/min离心10 min,收集菌体。用1 mL磷酸盐缓冲液冲洗2次,再加入4 mL磷酸盐缓冲液,悬浮后加入0.5 mL已经预热到37 ℃的溶菌酶(10 mg/mL),涡旋混匀后,37 ℃水浴保持10 min,加入0.5 mL的氯化钠溶液(4 mol/L),静置50 min[10]。
1.3.2乳糖酶活力的测定
1.3.2.1 ONP的标准曲线
6支100 mL容量瓶中分别加入0.0、3.0、6.0、9.0、12.0、15.0 mL的ONP(0.01 mol/L)溶液,去离子水定容至100 mL,分别加入25 mL的碳酸钠溶液,混匀后用磷酸盐缓冲液定容。紫外分光光度计测定每组在420 nm处的吸光值。以ONP浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
1.3.2.2 酶活力测定方法
取1 mL酶液,37 ℃水浴5 min,快速加入5 mL预热到37 ℃的ONPG溶液,晃动混匀,37 ℃反应10 min,后加入2 mL的碳酸钠终止反应,冷却后于420 nm下测定吸光值[11]。空白组:在添加ONPG前先加入2 mL碳酸钠溶液。
1.3.3单因素实验测定影响乳糖酶产量因素
对影响嗜热链球菌产乳糖酶的9个因素(包括培养基的碳源及其浓度、氮源及其浓度、接种量、发酵温度、发酵时间、培养基初始pH值、金属离子)分别进行研究。以产乳糖酶活力为指标,以M17培养基为基础培养基,将M17培养基中的碳源(葡萄糖)分别以等量的葡萄糖、乳糖、麦芽糖和蔗糖替换;选取乳糖质量浓度分别为5、10、15、20、25 g/L;将M17培养基中的氮源(大豆蛋白胨)分别以等量的大豆蛋白胨、鱼蛋白胨和酪蛋白胨替换;选取大豆蛋白胨质量浓度分别为5、10、15、20、25 g/L;选取接种量分别为1%、2%、3%、4%、5%(其他发酵条件为发酵温度42 ℃、发酵时间8 h、pH值为7);选取发酵温度分别为37、39、42、45、55 ℃(其他发酵条件为接种量1%、发酵时间8 h、pH值为7);选取发酵时间分别为6、8、10、12、16 h(其他发酵条件为接种量1%、发酵温度42 ℃、pH值为7);选取培养基初始pH值分别为3、4、5、6、7、8(其他发酵条件为接种量1%、发酵温度42 ℃、发酵时间8 h);将M17培养基中的金属离子(七水硫酸镁)分别以等量的磷酸二氢钾、一水合硫酸锰、氯化钙和七水合硫酸亚铁替换。
1.3.4响应面试验设计
结合单因素实验,以培养基初始pH值、接种量、乳糖浓度为自变量,以乳糖酶活力为响应值,根据响应面优化分析原理(Box-Behnken, BBD),通过Design-Expert软件设计响应面实验,研究st.GST-6产乳糖酶的最佳发酵条件[12]。
1.3.5乳糖酶的制备及提纯
1.3.5.1 硫酸铵分级沉淀
粗酶液经超声破碎,在4 ℃以10 000 r/min离心10 min,取上清液平分成9份,量其体积,计算硫酸铵在10%~90%饱和度下的质量。称取不同质量的硫酸铵,涡旋搅拌缓慢加入,搅拌20 min后于4 ℃静置4 h。沉淀后,在4 ℃以10 000 r/min离心10 min,取上清液测定酶活力,空白组只添加磷酸盐缓冲液。
1.3.5.2 硫酸铵沉淀
由分级沉淀可得纯化乳糖酶的最佳硫酸铵饱和度范围。先取粗酶液量其体积,计算并称取该体积范围内上限和下限饱和度对应的硫酸铵质量。缓慢加入范围下限质量的硫酸铵于酶液中,搅拌20 min后于4 ℃静置2 h。在4 ℃以10 000 r/min离心10 min,取上清液,缓慢加入范围上限质量的硫酸铵,搅拌20 min后于4 ℃静置2 h。在4 ℃以10 000 r/min离心10 min,弃上清,用20 mL磷酸盐缓冲溶液溶解沉淀,于4 ℃保存[13-14]。
1.3.5.3 DEAE-SepHarose Fast Flow离子交换柱
冷冻干燥后的酶粉末,配制成0.5 mg/mL的溶液。使用DEAE-SepHarose Fast Flow离子交换柱(2.6 cm×30 cm)对粗酶液进行纯化,上样量为10 mL,流速为1.5 mL/min,溶剂为pH值为7的磷酸盐缓冲液。先用缓冲液洗脱50 min,然后用分别含有0.1、0.5、0.9 mol的NaCl的磷酸盐缓冲液梯度洗脱。收集峰值附近的洗脱液,透析后冷冻干燥[5]。
1.3.5.4 SepHadex G75纯化乳糖酶
将1.3.5.3中得到的酶粉末配制成0.5 mg/mL的溶液,经SepHadex G75柱子(2.6 cm×60 cm)对酶液进行纯化。上样量为10 mL,流速为1.5 mL/min,溶剂为0.09 mol/L的磷酸盐缓冲液,收集峰值附近的蛋白冷冻干燥[15]。
1.3.6酶学特性研究
1.3.6.1 温度对乳糖酶活性及稳定性的影响[16]
取5支试管,分别加入质量分数为1%的纯酶液1 mL,45 ℃保温10 min,30、40、50、60、70 ℃预热10 min后,测定相对酶活。
取5支试管,分别加入质量分数为1%的纯酶液1 mL,分别在25、35、45、55、65 ℃下保温,2 h后测定相对酶活。
1.3.6.2 pH值对乳糖酶活性及稳定性的影响
取5支试管分别加入质量分数为1%的纯酶液1 mL,用pH值分别为3、4、5、6、7、8的磷酸盐缓冲液配制ONPG溶液,测定相对酶活。
1.3.6.3 金属离子对酶活性的影响
取质量分数为1%的纯酶液1 mL,分别加入浓度为1、5、10 mmol/L的硫酸锰、氯化钙、硫酸镁、硫酸铜、氯化锌和硫酸亚铁溶液中,室温保存30 min,测定酶活。
1.3.6.4 抑制剂对酶活性的影响
1.3.6.5 底物浓度对酶活性的影响
分别配制浓度为0.5、1.0、1.5、2.0、2.5、3 mmol/L ONPG 溶液,取1 mL酶液,测定相对酶活。
1.4 实验统计
实验数据采用三平行实验取平均值,通过SPSS 19.0数据分析软件处理方差,当p<0.05时差异显著,当p>0.05时,差异不显著。
2 结果与分析
2.1 ONP标准曲线
ONP标准曲线如图1,其中y=0.018x-0.0836,R2=0.006 2。

图1 ONP标准曲线Fig.1 Standard curves of ONP
2.2 单因素实验测定影响乳糖酶产量因素
2.2.1不同碳源对菌株产酶的影响
不同碳源时菌株产乳糖酶的活性如图2。从图2可以看出,5种不同碳源的培养基中st.GST-6产乳糖酶活性存在显著性差异。其中乳糖对菌株产酶的促进作用最大,其活性为88.9 U/mL。原始配方中乳糖和葡萄糖共同为碳源的作用次之,故乳糖参与时会促进菌株产酶。

图2 碳源种类对产酶的影响Fig.2 Effects of carbon sources on lactase production
2.2.2不同乳糖浓度对菌株产酶的影响
选取菌株产乳糖酶的重要碳源即乳糖作为研究对象,不同乳糖浓度时菌株产乳糖酶的总活性如图3。从图3中可以看出,当乳糖质量浓度为15 g/mL时,对菌株产乳糖酶的促进作用最大,酶活性为95.76 U/mL。高于或者低于这个浓度区间,对菌株产酶的促进作用会降低,故乳糖质量浓度为15 g/mL时为最适乳糖浓度。不同浓度时菌株产乳糖酶差异大,故乳糖浓度为影响产酶的主要因素。

图3 乳糖质量浓度对菌株产酶的影响Fig.3 Effects of lactose concentration on lactase production
2.2.3不同氮源对菌株产酶的影响
So L3=950×I5+475+475-200=950×I5+750,L4=A2-200-200-(950×I5+750)=A2-950×I5-1 150
不同氮源时菌株产酶的总活性如图4。从图4可以看出,不同的蛋白对菌株产酶的影响存在显著差异,其中大豆蛋白胨对菌株产酶的促进作用较强。在大豆蛋白胨作为氮源时,菌株产乳糖酶活性为71.3 U/mL,较原始配方中3种蛋白组合时,st.GST-6产乳糖酶的量有所提高。

图4 氮源对菌株产酶的影响Fig.4 Effects of nitrogen sources on lactase production
2.2.4不同大豆蛋白胨浓度对菌株产酶的影响
氮源浓度可影响菌株产酶量,不同大豆蛋白胨浓度时菌株产酶的总活性如图5。从图5中可以看出,随着大豆蛋白胨浓度增高,菌株产乳糖酶的活性呈现先增后降低的趋势,当大豆蛋白胨质量浓度为20 g/L时,酶活性达到最高值,为84.2 U/mL。
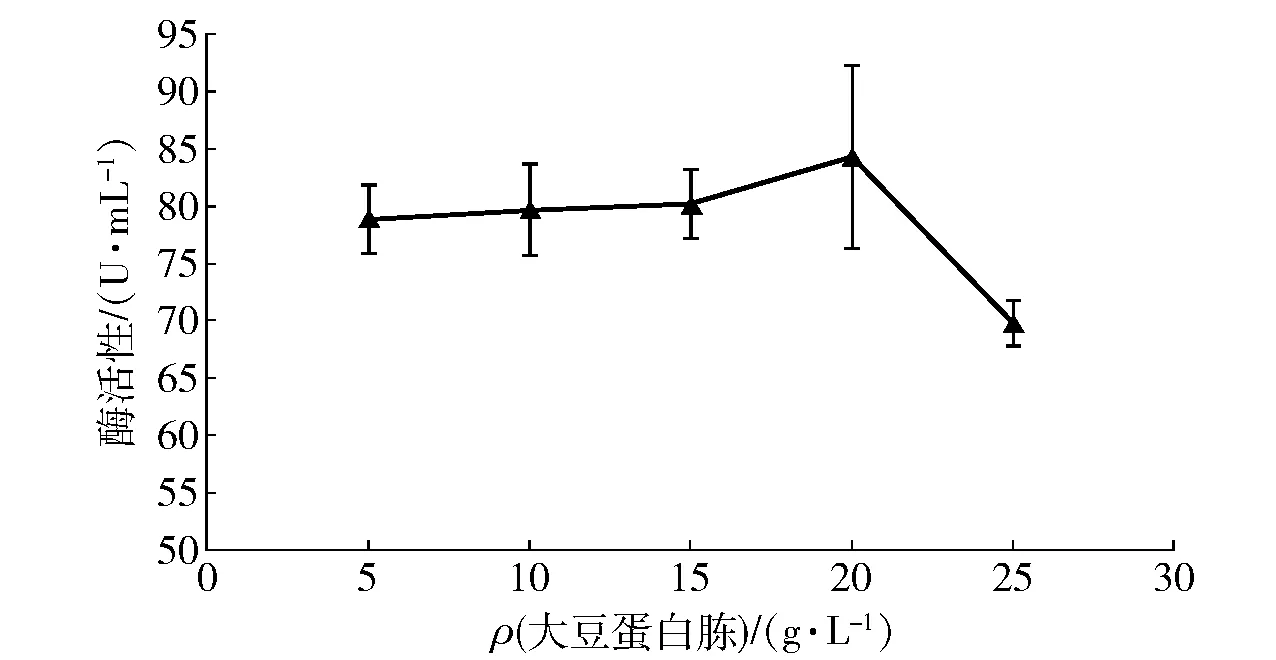
图5 大豆蛋白胨质量浓度对菌株产酶的影响Fig.5 Effects of soy peptone concentrations on lactase production
2.2.5不同金属离子对菌株产酶的影响
不同金属离子对菌株产酶总活性的影响如图6。从图6中可以看出,不同金属离子对菌株产酶的影响存在显著性差异。钙离子可显著促进st.GST-6产乳糖酶,乳糖酶活性为42.9 U/mL。七水和硫酸亚铁对菌株产乳糖酶的作用次之,选择钙离子为最佳金属离子。

图6 金属离子对菌株产乳糖酶的影响Fig.6 Effects of various metal ions concentrations on lactase production
2.2.6温度对菌株产酶的影响
不同温度时菌株产酶的总活性如图7。从图7可以看出,不同温度对菌株产酶存在显著性差异,发酵温度为39 ℃时,菌株产乳糖酶活性高于其他温度,此时酶的最大活力达到70.8 U/mL。而随着温度的升高,菌株产酶的总活性下降,当温度升高到55 ℃时,其他条件相同情况下,菌株产的乳糖酶活性仅为26.9 U/mL。

图7 温度对菌株产酶的影响Fig.7 Effects of temperatures on lactase production
2.2.7培养基初始pH值对菌株产酶的影响
培养基初始pH值对菌株产酶总活性的影响如图8。从图8中可以看出,不同培养基初始值pH的酶活性存在显著差异。当培养基初始pH值在6~7时,酶活性最高,在培养基初始pH值为7时,达到67.9 U/mL;培养基初始pH值在4附近时,菌株产乳糖酶受到抑制;培养基初始pH值高于7时,菌株产酶活性随培养基初始pH值的升高而降低。不同pH值时菌株产乳糖酶差异大,故培养基初始pH值为影响产酶的主要因素。
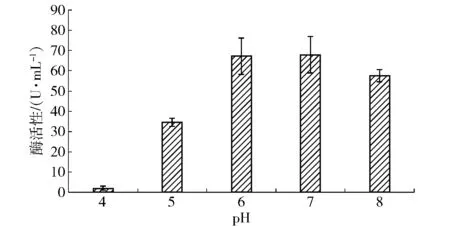
图8 培养基初始pH值对菌株产酶的影响Fig.8 Effects of initial pH values on lactase production
2.2.8不同发酵时间对菌株产酶的影响

图9 发酵时间对菌株产酶的影响Fig.9 Effects of fermentation time on lactase production
不同发酵时间菌株产酶的总活性如图9。从图9可以看出,当培养到6 h时,发酵液已经产生大量酶,发酵8 h时,酶活力达到最高值,为75.3 U/mL。继续培养更长时间时,酶活性降低。故较适发酵时间为8 h。
2.2.9不同接种量对菌株产酶的影响
不同接种量时菌株产酶的总活性如图10。从图10可以看出,接种量对产总酶活性的影响存在显著性差异,当接种量为2%时,酶的活性最高,为79.1 U/mL;当接种量高于2%时,酶活会随接种量增高而降低;接种量低于2%时,酶活性降低。不同接种量时菌株产乳糖酶差异大,故接种量为影响产酶的主要因素。
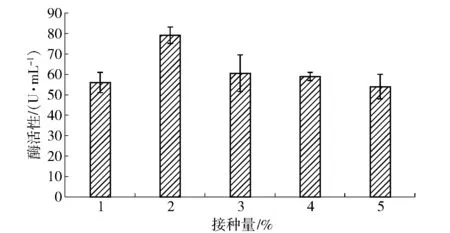
图10 接种量对菌株产酶的影响Fig.10 Effects of inoculation on lactase production
2.3 响应面试验设计优化产酶条件
2.3.1模型与显著性分析
通过对单因素实验分析可知,影响st.GST-6产乳糖酶最主要的因素为:pH值、接种量、乳糖浓度。以培养基初始pH值、接种量、乳糖浓度为自变量,以乳糖酶总活性为响应值,通过Design-Expert响应面设计软件设计17组实验,如表1。通过分析,其对应关系见式(1)。
Y=81.95+10.15×A+18.93×B-5.29×C-
7.97×A×B-10.12×A×C+14.86×B×C+
2.30×A2-17.73×B2+2.60×C2。
(1)
2.3.2响应面图分析
图11、图12、图13为通过Design-Expert软件得到的响应面图。图11表示当接种量固定为0,乳糖浓度和培养基初始pH值对酶活影响。由图11可以看出随着乳糖浓度和pH值的增加,酶活呈现先增加后减小的趋势,培养基初始pH值和乳糖浓度之间存在交互作用。图12表示当培养基初始pH值固定为0,乳糖浓度和接种量对酶活的影响,随着乳糖浓度和接种量的增加,酶活呈现先减小后增加的趋势。图13表示当乳糖浓度固定为0时,培养基初始pH值和接种量对酶活的影响,随着培养基初始pH值和接种量的增加,酶活先增加后减小。由图11~图13的立体模型可以看出,乳糖酶活Y存在最大值,最大值表示乳糖浓度、pH值、接种量影响乳糖酶活的最佳配比。通过Design-Expert软件拟合计算出最适条件为乳糖质量浓度为25.00 g/L,培养基初始pH值为6.78,接种量为1%时,菌株产酶活性最大,为112.63 U/mL。验证实验结果表明,在此优选条件下,总酶活为109.3 U/mL。

表1 Box-Behnken设计方案及响应值结果
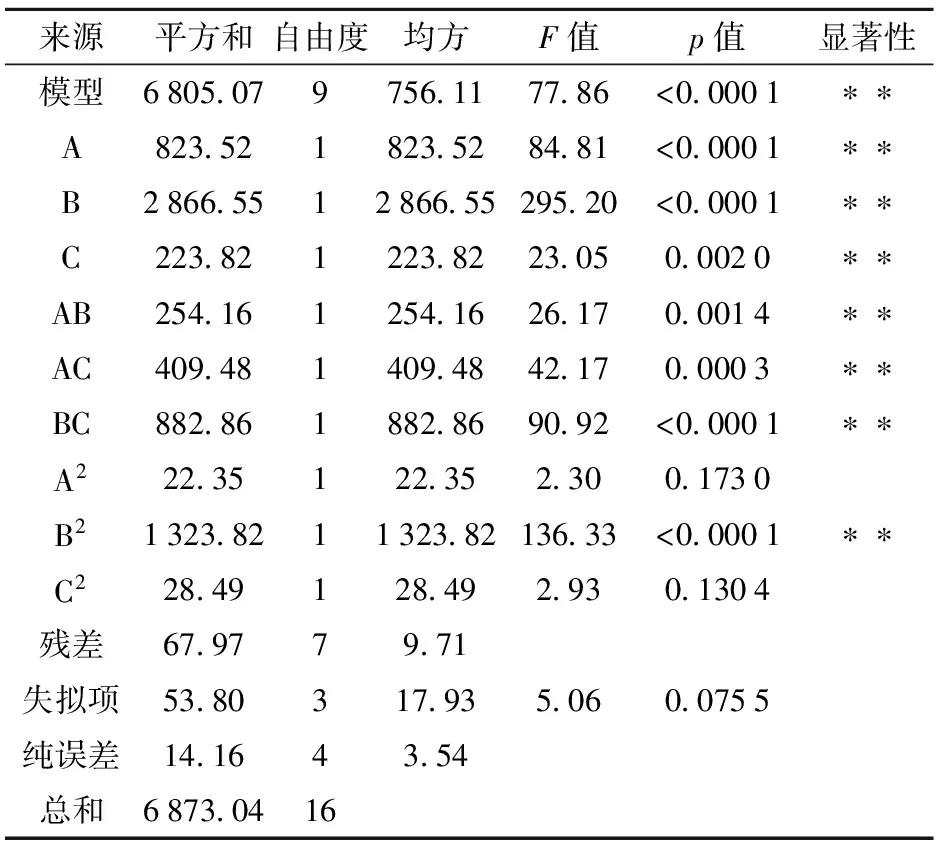
表2 回归方程的方差分析ANAOV
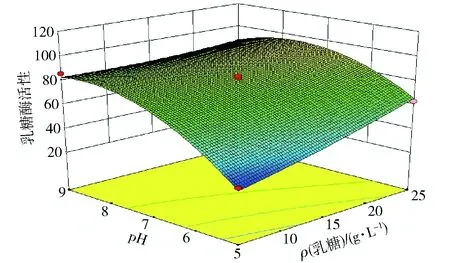
图11 培养基初始pH值和乳糖浓度对乳糖酶活性影响响应面图Fig.11 Response surface and contour plots for effects of initial pH values and lactose concentrations on lactase production

图12 接种量和乳糖浓度对乳糖酶活性影响响应面图Fig.12 Response surface and contour plots for effects of inoculation and lactose concentrations on lactase production

图13 培养基初始pH值和接种量对乳糖酶活性影响响应面图Fig.13 Response surface and contour plots for effects of initialpH values and inoculation on lactase production
2.4 乳糖酶的分离及提纯
2.4.1硫酸铵分级沉淀
不同饱和度的硫酸铵对乳糖酶沉淀的影响如图14。从图14可以看出,当硫酸铵饱和度小于40%时,酶活性随饱和度下降的趋势显著,此时粗酶液只有少许沉淀;当硫酸钠饱和度在40%~50%时,酶活性急速下降,表明此时的乳糖酶均与硫酸铵结合而沉淀;当饱和度大于50%时,酶活变化变缓,表明大量乳糖酶被结合沉淀下来。综上,硫酸铵纯化乳糖酶的饱和度范围为10%~50%。

图14 硫酸铵沉淀上清液中乳糖酶酶活力变化曲线Fig.14 Enzyme activity in supernatant after various (NH4)2SO4 saturation precipitation
2.4.2DEAE-SepHarose Fast Flow纯化结果
使用DEAE-SepHarose Fast Flow离子交换柱纯化乳糖酶的结果如图15,纯化过程出现4个峰。收集每个峰检测酶活性发现峰3具有乳糖酶活性,而其他峰的酶活性显著低于峰3,收集峰3进行透析冷冻干燥。

图15 DEAE-SepHarose Fast Flow离子交换柱洗脱峰Fig.15 Chromatogram of lactase by DEAE-SepHarose Fast Flow
2.4.3SepHadex G75纯化结果分析
使用SepHadex G75层析柱纯化乳糖酶的结果如图16,纯化过程出现1个峰。收集峰附近洗脱液可检测酶活性,透析冷冻干燥后得到较纯的乳糖酶。

图16 SepHadex G75柱洗脱峰Fig.16 Chromatogram of lactase by SepHadex G75
2.4.4不同温度对乳糖酶活性的影响
不同温度对乳糖酶的活性有很大影响(见图17)。由图17(a)可以看出,酶活性随温度上升而增高,当温度达到70 ℃时,酶具有最大活力,表明st.GST-6产乳糖酶在高温下仍具有很高的活力。乳糖酶在不同温度的热稳定性如图17(b),酶的热稳定性随温度升高而降低,其中在30~40 ℃时酶的活性最大,保留了70%的活性,在50~60 ℃酶热稳定性下降趋势加快。故st.GST-6产乳糖酶具有耐高温的能力,但是持续时间较短,在应用过程中需要注意保温时间。

图17 温度对乳糖酶活性的影响Fig.17 Effects of temperatures on enzyme activity
2.4.5pH值对乳糖酶活性的影响
pH值对乳糖酶活性的影响如图18。pH值为3~4时,酶的活性较低;在5~6时,酶的活性很高,并保留了80%以上的活性;当pH值高于6时,酶的活性又逐渐降低。说明pH值过高或者过低都会降低酶的活性,st.GST-6产乳糖酶的最适pH值为6。

图18 pH值对乳糖酶活性的影响Fig.18 Effects of pH values on enzyme activity
2.4.6不同浓度金属离子对乳糖酶活性的影响
金属离子对酶活性的影响主要为激活作用和抑制作用,不同浓度金属离子对乳糖酶活性影响如图19。锰离子、镁离子和亚铁离子均对酶起到激活作用,并且随浓度升高,激活作用也增强;钙离子、铜离子、锌离子对酶起到抑制作用,并且基本上随浓度升高,抑制作用减弱。其中,锰离子的激活作用最强,铜离子的抑制作用最强。

图19 金属离子浓度对乳糖酶活性的影响Fig.19 Effects of various metal ions on enzyme activity

图20 抑制剂对乳糖酶活性的影响Fig.20 Effects of inhibitors on enzyme activity
2.4.7不同抑制剂对乳糖酶活性的影响
不同抑制剂对乳糖酶活性影响如图20。EDTA对酶活性几乎没有抑制作用,α乳糖对乳糖酶有一定的抑制作用,而SDS对乳糖酶的活性有较强的抑制作用。
2.4.8乳糖酶的动力学性质
底物浓度的倒数与酶活的倒数关系如图21。利用双倒数法求米氏常数,直线在X轴的截距为-1/K,在Y轴的截距为1/Vmax,由方程可得,最大速度Vmax=2.20 μmol/min,Km=0.27 mmol/L。

图21 底物浓度倒数与酶活性倒数关系Fig.21 Lineweaver-Burk plot of lactase using ONPG as substrate
3 结 论
培养基中提供微生物生长所需的营养要素对其产酶具有重要影响。碳源能提供微生物生长所需的能量,同时某些碳源还是酶的诱导物,碳源种类会影响乳糖酶的产量[17]。st.GST-6产乳糖酶的最适碳源为乳糖,这可能因为乳糖酶是一种胞内酶,它的合成需要诱导物质来完成。乳糖浓度的高低影响到乳糖酶的产量,乳糖浓度超过最适浓度时,由于打破了适合微生物生长的C/N,菌株生长缓慢,乳糖酶的产生受到抑制,导致酶产量下降[18-19]。氮源作为构成生物体的蛋白质、核酸及其他氮素化合物的材料,大豆蛋白胨的添加量会影响乳糖酶的产量,这可能是大豆蛋白胨容易被st.GST-6利用导致的。金属离子种类能影响乳糖酶的产量,钙离子可促进菌株产酶,与钙离子对乳糖酶合成途径相关酶的激活作用有关[20]。发酵温度会影响酶促反应的速率,在最佳温度下,菌株产酶的反应处于最佳条件,当温度更高时,酶失去活性发生不可逆反应,导致产乳糖酶活性降低[21]。培养基初始pH值在产酶过程中会不断变化[22],本研究对培养基初始pH值的研究表明其对菌株产酶也有较大影响。
利用硫酸铵分级沉淀,当其饱和度为10%时可除去粗酶液中的杂蛋白,进一步提高饱和度至50%时沉淀乳糖酶,可以获得更纯的酶。st.GST-6乳糖酶可耐受70 ℃温度,在高温下也能保证其活性,工业生产中可以在杀菌过程中添加,既保证了生产效率,又起到了分解乳糖的作用。随着pH值的升高,乳糖酶活力逐渐降低,这是因为过酸或过碱会影响酶活性中心结合基团和催化基团的解离状态,使得底物不能和酶结合[23]。SDS 对乳糖酶活性有较强的抑制作用,这是因为某些抑制剂的化学结构与底物相似,与底物竞争酶的活性中心并与之结合,从而减少了酶与底物结合的机会,使酶的反应速度降低。对乳糖酶酶学特性的研究,可以为实际生产中更有效地利用乳糖酶提供切实可行的理论依据。
参考文献:
[1] 张敏文, 顾取良, 张博,等. 乳糖酶研究进展[J]. 微生物学杂志, 2011, 31(3):81-86.
ZHANG Minwen, GU Quliang, ZHANG Bo, et al. Advancement in lactase study[J]. Journal of Microbiology, 2011, 31(3):81-86.
[2] 李红, 赵春燕. 乳酸链球菌素产生菌的筛选初报[J]. 中国酿造, 2006, 25(3):51-53.
LI Hong, ZHAO Chunyan. A primary report on the screening of nisin-producing strain [J]. China Brewing, 2006, 25(3):51-53.
[3] WAN V S, TOMAR S K, ALI B, et al. Production of β-galactosidase fromStreptococcusthermophilus, for galactooligosaccharides synthesis[J]. Journal of Food Science and Technology, 2015, 52(7):4206-4215.
[4] 王建芳, 陈芳, 靳亚平. 嗜热链球菌适宜培养条件研究[J]. 西北农业学报, 2008, 17(2):56-58.
WANG Jianfang, CHEN Fang, JIN Yanping. Research on appropriate culture condition ofS.thermophilus[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2008, 17(2):56-58.
[5] GEZGIN Y, TANYOLAC B, ELTEM R. Some characteristics and isolation of novel thermostable β-galactosidase fromThermusoshimai, DSM 12092[J]. Food Science & Biotechnology, 2013, 22(1):63-70.
[6] 管声, 梁琪, 宋雪梅,等. 牦牛乳乳糖酶解及其预热处理条件优化[J]. 食品与发酵工业, 2017, 43(1):118-123.
GUAN Sheng, LIANG Qi, SONG Xuemei, et al. Optimization of enzymatic hydrolysis of yak milk lactose and preheat treatment process[J].Food and Fermentation Industries, 2017, 43(1):118-123.
[7] 陈卫, 张灏, 丁霄霖. 一种高温乳糖酶的酶学性质及对牛乳中乳糖的水解[J].中国乳品工业, 2002, 30(6):15-18.
CHEN Wei, ZHANG Hao, DING Xiaolin. Study on properties of thermostable β-galactosidase and hydrolysis of lactose in milk [J]. China Dairy Industry, 2002, 30(6):15-18.
[8] 官雪芳, 郑怡, 徐庆贤,等. 一株酸奶发酵嗜热链球菌的选育研究[C]. 北京:中国食品科学技术学会,2016:97.
[9] 李文婷, 边斐, 王翠萍,等. 凝结芽孢杆菌RY237 β-半乳糖苷酶酶学性质研究[J]. 食品工业科技, 2017, 38(14):111-115.
LI Wenting, BIAN Fei, WANG Cuiping, et al. Characterization of β-galactosidase fromBacilluscoagulansRY237[J]. Science and Technology of Food Industry, 2017, 38(14):111-115.
[10] 赵春萍. 高产乳糖酶酵母菌筛选、培养基优化及酶的分离提纯[D]. 呼和浩特:内蒙古农业大学, 2014.
[11] 侯重文, 朱梓昂, 张秀华,等. 毕赤酵母工程菌产乳糖酶发酵条件优化的研究[J]. 食品与药品, 2016, 18(5):305-311.
HOU Chongwen, ZHU Ziang, ZHANG Xiuhua, et al. Optimization of fermentation conditions of lactase-producing pichiapastoris [J]. Food and Drug, 2016, 18(5):305-311.
[12] 崔庆新, 刘军海, 黄宝旭,等. 响应面分析法优化党参多糖提取工艺[J]. 药物分析杂志, 2011, 31(5):816-820.
CUI Qingxin, LIU Junhai, HUANG Baoxu, et al. A primary report on the screening of nisin-producing strain [J]. China Brewing, 2011, 31(5):816-820.
[13] HUSAIN Q. Beta galactosidases and their potential applications: a review [J]. Critical Reviews in Biotechnology, 2010, 30(1):41.
[14] 朱运平, 许丽亚, 范光森,等. 具有转糖苷活性β-半乳糖苷酶菌株的筛选鉴定[J]. 食品与生物技术学报, 2017, 36(6):598-603.
ZHU Yunping, XU Liya, FAN Guangsen, et al. Screening and identification of β-galactosidase-producing microorganism with transgalactosylation activity [J]. Journal of Food Science and Biotechnology, 2017, 36(6):598-603.
[15] WANG K, LI G, YU S Q, et al. A novel metagenome-derived β-galactosidase: gene cloning, overexpression, purification and characterization[J]. Applied Microbiology & Biotechnology, 2010, 88(1):155.
[16] 贾超. 米曲霉β-半乳糖苷酶的基因克隆与酶学特征分析[D]. 天津:天津科技大学, 2016.
[17] 董自星, 贾超, 王君, 等. 米曲霉β-半乳糖苷酶系的克隆表达与酶学特性分析[J]. 食品工业科技, 2016, 37(21):172-177.
DONG Zixing, JIA Chao, WANG Jun, et al. Cloning, expression and biochemical characterization of β-galactosidases fromAspergillusoryzae[J]. Science and Technology of Food Industry, 2016, 37(21):172-177.
[18] 付志军, 史玉东, 康小红,等. 乳糖酶在生产低乳糖奶中的应用研究[J]. 食品研究与开发, 2008, 24(8):48-52.
FU Zhijun, SHI Yudong, KANG Xiaohong, et al.Study on lactases in the production of low-lactose milk application[J].Food and Research and Development, 2008, 24(8):48-52.
[19] 黄新仁. 响应面法在生物过程优化中的应用[D]. 长沙:湖南大学, 2011.
[20] 何熹, 王彦宁, 李超,等. 乳酸菌与乳糖酶[J]. 食品研究与开发, 2016, 37(16):202-205.
HE Xi, WANG Yanning, LI Chao, et al.Lactobacillusand lactase[J]. Food Research and Development, 2016, 37(16):202-205.
[21] 姚跃飞, 曾柏全. 现代固态发酵技术在食品加工业中的应用[J]. 食品与机械, 2005, 21(6):89-92.
YAO Yuefei, ZENG Baiquan. Application of modern solid-state fermentation technology in food processing [J]. Food and Machinery, 2005, 21(6):89-92.
[22] 山琳. 米曲霉乳糖酶的发酵条件及酶学性质的研究[D]. 兰州:甘肃农业大学, 2014.
[23] 张莉, 李庆章, 田雷. β-半乳糖苷酶研究进展[J]. 东北农业大学学报, 2009, 40(7):128-131.
ZHANG Li, LI Qingzhang, TIAN Lei.Research advancement of β-galactosidase [J]. Journal of Northeast Agricultural University, 2009, 40(7):128-131.
