食品香料香精发展趋势
2018-04-17田红玉陈海涛孙宝国
田红玉, 陈海涛, 孙宝国
(北京工商大学 食品学院/北京市食品风味化学重点实验室, 北京 100048)
近些年食品安全问题受到空前关注,而在食品加工过程中起着非常关键作用的食品添加剂成为众矢之的。恐慌的消费者群体希望退回到食品制作的原始状态,即不使用添加剂,或者只接受全天然的食品添加剂的使用。鉴于广大消费者这种并非理性的心理需求,雀巢公司宣布于2015 年底之后在其巧克力类产品中不再使用任何的人工色素和香料[1]。作为国际食品行业巨头的雀巢公司的这一举措,无疑对整个食品添加剂行业的发展起到了非常重要的导向作用。作为食品添加剂家族重要成员的香料香精的发展当然也不例外,天然香料香精的需求呈不断上升的趋势。因此近年来在食品香料香精研究领域,安全和天然成为研究问题的核心,相关研究活动非常活跃[2]。本文就与天然香料香精发展的有关研究工作及发展趋势进行简要介绍。
1 利用生物转化制备天然香料
天然香料按照来源可以分为两大类,天然提取物和利用生物技术制备的香料。目前天然提取物仍然是天然香料香精市场的主要来源,包括各种植物精油以及食物加工废弃物的回收利用。但是面临全球人口不断增长和耕地面积日趋减少的压力,对于解决人类温饱问题的农作物的需求显然比香料作物更为迫切。从长远发展来看,寻找可替代香料作物的天然香料来源成为一种必然的趋势,而生物技术制备的香料被视为天然产品。此外,与传统的有机合成工艺相比,生物技术还具有反应条件温和、立体选择性好、环境污染小等优点,因此利用生物技术制备天然香料成为近二十年中香料领域最受关注的研究热点之一[3-4]。这里介绍利用生物转化制备一些重要香料品种的研究情况。
1.1 香兰素
香兰素是食品香料中应用最广的香料之一,是香荚兰豆提取物的主要香味成分,但含量很低,大约只有2%。香兰素和香荚兰豆提取物广泛用于巧克力、烘焙食品和冰淇淋中,全球销售额接近6亿美元,总量接近16 000 t[1]。由于天然提取物生产成本高,来源有限,所占市场份额不足1%。市场上的香兰素主要都是化学合成产品,合成路线主要以丁香酚、木质素或愈创木酚为起始原料。我国是香兰素的生产大国,采用愈创木酚/乙醛酸的方法来生产。合成香兰素市场价格稳定,每千克大约在16美元,而天然香荚兰豆提取物来源非常不稳定,价格通常大幅波动,2003年曾达到每千克400美元,2005年却跌至每千克32美元。如香兰素的含量按2%计算,即便在香荚兰豆丰收的年份,天然香兰素每千克的价格也要达到一千美元以上,与合成的香兰素价格有着天壤之别。鉴于天然香兰素严重的市场短缺,生物技术制备天然香兰素的研究非常活跃。
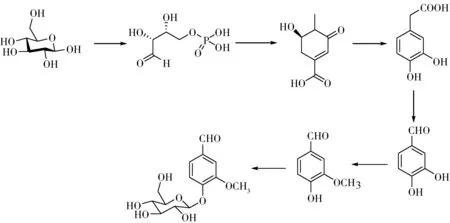
图2 IFF-Evolva公司开发的天然香兰素制备路线Fig.2 Synthetic route of natural vanillin developed by IFF-Evolva
文献报道的生物转化制备天然香兰素的前体物包括木质素、丁子香酚、阿魏酸、姜黄色素、安息香树脂,转化率通常低于30%,产量水平在1 g/L以下[5]。底物及产物对微生物细胞的毒性以及产物在反应体系中的降解是产率低下的主要原因。阿魏酸被认为是制备天然香兰素最有前景的底物,文献报道在10 L的反应器中,在Amycolatopsissp.[6]或Streptomycessetonii[7]菌株的作用下,香兰素的最终产率可分别高达11.5 g/L或13.9 g/L。第一个成功商业化的例子是Rhodia公司采用Givaudan公司的技术,于2000年由阿魏酸合成了商品名称为Rhovanil Natural 的天然香兰素[7]。尽管每千克售价700 美元,但相比香荚兰豆价格极高的2003 年,已经达到可以接受的水平。2015 年,Givaudan开发了一种全新的生物合成阿魏酸的工艺,可用做生产天然香兰素的原料[8]。该工艺以p-香豆酸为原料,经过羟基化和O-甲基化两步反应,咖啡酸为中间代谢产物。该工艺的开发具有非常重要的意义,因为在玉米芯、酒糟、米糠等废弃物中,p-香豆酸以很高的含量与阿魏酸同时存在。同年,BASF公司推出了改进的由阿魏酸制备香兰素的工艺,催化剂是通过基因工程改造过的Pseudomonas菌株[9]。法国Mane S. A.公司还曾在2014年推出了一条改进的以丁香酚为原料通过微生物转化生产香兰素的工艺,商标名称为Sense CaptureTM[10-11]。以丁香酚和阿魏酸为原料制备天然香兰素路线如图1。

图1 以丁香酚和阿魏酸为原料制备天然香兰素Fig.1 Preparation of natural vanillin starting from eugenol or ferulic acid
以葡萄糖为原料通过多步生物转化制备香兰素也是一条可行的途径。该方法最早是由美国密歇根大学的Frost教授于1998年报道的[12]。瑞士的Evolva 公司与International Flavors & Fragrances (IFF)公司以该报道为基础,成功开发了由葡萄糖生物合成香兰素的工艺(图2)。值得注意的是,由于香兰素对发酵过程中的微生物有毒,因此在反应体系中要将产物转化为香兰素糖苷,发酵完成后经水解得到香兰素。2014年,IFF已将该技术生产的天然香兰素用于产品中。
以辣椒素(N-(4-羟基-3-甲氧基-苄基)-8-甲基-trans-6-壬烯酰胺)为原料通过两步生物转化制备香兰素也是一条很有前景的途径[13]。天然的辣椒素来源丰富,其可在羧酸酯酶的作用下转化为香草基胺,然后在风味蛋白香草基醇氧化酶(VAO)的作用下生成香兰素(图3)。风味蛋白香草基醇氧化酶非常价廉易得,催化脱氨效率很高,不需要其他的辅助试剂,只需要在氧气存在条件下,即可完成转化。两步的酶催化反应可以在一锅煮式的反应器中完成。
图3 以辣椒素为原料生物转化制备香兰素Fig.3 Preparation of vanillin from capsaicin through biotransformation
虽然生物合成的天然香兰素已经有了少量的工业化生产,天然的香荚兰豆提取物仍是不可替代的。一些著名的国际香料公司如Symrise、Firmenich、Taksago、Givaudan在香荚兰的关键产地都有相应的项目,以保证香荚兰种植产业的可持续发展。
1.2 萜烯酮
香芹酮是一个非常重要的酮类香料,存在一对对映体,R构型为留兰香油的主要成分,S构型为葛缕子油的主要成分,两个构型具有明显不同的香气特征。市场上的香芹酮主要通过化学合成方法生产。以相应构型的柠檬烯为原料,与亚硝酰氯发生加成反应,然后经过消除、水解两步反应得到与原料构型相反的香芹酮。而以柠檬烯为原料,也可以通过生物转化方法制备香芹酮(图4)。柠檬烯在RhodococcusopacusPWD4菌株的作用下,可得到对映体纯的反式构型的香芹醇。该反应2.5 h产物即可达到最高浓度,产率可达94%~97%[14]。右旋的香芹醇在R.globerusPWD8菌株的作用下可以转化为右旋的香芹酮,而左旋的香芹醇在R.erythropolis菌株的作用下可以转化为左旋的产物[15-16]。即在由柠檬烯生物转化制备香芹酮的方法中,产物构型与原料是一致的,而传统化学合成路线则是得到相反构型的产物。该方法产率理想,具有很好的工业化应用前景。
图4 柠檬烯或香芹醇生物转化制备香芹酮Fig.4 Preparation of carvone from limonene or carveol through biotransformation
诺卡酮是葡萄柚最特征的香气成分之一,除用作食品香料外,还广泛用在日用香料、医药等领域。诺卡酮的最主要制备方法是以瓦伦亚烯为原料通过氧化反应制备。该氧化反应既可通过传统的有机氧化方法,也可以利用生物转化方法(图5)[17-18]。文献报道的最有效的生物氧化剂为担子菌Pleurotussapidus,其产量可以达到每天320 mg/L。该转化是一个两步反应的过程,瓦伦亚烯首先氧化生成α-和β-努特卡醇,β-努特卡醇在氧化酶的作用下进一步氧化生成诺卡酮,中间体α-努特卡醇则不能被进一步转化,最终产物中会有少量醇的中间体存在[19]。通过生物转化制备诺卡酮的方法已经由美国Allylix 公司实现工业化生产,该公司于2014年被瑞士Evolva公司收购。

图5 瓦伦亚烯氧化制备诺卡酮Fig.5 Preparation of nootkatone from valencene
1.3 醚类香料
降龙涎醚((-)-Ambrox)是龙涎香最为重要的香气成分,具有柔和、持久、稳定的动物型龙涎香香气、温和的木香香韵,是非常好的定香剂,在化妆品行业中应用广泛,同时降龙涎醚也是一种可以用于各种食用香精配方的食品香料。目前降龙涎醚的工业合成主要采用以香紫苏醇为原料的路线。香紫苏醇具有和降龙涎醚类似的碳原子骨架,首先经过氧化反应生成香紫苏内酯,再经还原、环化反应即可生成降龙涎醚。美国Avoca 公司是目前世界上最大的香紫苏醇和香紫苏内酯生产商。早先香紫苏醇采用高锰酸钾进行氧化生成香紫苏内酯,现在则用生物发酵的方法[20-21]。
香紫苏醇是从香紫苏植物中提取得到的,将植物的花、叶经水蒸气蒸馏得到香紫苏油,再依次用烷烃和甲醇萃取分离即可得到香紫苏醇。无论香紫苏醇,还是香紫苏内酯,价格都很昂贵,并且供应量起伏较大。自从1988年香紫苏醇和香紫苏内酯市场发生严重短缺后,各大香料公司开始积极探寻其他可替代的路线。Firmenich 公司和美国Allylix 公司均开发出了以香叶基焦磷酸酯为原料通过生物合成的方法制备香紫苏醇的可行路线[22-24]。香叶基焦磷酸酯首先在焦磷酸赖百当烯二醇酯合酶(LDPP synthase)的作用下转化为赖百当烯二醇焦磷酸单酯,然后在香紫苏醇合酶(sclareolsynthase)的作用下生成香紫苏醇。所得到的香紫苏醇再通过上述路线转化为降龙涎醚。最近,日本KAO 公司和德国BASF 公司也分别开发了一条降龙涎香醚的半生物合成途径[25-26]。以化学合成的高金合欢醇为原料,在环化酶的催化作用下关环得到降龙涎醚产物。这些新的生物转化技术都有望在将来实现工业化利用(图6)。

图6 降龙涎醚的生物合成Fig.6 Biosynthesis of Ambrox

图7 芳樟醇氧化制备芳樟醇氧化物Fig.7 Preparation of linalool oxide by oxidation of linalool
芳樟醇氧化物是非常重要的醚类代表性香料,天然存在于水果、咖啡、啤酒花、薰衣草等食品和植物精油中,具有甜香、木香、花香和香柠檬样的香味,存在呋喃型和吡喃型两种结构。工业上芳樟醇氧化物的合成是以芳樟醇为起始原料,采用过氧酸氧化得到的,产物以呋喃型结构为主,而且为顺反构型的混合物。利用各种微生物也可以将芳樟醇通过生物转化为氧化物(图7)。Demyttenaere等[27]报道了在Aspergillusniger菌株(A.nigerDSM 821)的作用下,可将(S)-芳樟醇转化为氧化物,顺反式呋喃型产物分别达到30%和5%,吡喃型产物顺反式分别达到14%和1.5%。该菌株只能有效地将S构型的芳樟醇底物转化。文献报道生物转化产率最高的是Corynesporacassiicola(DSM 62485),以消旋的芳樟醇为底物,转化率可接近100%,产量水平每天可达到120 mg/L。该菌株是目前芳樟醇氧化物生物制备中最有效的催化剂[28]。
玫瑰醚也是一个重要的具有玫瑰香的醚类香料品种。玫瑰醚有两个顺反异构体,天然存在于玫瑰精油和香叶油,但含量很低。市场上的玫瑰醚以香茅醇为原料,通过氧化、还原、异构化后关环四步反应来制备。以单一构型的香茅醇为原料,得到顺反两个非对映体产物混合物,比例接近1∶1(图8)。Onken等[29]在研究担子菌Cystodermacarcharias催化香茅醇的反应中,发现得到少量的玫瑰醚,转化率很低,只有1.7%。这是首次在生物转化反应中发现玫瑰醚。随后Demyttenaere等[30]报道了在Aspergillussp.或Penicilliumsp.催化作用下,也可将香茅醇转化为玫瑰醚,但是转化率也非常低。有关玫瑰醚有工业应用价值的生物转化方法还有待进一步研究。

图8 香茅醇生物转化制备玫瑰醚Fig.8 Preparation of rose oxide from citronellol through biotransformation
1.4 γ-谷氨酰-缬氨酰-甘氨酸
近些年日本科学家提出了一种新的味觉概念,即“厚味”(kokumi),英文翻译为“heartiness”或“mouthfullness”[31]。这种“厚味”代表性的化合物为三肽分子γ-谷氨酰-缬氨酰-甘氨酸,其FEMA号为4709,该化合物能增强低脂花生酱的风味浓郁程度、余味和油腻感,还能起到增强食物甜味、咸味和鲜味的作用[32-33]。因其可改善脂肪缺乏导致的风味缺失,在低脂类食物中具有非常好的应用前景。该化合物的制备可以缬氨酰-甘氨酸为原料,利用γ-谷氨酰转移酶的突变体将谷氨酸分子中的谷氨酰基转移至底物分子,从而得到目标化合物(图9)[34]。

图9 γ-谷氨酰-缬氨酰-甘氨酸的生物制备Fig.9 Biosynthesis of γ-glutamyl-L-valyl-glycine
1.5 小结
尽管目前食品香料工业大量使用的香料化合物仍来自化学合成,但是天然香料的发展壮大已经成为必然的市场趋势。通过生物技术制备天然香料,与从植物中提取天然香料传统工艺相比,不会受到地理、气候、病虫害等因素的影响,在生产和供应过程中有更大的控制权。鉴于天然香料所表现出的巨大的市场潜力,一些国际香料公司在生物技术方面开展了大量的研究工作。2014年可以算是香料香精行业在可持续发展方向上的一个转折点,一些长期致力于生物技术研究的公司如Amyris和Evolva开始收到投资回报。很多香料公司还和在生物燃料制备方面经验丰富的公司积极开展合作,一些传统的香料产品如薄荷脑、沉香、藏红花油的生物制备方法正在探讨之中。尽管目前生物技术制备香料方面投资收益甚微,但可以预见的是其在满足市场对天然产物的需求方面必将发挥重要的作用。
2 液体类食物加工过程中风味物质的回收利用
液体类食物是我们日常食物非常重要的组成部分,如各种非醇类的果汁类饮料,葡萄酒、啤酒、苹果酒等醇类饮料,还有我们中国特色的白酒、酱油、醋等调味品。在液体类食物加工过程中,风味物质的组成通常会发生很大变化。这些变化可以分为两大类,一类属于化学变化,如因为加热产生的氧化反应或Maillard反应,可导致风味物质的损失或新的风味物质的形成;另一类属于物理变化,如在蒸馏浓缩过程中导致的挥发性风味物质减少。很显然这些变化对于液体类食物风味保持是非常不利的,而额外的调香物质的加入往往又是广大消费者不愿意接受的。正如目前在医疗过程中广受欢迎的自体输血一样,将液体类食物加工过程中易损失的风味物质在一定的阶段采用合适的手段回收后重新加入到最终的产品中,成为一种既绿色安全又保持了食品原有风味的有效途径。近些年关于液体类食物加工过程中的风味物质回收有很多的研究报道,主要有4类方法:蒸馏技术、膜蒸馏技术、超临界流体萃取技术以及吸附技术[35-36]。
2.1 蒸馏技术
传统蒸馏技术是风味物质回收中最常采用的一种技术,通常通过汽提的方式提取出大部分的挥发性成分,然后通过分馏将提取液浓缩至100~200倍后,再加回至最终的产品中[37-38]。该方法的主要缺陷是温度过高,会导致一些异味物质的生成,改变产品原有的风味,同时对一些营养物质也会造成破坏。针对传统蒸馏技术的缺陷,目前出现了很多改进的蒸馏技术手段。离心蒸馏是一种将蒸馏塔板进行改进的新技术,与传统板式蒸馏塔不同,其装有可旋转的锥形塔板。汽液在交替旋转的截短了的锥体表面逆流接触,比传统塔板的传质效率要高3~4倍。该技术具有操作温度低、停留时间短、气液混合效率高的特点,非常适合用于果汁和液体食物中风味物质的回收或除去不需要的挥发性成分。目前该技术已经成功用于葡萄酒和啤酒工业中挥发性风味成分的回收[39-41]。此外,利用空气-汽提(air-stripping)也可以避免传统汽提蒸馏技术的高温,最大程度地保留原有的风味物质[42]。空气-汽提通常在泡罩塔(bubble column)中进行。研究表明,该技术对果汁的风味物质回收非常有效,回收率可以高达98%[43]。
2.2 膜蒸馏技术
近些年膜蒸馏(membrane distillation, MD)和真空膜蒸馏(vacuum membrane distillation, VMD)技术在风味物质回收中的应用报道也非常多[44-46]。膜蒸馏(MD)是膜技术与蒸馏过程相结合的膜分离过程,其以疏水微孔膜为介质,在膜两侧蒸气压差的作用下,料液中挥发性组分以蒸气形式透过膜孔,从而实现分离的目的。与其他常用分离过程相比,膜蒸馏具有分离效率高,操作条件温和,对膜与原料液间相互作用及膜的机械性能要求不高等优点。真空膜蒸馏技术则具有操作温度和压力更低的特点,因压差大,透过率更高。在对葡萄酒风味物质的回收中,真空膜蒸馏技术得到的产物浓度要高5~6倍[47]。目前该技术的应用研究还包括啤酒、咖啡,以及各种果汁如梨汁、橙汁、黑加仑汁等液体类食物的风味物质回收[48-53]。
2.3 超临界流体萃取技术
超临界流体萃取利用处于温度高于临界温度、压力高于临界压力的热力学状态的流体作为萃取剂,从液体或固体中萃取出特定成分,以达到分离目的。其特点是萃取剂在常压和室温下为气体,萃取后易于分离; 在较低温度下操作,特别适合于热敏性的天然物质的分离; 并可调节压力、温度和引入夹带剂等措施调整超临界流体的溶解能力,提高萃取过程的选择性。超临界流体萃取已经在天然产物的提取中得到广泛应用,目前该技术在风味物质的回收方面也有了一些研究报道,如从含醇饮料中分离回收酯类化合物,从苹果汁中分离2-己烯醛和己醛,从植物油中分离脂肪酸酯等[54-58]。
2.4 吸附技术
吸附技术因操作简单,而且各种天然或合成吸附剂品种丰富,在污水处理中应用广泛。吸附过程通常在温和的条件下进行,不会对吸附的成分造成破坏作用,这一特点非常有利于风味物质的回收。最近一些研究探讨了该技术在风味物质回收中的应用,活性炭为最常采用的吸附剂,对咖啡中的重要风味物质苯甲醛、2-苯乙醇、乙酸乙酯和糠醛、梨汁中非常特征的风味成分2,4-癸二烯酸乙酯等都能进行有效回收[59-63]。众所周知,在各种植物精油生产所产生的废水中也含有比例很高的香料化合物。Edris小组利用活性炭填充柱对薄荷精油、香茅草油和留兰香油三种精油生产中的废水含有的香料化合物进行了回收,回收率可以达到70%~98%,通常亲水性的成分比疏水性成分的回收率更高[64]。
2.5 小结
很显然在天然产品受到高度推崇的今天,从产品加工过程中回收产品本身的风味物质然后再加回至最终产品中,毫无疑问可以满足消费者对纯天然产品的心理需求。虽然目前风味物质回收仍然以传统的蒸馏技术为主,但是膜蒸馏技术、超临界流体萃取技术和吸附技术为风味物质的回收带来了更多的选择性。这些新技术克服了传统蒸馏技术中的缺陷,同时对某些特定的重要风味物质还能进行选择性回收。将这些技术相互结合使用则可使食品在加工过程中最大程度地保持原有风味。
3 咸味香精
以蛋白酶解物、糖类等为原料通过Maillard反应制备的咸味香精也属于天然产品的范畴。咸味香精在我国食品香料香精行业占有重要的地位,近些年增长态势非常突出。2012 年中国咸味香精产能为 18.54 万吨,产量达到 16.88 万吨,销售额达31亿元。到2016 年,咸味香精产能增长至 30.64 万吨,产量为27.87 万吨。中国食品科学技术学会食品添加剂分会对国内咸味香精、调味料行业具有代表性的20家企业进行的统计中,其销售额2015 年为46.63 亿元,2016年为53.87 亿元。我国咸味香精企业主要分布在华东、华南、华中三个区域,其中华东区域占据了半壁江山,成为从业人员最关注的地区。咸味香精行业的客户群以方便面、肉制品、调味品、休闲食品、速冻调理食品、餐饮业为主要市场。企业产能、产量和销售额数据显示,咸味香精行业发展迅猛。扣除原材料成本上涨等因素,投资方仍然看好国内咸味香精的市场前景,很多传统甜味和烟草香精企业竞相上马咸味香精事业部,市场对于天然产品的需求无疑也成为咸味香精发展的重要驱动力。咸味香精的发展将主要体现在技术和应用领域两个方面。
3.1 新技术的发展
1)减盐增鲜技术。我国居民钠的日摄取量远高于世界卫生组织(WHO)的推荐量,减少膳食中钠的摄取,对国人来说,首要的是减盐。盐减少了,还不希望口感下降,这就要靠新的替代品。咸味香精企业此前在减盐方面做过很多尝试,目前比较热门的研究有咸味肽的开发,利用其协同作用欺骗味蕾,同时减少膳食中盐的用量。此外,香精企业也致力于饮食习惯的研究。辣味对咸味有明显的替代效应,如何利用类似的方法减少盐的摄取,将成为未来研究的热点。
2)风味低温驻留技术。人们大多都具有这样的生活经验:冰箱中冻久了的肉,无论怎么烹饪都有一股不新鲜的味道。肉在低温储藏过程中的风味劣变是个十分复杂的过程,这也是消费者认为现包现煮的水饺比速冻水饺好吃的原因。香精在速冻食品中没有起到太大的作用,原因在于香精企业过去更多地关注于如何让香精耐高温,而低温下香辛料等风味矫正剂自身的风味衰减过快,导致速冻食品货架期的风味不确定性大大增加。为此,需要香精企业研究各风味成分的耐低温性。根据各原料的特性,采取不同的技术手段,增加其驻留时间。目前,采用纳米乳化技术尝试延长风味驻留时间的实验已经展开。
3)现代分析技术。中国的传统发酵食品种类繁多、风味独特,在中餐领域应用普遍。很多代表性的中式菜肴,其特征风味都源于发酵原料的贡献。多年来,科技人员利用各种现代分析技术拆解这些发酵食品的风味组成,意在通过人工模拟的手段进行再现,但始终没有做到神似。后续研发人员将关注于引入更高灵敏度的分析仪器。另一方面,中餐的风味形成不仅仅依赖于配方,还跟烹饪工艺有密切关系。很多中式菜肴烹饪工序多,手段复杂,寻找形成特征风味的关键点将成为大家关注的热点。这项工作将依赖于在线式多任务型分析仪器的辅助,这种需求有可能推动分析仪器厂家研究热点的转移。
3.2 新领域的开发
1)烟熏腊肉制品。烟熏腊肉制品一直深受广大消费者喜爱,但有关其安全性的报道也从未间断。烟熏工艺在造就独特风味的同时,多环芳烃等致癌物含量也明显增加。咸味香精企业应关注烟熏腊肉行业的需求,在风味保持与食品安全的平衡间找到自己产品的落脚点。
2)短保烘焙食品。传统的月饼、近年来新兴的蒸蛋糕、肉松小贝等都是短保烘焙食品的代表。最初该类型产品主打新鲜、口感好的卖点,炒作无添加剂的概念。目前该行业提出的要求则是在特征明显的基础上,风味类型多样化并存,相关产品差异化开发。
3)自热火锅。随着人们生活节奏的加快,上班族用于烹饪的时间越来越少,因此自热食品的市场前景越来越好。无论是自热饭菜还是自热火锅、软罐头菜肴,包装瞬间的风味能否处于最佳状态都是亟待解决的技术难题。这需要香精企业开展大量的基础研究,配合食品企业改进目前的生产工艺和配方,才可能取得良好的效果,推动行业的进步。
4)特医食品。随着中国社会老龄化步伐的加快,各种疾病患者的数量急剧增加。为了配合治疗,很多种慢性病的患者必须遵医嘱长期食用特医食品。这些由制药企业生产的特医食品一般食用周期长、剂量大,有的甚至直接替代全部餐食。大多特医食品的配方设计仅仅从食物(营养)成分的需求或禁忌进行考虑,虽然治疗效果明显,但口味难以恭维。目前照搬国外的方法,即利用草莓、香草或巧克力香精进行矫味的思路,不符合国人的饮食习惯,患者难以长期食用这样的特医食品。只有接地气的中餐风味才能打开特医食品的销路,但这条路却并不好走。药企的研发人员不知道矫正异味该如何选材,而香精企业的研发人员不知道异味掩蔽剂是否破坏原配方的功效。这需要双方长期密切合作,既需要对对方人员进行技术培训,也需要大量的基础实验支持。
5)塑料制品。对咸味香精来说,这是个与时俱进的新领域。有人用软软的海绵将汉堡、面包和红烧肉等形象做成钥匙环上的挂件,还将逼真的风味注入海绵,成了深受欢迎的玩具。虽然目前产品类型还比较单一,但已有厂家开始尝试用各种咸味香精开发新产品。这个领域以往并不被咸味香精企业所熟悉,应用工程师也缺乏相关的经验,但是凭借前期的技术和产品积累,市场前景很好。
6)工业旅游。这也是一个新领域。一些大型食品企业在发展工业旅游过程中,发现游客对企业的硬件条件、管理体系和产品质量评价都很高,但销售额却上不去。调查结果表明,游客在参观走廊完全闻不到车间里面生产的食品香气,无法激起他们的购买欲。如果在参观走廊中模拟出目标食品的香气,对于提升游客体验,刺激购买欲都会有很大的作用。这种方法对于散装食品改为气调包装后导致的销售下滑也有很好的改善作用。目前,该领域已有十分成功的案例。相信咸味香精企业会有更多的建树。
3.3 小结
未来10年,是咸味香精发展重要的10年。对国内的咸味香精市场来说,机遇和挑战并存。克服前进道路上的困难,在迷雾中找对前进方向,咸味香精行业将迎来质的飞跃。
1)加大科普力度,消除负面宣传的影响。食用香精作为食品添加剂的一个分支,对现代食品工业做出了自己的贡献。但社会上对于香精的误解颇深,严重时将食品安全事件和食品造假都归罪于食用香精。个别食品企业推波助澜,广告词中有意强调未添加某种食品添加剂成分,造成了公众对食品添加剂更多的反感。针对这些情况,业内人士首先要通过专业学习,强化自信。比如,番茄在多年来的栽培过程中,决定其外观的基因表达战胜了决定其风味的基因表达[1],因而现在的番茄越来越漂亮,可味道却越来越淡。目前正是我们的研发人员通过自己的努力,对番茄菜肴进行风味补偿,消费者才能再次感受“儿时妈妈的味道”。将这样的事实告诉公众,当权威、公正、科学的声音占据主流媒体时,业内人士才更有底气做好自己的本职工作,公众对食品添加剂,对香精的认可才可能是水到渠成的事。为此,整个行业要团结起来,通力合作,加强正面宣传。
2)新环保法下的污染防治。近年来社会对环保的关注度持续高涨,国家新实施了堪称史上最严环保法。污染防治重点包括大气污染、水污染、生态污染等,这恰恰是香精行业的薄弱环节。香精企业既要集体发声,争取行业发展的必要空间,又要潜心研究,从配方设计角度出发,源头控制,减少后续治理的成本。
3)加强同行交流,促进共同发展。近几年,业内没有重大的技术突破,既有保护商业机密的考虑,也有创新匮乏的原因。香精的研发看似简单,其实内在的规律至今仍不清晰。增进同行的交流,可以互通有无,发挥头脑风暴的优势,实现共同进步。走过35年的我国咸味香精行业仍是香精行业中的小字辈,但在中国却有着广阔的发展空间。希望大家沉下心来,发扬工匠精神,打造精品,为中餐的工业化、标准化和现代化做出更大的贡献。
4 展 望
尽管消费者普遍认为“天然的”即是“安全的”,但事实并非如此。对于同一香料化合物,天然的和合成的并没有任何差异,它们具有相同的CAS登记号、FEMA号和JECFA号。“天然的比合成的更安全”更多意义上只是市场的一个宣传口号。对天然产品的追求,从可持续发展角度来讲更有意义。如采用生物技术制备香料,确实比传统的有机合成方法污染小,反应条件温和,而且原料底物为可再生的资源,更符合绿色化学的原则,因此天然的食品香料香精的发展是必然的趋势。目前很多的生物技术还存在转化率低、成本过高的缺陷,阻碍了其在香料工业制备中的广泛应用。生物技术应用在经济上的可行性亟待提高,有关基因工程、生物工程技术方面的研究、廉价反应底物来源的探索将成为解决问题的关键。除生物技术的应用外,天然提取物绿色提取技术的开发与利用、农副产品加工废弃物的回收利用也是天然香料可持续发展的重要方向。作为天然香精的咸味香精将会继续保持其市场优势,新的技术和应用领域的开发将为其发展注入新的活力。
参考文献:
[1] LEFFINGWELL J C, LEFFINGWELL D. Biotechnology: conquests and challenges in flavors & fragrances[J]. Leffingwell Reports, 2015, 7(2): 1-11.
[2] AKACHA N B, GARGOURI M. Microbial and enzymatic technologies used for the production of natural aroma compounds: synthesis, recovery modeling, and bioprocesses[J]. Food and Bioproducts Processing, 2015, 94: 675-706.
[3] BICAS J L, DIONISIO A P, PASTORE G M. Bio-oxidation of terpenes: an approach for the flavor industry[J].Chemical Review, 2009, 109(9): 4518-4531.
[4] BRENNA E, FUGANTI C, GATTI F G, et al. Biocatalytic methods for the synthesis of enantioenriched odor active compounds[J]. Chemical Review, 2011, 111(7): 4036-4072.
[5] BEN I, MUHEIM A. Flavour science: recent development[M].Cambridge: Royal Society of Chemistry, 1996:111-117.
[6] RAO S R, RAVISHANKAR G A. Vanilla flavor: production by conventional and biotechnological routes[J]. Journal of the Science of Food and Agriculture, 2000, 80(3): 289-304.
[7] MUHEIM A, MULLER B, MUNCH T, et al. Microbiological process for production of vanillin: US6235507[P].2001-03-22.
[8] ZHOU R, BHUIYA M W, CAI X, et al. Fermentative production of vanillin utilizing ferulic acid provided by a modified cafferic acid 3-O-methytransferase: WO2014106189[P]. 2014-07-03.
[9] GRAF N, ALTENBUCHNER J. Genetic engineering ofPseudomonasputidafor rapid and high yield production of vanillin from ferulic acid: WO20150111112[P]. 2015-01-29.
[10] LAMBERT F, ZUCCA J, MANE J, et al. Method for producing aromatic molecules inStreptomyces: WO2008113936[P]. 2008-09-25.
[11] LAMBERT F, ZUCCA J, NESS F, et al. Production of ferulic acid and coniferyl alcohol by conversion of eugenol using a recombinant strain ofSaccharomycescerevisiae[J]. Flavour and Fragrance Journal, 2014, 29(1): 14-21.
[12] LI K, FROST J W. Synthesis of vanillin from glucose[J]. Journal of the American Chemical Society, 1998, 120(40): 10545-10546.
[13] VAN DEN HEUVEL R H, FRAAIJE M W, LAANE C, et al. Enzymatic synthesis of vanillin[J]. Journal of Agricultural and Food Chemistry, 2001, 49(6): 2954-2958.
[14] DUETZ W, FJALLMAN A M, REN S, et al. Biotransformation of D-limonene to (+) trans-carveol by toluene-grownRhodococcusopacusPWD4 cells[J]. Applied and Environmental Microbiology, 2001, 67(6): 2829-2832.
[15] TECELAO C S R, VAN KEULEN F, DE FONSERCA. Development of a reaction system for the selective conversion of (-)-trans-carveol to (-)-carvone with whole cells ofRhodococcuserythropolisDCL14[J]. Journal of Molecular Catalysis B: Enzymatic, 2001, 11(4-6): 719-724.
[16] MORRISH J L,BRENNAN E,DRY H,et al. Enhanced bioproduction of carvone in a two-liquid-phase partitioning bioreactor with a highly hydrophobic biocatalyst[J]. Biotechnology and Bioengineering, 2008, 101(4): 768-775.
[17] MULLER B, DEAN C, SCHMIDT C, et al. Preparation of nootkatone and nootkatol by oxidation of valencene: WO9722575[P]. 1997-06-26.
[18] HUANG R, CHRISTENSON P A, LABUDA I M. Process for the preparation of nootkatone by laccase catalysis: US6200786[P]. 2001-03-13.
[19] FRAATZ M, RIEMER S L, STOEBER R, et al. A novel oxygenase fromPleurotussapidustransforms valencene to nootkatone[J]. Journal of Molecular Catalysis B: Enzymatic, 2009, 61(3/4): 202-207.
[20] SUBBIAH V. Extractive process for the purification of sclareolide produced by the fermentation of sclareol: US5945546[P].1999-08-31.
[21] FARBOOD M I, MORRIS J A, DOWNEY A E. Process for producing diol and lactone and microorganisms capable of same: US4970163[P]. 1990-11-13.
[22] SCHALK M, PASTORE L, MIRATA M A, et al. Toward a biosynthetic route to sclareol and amber odorants[J]. Journal of the American Chemical Society, 2012, 134(46): 18900-18903.
[23] JULIEN B N, PARK G E, BURLINGAME R. Recombinant microorganism producing sclareol synthase and labdenediol diphosphate synthase for ambroxide synthesis: WO/2014/022434 A1[P]. 2014-02-06.
[24] SCHALK M. Method for producing sclareol:US8617860[P]. 2013-12-31.
[25] HAYASE A, IGARSHI K. Manufacture of (-)-ambroxan using squalene-hopene cyclase: JP/2009/060799 A[P]. 2009-03-26.
[26] BREURE M, HOERSTER A, HAUER B. Enzymic production of ambroxane via cyclization of homofarnesol by a squalene hopene cyclase: WO/2010/139719 A2[P]. 2010-12-09.
[27] DEMYTTENAERE J C R, WILLEMEN H M. Biotransformation of linalool to furanoid and pyranoid linalool oxides byAspergillusniger[J]. Phytochemistry, 1998, 47(6): 1029-1036.
[28] MIRATA M A, WUEST M, MOSANDL A,et al. Fungal biotransformation of (±)-linalool[J]. Journal of Agricultural and Food Chemistry, 2008, 56(9): 3287-3296.
[29] ONKEN J, BERGER R G. Biotransformation of citronellol by the basidiomyceteCystodermacarchariasin an aerated-membrane bioreactor[J]. Applied Micro-biology and Biotechnology, 1999, 51(2): 158-163.
[30] DEMYTTENAERE J C R, ADAMS A, VANOVERSCHELDE J, et al. Biotransformation of (S)-(+)-linalool byAspergillusniger: an investigation of the culture conditions[J]. Journal of Agricultural and Food Chemistry, 2001, 49(12): 5895-5901.
[31] OHSU T, AMINO Y, NAGASAKI H, et al. Involvement of the calcium-sensing receptor in human taste perception[J]. Journal of Biological Chemistry, 2010, 285(2): 1016-1022.
[32] SMITH R L, WADDELL W J, COHEN S M, et al. GRAS flavoring substances [J]. Food Technology, 2011, 65(7): 44-75.
[33] OHSU T, TAKESHITA S, ETO Y, et al. Peptidic calcium receptor activators: WO/2007/055388 A2[P]. 2007-05-18.
[34] NOZAKI H, ABE I, TAKAKURA J, et al. Preparation of γ-glutamyltransferase variants for the production of γ-glutamylvalylglycine from valyl glycine: WO/2013/051685 A1[P]. 2013-04-11.
[35] SAFFARIONPOUR S, OTTENS M. Recent advances in techniques for flavor recovery in liquid food processing[J/OL]. Food Engineering Reviews, 2017[2018-03-01]. https://doi.org/10.1007/s12393-017-9172-8.
[36] WYLOCK C, ELOUNDOU MBALLA P P, HEILPORN C, et al. Review on the potential technologies for aroma recovery from food industry flue gas[J]. Trends in Food Science & Technology, 2015, 46(1): 68-74.
[37] MATIAS-GUIU P, RODRIGUEZ-BENCOMO J J, ORRIOLS I, et al. Floral aroma improvement of muscat spirits by packed column distillation with variable internal reflux[J]. Food Chemistry, 2016, 213: 40-48.
[38] SILVESTRE W P, AGOSTINI F, MUNIZ L A R, et al. Fractionation of green mandarin(CitrusdeliciosaTenore) essential oil by vacuum fractional distillation[J]. Journal of Food Engineering, 2016, 178: 90-94.
[39] BELISARIO-SANCHEZ Y Y, TABOADA-RODRIGUEZ A, MARIN-INIESTA F, et al. Dealcoholized wines by spinning cone column distillation: phenolic compounds and antioxidant activity measured by the 1,1-diphenyl-2-picrylhydrazyl method[J]. Journal of Agricultural and Food Chemistry, 2009, 57(15): 6770-6778.
[40] CATARINO M, MENDEZ A. Non-alcoholic beer: a new industrial process[J]. Separation and Purification Technology, 2011, 79(3): 342-351.
[41] SCHMIDTKE L M, BLACKMAN J W, AGBOOLA S O. Production technologies for reduced alcoholic wines[J]. Journal of Food Science, 2012, 77(1): 25-41.
[42] BAGGER-JØRGENSEN R, MEYER A S, PINELO M, et al. Recovery of volatile fruit juice aroma compounds by membrane technology: sweeping gas versus vacuum membrane distillation[J]. Innovative Food Science and Emerging, 2011, 12(3): 388-397.
[43] SCHMITZ O R, MARMO N S M, CUNHA L P L, et al.Extraction of aroma compounds of fruit juices by air stripping using a bubble column operating with antifoam and its effect on juice properties[J]. Journal of Food Engineering, 2015, 159: 1-8.
[44] ABU-ZEID M, ZHANG Y, DONG H, et al. A comprehensive review of vacuum membrane distillation technique[J]. Desalination, 2015, 356: 1-14.
[45] CHEN G, YANG X, WANG R, et al. Performance enhancement and scaling control with gas bubbling in direct contact membrane distillation[J]. Desalination, 2013, 308:47-55.
[46] PURWASASMITA M, KURNIA D, MANDIAS F C, et al. Beer dealcoholization using non-porous membrane distillation[J]. Food and Bioproducts Processing, 2015, 94: 180-186.
[47] MOTTA S, GUAITA M, PETROZZIELLO M, et al. Comparison of the physichochemical and volatile composition of wine fractions obtained by two different dealcoholization techniques[J]. Food Chemistry, 2017, 221: 1-10.
[48] CATARINO M, FERREIRA A, MENDES A. Study and optimization of aroma recovery from beer by pervaporation[J]. Journal of Membrane Science, 2009, 341(1/2): 51-59.
[50] WESCHENFELDER T A, LANTIN P, VIEGAS M C, et al.Concentration of aroma compounds from an industrial solution of soluble coffee by pervaporation process[J]. Journal of Food Engineering, 2015, 159: 57-65.
[51] DIBAN N, VOINEA OC, URTIAGA A. Vacuum membrane distillation of the main pear aroma compound: experimental study and mass transfer modeling[J]. Journal of Membrane Science, 2009, 326(1): 64-75.
[52] AROUJALIAN A, RAISI A. Recovery of volatile aroma components from orange juice by pervaporation[J]. Journal of Membrane Science, 2007, 303(1/2): 154-161.
[53] SONI V, ABILDSKOV J, JONSSON G, et al. Modeling and analysis of vacuum membrane distillation for the recovery of volatile aroma compounds from black currant juice[J]. Journal of Membrane Science, 2008, 320(1/2): 442-455.
[54] BEJARANO A, SIMOES P C, DEL VALLE J M. Fractionation technologies for liquid mixtures using dense carbon dioxide[J]. Journal of Supercritical Fluids, 2016, 107: 321-348.
[55] RUIZ-RODRIGUEZ A, FORNARI T, JAIME L, et al. Supercritical CO2extraction applied toward the production of a functional beverage from wine[J]. Journal of Supercritical Fluids, 2012, 61: 92-100.
[57] BEJARANO A, DEL VALLE J M. Countercurrent fractionation of aqueous apple aroma constituents using supercritical carbon dioxide[J]. Journal of Supercritical Fluids, 2017, 120: 266-274.
[58] DEL VALLE J M. Extration of natural compounds using supercritical CO2: going from the laboratory to the industrial application[J]. Journal of Supercritical Fluids, 2015, 96: 180-199.
[59] DIANA R Z, DANIELLE C, GUILHERME A R D, et al.Adsorption of two coffee aromas from synthetic aqueous solution onto granular activated carbon derived from coconut husks[J]. Journal of Food Engineering, 2011, 104(2): 284-292.
[60] ANDERSON M D C, DANIELLE C, AGNES P S, et al. Fixed-bed column adsorption of the coffee aroma compound benzaldehyde from aqueous solution onto granular activated carbon from coconut husk[J]. LWT-Food Science and Technology, 2014, 59: 1025-1032.
[61] DANIELLE C, LUIZ A D, VITOR R S, et al. Adsorption of volatile aroma compound 2-phenylethanol from synthetic solution onto granular activated carbon in batch and continuous modes[J]. Journal of Food Engineering, 2013, 117(3): 370-377.
[62] LUCAS S, COCERO M J, ZETZL C, et al. Adsorption isotherms for ethylacetate and furfural on activated carbon from supercritical carbon dioxide[J]. Fluid Phase Equilibria, 2004, 219(2): 171-179.
[63] DIBAN N, RUIZ G, URTIAGA A, et al. Granular activated carbon for the recovery of the main pear aroma compound: viability and kinetic modelling of ethyl-2,4-decadienoate adsorption[J]. Journal of Food Engineering, 2006, 78(4): 1259-1266.
[64] EDRIS A E, GIRGIS B S, FADEL H H M, et al. Recovery of volatile aroma components from aqueous waste streams using an activated carbon column[J]. Food Chemistry, 2003, 82(2): 195-202.
