香菇柄中5′-核苷酸的酶法提取及组成分析
2018-04-17李顺峰王安建张雪彦田广瑞刘丽娜魏书信高帅平
李顺峰, 王安建, 张雪彦, 田广瑞, 刘丽娜, 魏书信, 高帅平
(1.河南省农业科学院 农副产品加工研究中心, 河南 郑州 450002; 2.河南农业大学 食品科学技术学院, 河南 郑州 450002)
香菇是一种营养丰富、风味独特的药食同源食用菌[1],其含有的多糖、多酚、不饱和脂肪酸和膳食纤维等功能活性成分,在提高人体免疫力、抗肿瘤、降血脂、抗氧化等方面都具有良好的保健功效[2-6],深受消费者喜爱。而且,文献[7]指出,与其他可食蘑菇相比,香菇中的5′-核糖核苷酸含量较高,尤其是5′-鸟苷酸(5′-GMP)、5′-肌苷酸(5′-IMP)和5′-黄苷酸(5′-XMP)和5′-腺苷酸(5′-AMP)对香菇的鲜味有增效作用。鲜味是人体味觉的第五感,具有开胃、可口和令人愉悦的感觉[8]。近年来的研究表明,鲜味可以调控人体的食欲和对食物的满足感,可减少对高能量和高糖高脂食物的摄取量,从而降低肥胖,也可帮助病人或老年人改善食欲[9]。
香菇柄是香菇深加工过程中的副产物,约占香菇干质量的15%~30%。研究表明,香菇柄不仅在营养成分上与香菇菇盖基本接近,而且膳食纤维含量远高出香菇菇盖[10]。然而,由于菇柄中含有较多的纤维素类物质,致其口感粗糙,咀嚼度差,大多数被废弃处理,全国每年废弃的香菇柄有数万吨,造成了极大的资源浪费[11]。也正是由于菇柄中纤维类物质的包裹,使得菇柄中的风味成分很难释放,其鲜香味远不如香菇菇盖浓郁醇厚[12]。
与香菇开发利用的研究报道相比,对香菇柄加工利用的报道现在较少。目前,仅有关于香菇柄面包[13]、香菇柄蜜饯[14]、香菇柄松[15]、香菇柄酒精饮料[16]等菇柄加工产品的报道,而关于香菇柄中呈鲜物质提取和利用的报道较少[12, 17]。相较于香菇菇盖,香菇柄中纤维含量较高,本文采用纤维素酶酶解香菇柄提取5′-核苷酸,并分析其组成比例和含量,以期为香菇柄风味物质的利用和香菇柄调味料的开发提供参考。
1 材料与方法
1.1 材料与试剂
香菇柄,购自郑州信基调味品城;纤维素酶(食品级,10 000 U·g-1),南宁庞博生物工程有限公司;磷酸二氢钾、高碘酸钠、乙二醇、抗坏血酸、四水合钼酸铵等均为国产分析纯;5′-鸟苷酸(5′-GMP)、5′-尿苷酸(5′-UMP)、5′-胞苷酸(5′-CMP)、5′-腺苷酸(5′-AMP)、5′-肌苷酸(5′-IMP),购自Sigma-Aldrich公司;5′-黄苷酸(5′-XMP),购自上海阿拉丁生化科技股份有限公司;实验用水为蒸馏水。
1.2 实验方法
1.2.1纤维素酶酶解提取香菇柄中5′-核苷酸单因素实验
香菇柄40 ℃烘干后,粉碎过60目筛,称取香菇柄粉2.0 g,分别考察纤维素酶不同加酶量(0.1%、0.2%、0.4%、0.6%、0.8%、1.0%)、液固比(mL∶g)(10∶1、20∶1、30∶1、40∶1、50∶1)、酶解温度(30、40、50、60、70 ℃)、酶解时间(0.5、1、2、3、4、5 h)、酶解pH值(3.0、3.8、4.6、5.4、6.2、7.0)对香菇柄中5′-核苷酸提取得率的影响。采用过碘酸氧化法[18]测定5′-核苷酸,每组实验重复3次,取平均值。
1.2.2纤维素酶酶解提取香菇柄中5′-核苷酸正交试验设计
在单因素实验的基础上,选取加酶量、酶解温度、酶解pH值、酶解时间4个因素,采用L9(34)正交设计对纤维素酶酶解提取5′-核苷酸工艺进行优化。正交试验设计与水平见表1。
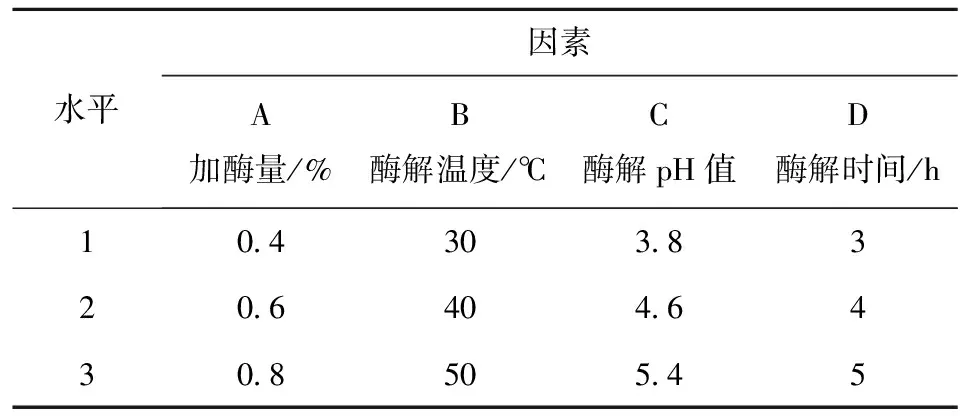
表1 正交因素水平
1.2.3纤维素酶酶解提取香菇柄中5′-核苷酸的组成分析
5′-核苷酸的组成测定参考Taylor等[19]和Mau等[20]方法并稍作修改。
1.2.3.1 色谱条件
HPLC为美国戴安Ultimate 3000,配有PDA-3000检测器;色谱柱为安捷伦ZORBAX Eclipse Plus C18色谱柱(5 μm,4.6×250 mm);流动相为0.2 mol·L-1磷酸二氢钾∶水=30∶70;检测波长为254 nm;进样量10 μL;柱温30 ℃;流速1.0 mL·min-1。
1.2.3.2 标品及混合标品的配制
准确称取5′-GMP、5′-UMP、5′-CMP、5′-AMP、5′-IMP、5′-XMP各0.100 g,用超纯水溶解后配成1mg·mL-1各核苷酸标准液。取核苷酸标准液各1 mL,定容至10 mL,得6混标溶液,各单核苷酸质量浓度为100 μg·mL-1,并依次配成70、50、30、10 μg·mL-1核苷酸混合标准液,分别吸取10 μL测定,依据峰面积绘制各5′-核苷酸标准曲线。
1.2.3.3 香菇柄5′-核苷酸组成测定
纤维素酶酶解提取得到的香菇柄5′-核苷酸过0.2 μm滤膜,取10 μL上样测定,并依据保留时间确定各5′-核苷酸,然后按峰面积计算各5′-核苷酸含量。
2 结果与分析
2.1 单因素实验
2.1.1加酶量对5′-核苷酸得率的影响
在液固比为20∶1,酶解温度为50 ℃,酶解时间为2 h,酶解pH值为5.4的条件下,采用不同加酶量(0.1%、0.2%、0.4%、0.6%、0.8%、1.0%)进行酶解提取,考察加酶量对香菇柄中5′-核苷酸提取得率的影响。加酶量对5′-核苷酸得率的影响见图1。
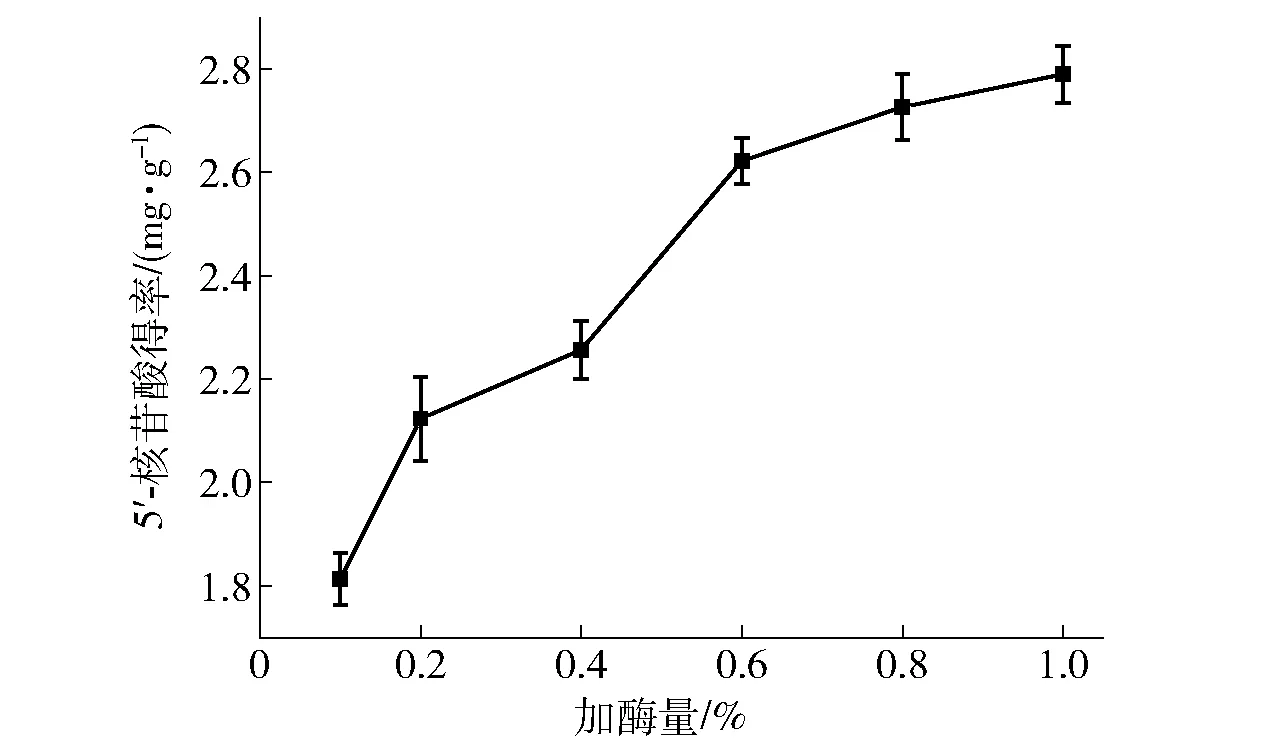
图1 加酶量对5′-核苷酸得率的影响Fig.1 Effect of cellulase amount on 5′-nucleotides content
从图1可以看出,在加酶量为0.1%~0.6%时,随着加酶量的增大,5′-核苷酸得率呈逐渐增大的趋势,并在加酶量为0.6%时,5′-核苷酸得率达到较高水平(2.62 mg·g-1),此后继续增大加酶量,5′-核苷酸得率虽有所增加,但与加酶量为0.6%时的得率相比较无显著差异(p>0.05)。这可能是由于在较低酶浓度条件下,底物能够完全与酶结合破坏细胞壁,促使内容物释放,但在较高酶浓度情况下,底物不能对酶达到饱和而使一部分酶分子无法发挥作用[12, 21]。因此,从经济方面考虑,选择加酶量为0.6%较为适宜。
2.1.2液固比对5′-核苷酸得率的影响
在加酶量为0.6%,酶解温度为50 ℃,酶解时间为2 h,酶解pH值为5.4条件下,考察不同液固比10∶1、20∶1、30∶1、40∶1、50∶1对香菇柄中5′-核苷酸提取得率的影响(见图2)。由图2可知,当液固比由10∶1增加到20∶1时,5′-核苷酸得率由2.44 mg·g-1显著升高至2.76 mg·g-1,此后继续增大液固比,5′-核苷酸得率呈缓慢升高趋势,与液固比为20∶1时相比较,5′-核苷酸得率均未达到显著水平(p>0.05),并且当液固比增大至50∶1时,5′-核苷酸得率仅比液固比为20∶1时增加了0.16 mg·g-1,考虑后续工作和节约资源等综合因素,选择液固比20∶1较为合适。

图2 液固比对5′-核苷酸得率的影响Fig.2 Effect of liquid-solid ratios on yield of 5′-nucleotides
2.1.3酶解温度对5′-核苷酸得率的影响
在加酶量为0.6%,液固比(mL∶g)为20∶1,酶解时间为2 h,酶解pH值为5.4条件下,考察不同酶解温度(30、40、50、60、70 ℃)对香菇柄中5′-核苷酸提取得率的影响。随着酶解温度的升高,5′-核苷酸得率呈先升高后下降的趋势(见图3)。在酶解温度为40 ℃时,5′-核苷酸得率最高,为3.18 mg·g-1,这一结果可能与酶的性质有关,每种酶都有一个最适作用温度,在较低温度下,随着温度上升酶活不断增强,酶解破壁作用加强,但温度超过最适温度后,随着温度的上升酶部分或全部变性而失去酶活力[12,17,21]。故选择40 ℃作为适宜的酶解温度进行后续实验。
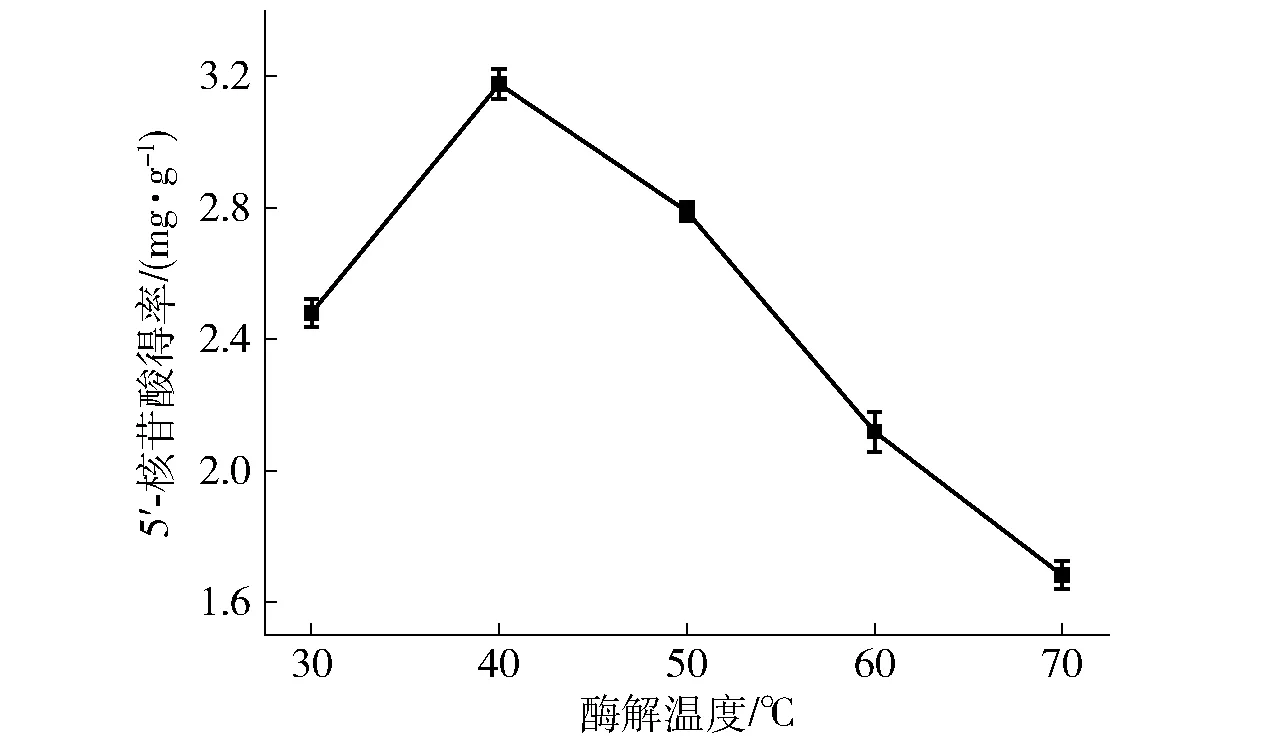
图3 酶解温度对5′-核苷酸得率的影响Fig.3 Effect of enzymatic hydrolysis temperatures on yield of 5′-nucleotides
2.1.4酶解时间对5′-核苷酸得率的影响
在加酶量为0.6%,液固比20∶1,酶解温度为40 ℃,酶解pH值为5.4条件下,考察不同酶解时间(0.5、1、2、3、4、5 h)对香菇柄中5′-核苷酸提取得率的影响(见图4)。从图4可以看出,随酶解时间的延长,5′-核苷酸得率呈逐渐升高趋势,当酶解时间为4 h时,5′-核苷酸得率达到较高水平(3.66 mg·g-1),为酶解时间在0.5 h时得率的1.77倍,此后继续延长酶解时间至5 h时,其5′-核苷酸得率仅比4 h时高了1.45%。这是由于随着酶解时间的延长,纤维素酶能充分地与底物反应,破坏细胞壁,从而使5′-核苷酸不断溶出;当细胞壁被破坏到一定程度时,继续延长酶解时间,5′-核苷酸得率升高趋缓[12,17,21]。故选取4 h作为较佳酶解时间。

图4 酶解时间对5′-核苷酸得率的影响Fig.4 Effect of enzymatic hydrolysis time on yield of 5′-nucleotides
2.1.5酶解pH值对5′-核苷酸得率的影响
在加酶量为0.6%,液固比20∶1,酶解温度为40 ℃,酶解时间为4 h条件下,考察不同酶解pH值(3.0、3.8、4.6、5.4、6.2、7.0)对香菇柄中5′-核苷酸提取得率的影响(见图5)。由图5可知,在实验范围内,随着pH值升高,5′-核苷酸得率逐渐升高,在pH值 4.6时,5′-核苷酸得率达到最大(3.89 mg·g-1),随着pH值继续增大,5′-核苷酸得率呈逐渐下降的趋势。这可能是由于在适宜的pH值作用范围内,酶活性较高,能充分发挥酶的专一水解作用[21],故选择4.6作为较适宜酶解pH值。

图5 酶解pH值对5′-核苷酸得率的影响Fig.5 Effect of enzymatic hydrolysis pH values on yield of 5′-nucleotides
2.2 正交优化试验
以5′-核苷酸得率为指标,对香菇柄5′-核苷酸的纤维素酶酶解条件进行优化,正交试验结果见表2。
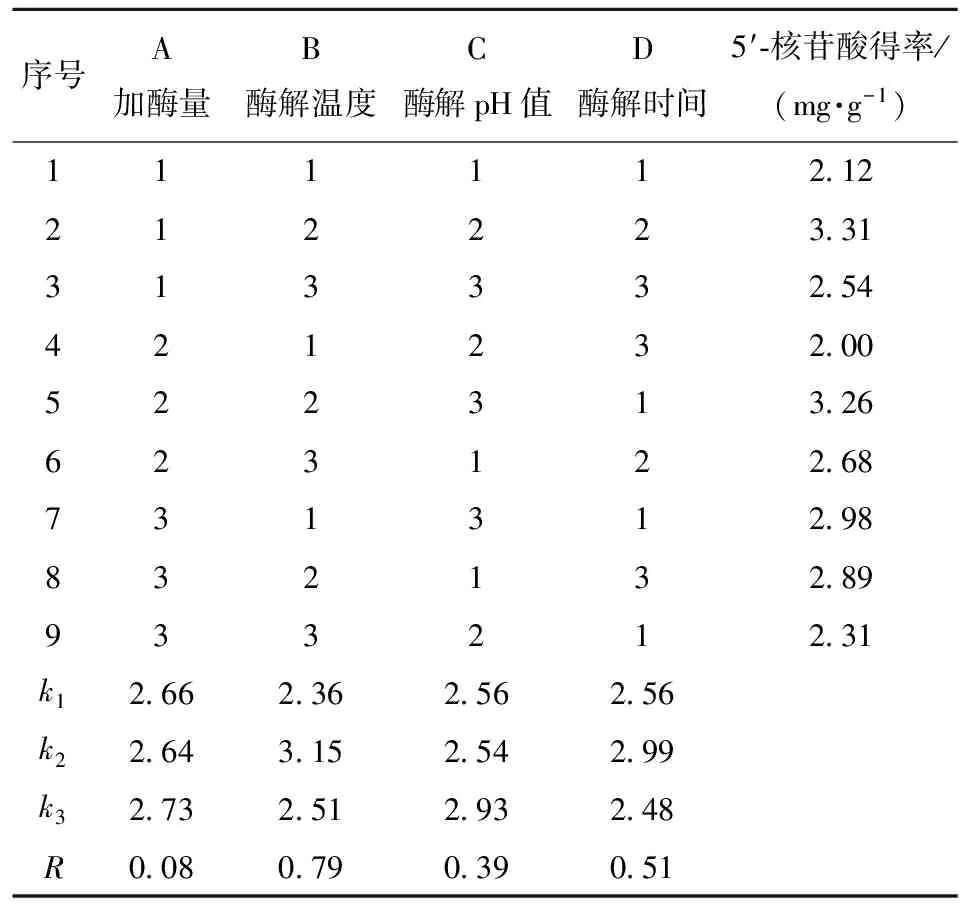
表2 正交试验设计及结果
从表2中的极差R可以看出,各因素对5′-核苷酸得率影响大小依次为B>D>C>A,即影响5′-核苷酸得率的最主要因素是酶解温度,其他依次为酶解时间、酶解pH值、加酶量。由表2中的k值可以看出,在液固比20∶1条件下,纤维素酶酶解提取香菇柄中5′-核苷酸的优化工艺组合为A3B2C3D2,即加酶量0.8%,酶解温度40 ℃,pH值为5.4,酶解时间4 h。经验证,在此优化条件下纤维素酶酶解提取香菇柄中5′-核苷酸得率为(4.08±0.11)mg·g-1,高于单因素实验结果和正交表内组合结果。但这一结果,显著低于吴关威等[17]采用分光光度法测定纤维素酶提取的香菇柄中呈味核苷酸(I+G)的含量(32.8 mg·g-1),这可能与采用的测定方法不同有关[18],本文采用的过碘酸氧化法可以专一测定5′-核苷酸。
2.3 5′-核苷酸组成分析

图6 纤维素酶酶解提取香菇柄中5′-核苷酸各组分含量Fig.6 Contents of 5′-nucleotides components from shiitake mushroom stipe extracted by cellulase
研究采用HPLC测定纤维素酶酶解提取香菇柄5′-核苷酸含量(4.57 mg·g-1),如图6。高于分光光度法所测结果,说明5′-核苷酸含量高低受所采用测定方法的影响。因HPLC法可直接测定各5′-单核苷酸含量,是一种比较适宜的5′-核苷酸测定方法。与前人研究相比,本研究结果与Chen等[22]所测定香菇柄5′-核苷酸含量(4.23 mg·g-1)相近,高于赵静等[23]香菇菌汤中5′-核苷酸含量(1.50 mg·g-1)。本研究所得5′-核苷酸由5′-GMP、5′-UMP、5′-CMP、5′-AMP、5′-IMP和5′-XMP组成,且所提取5′-核苷酸主要由5′-CMP、5′-AMP和5′-XMP组成,分别占5′-核苷酸的36.67%、43.69%和16.01%。而Chen等[22]仅检测到香菇柄中的4种5′-核苷酸,未检测到5′-IMP和5′-XMP。本研究所测定纤维素酶酶解香菇柄所得的5′-GMP和5′-AMP含量为2.00mg·g-1,高于Andō[24]报道的香菇柄中5′-GMP和5′-AMP的含量(0.8 mg·g-1)。呈鲜味核苷酸由5′-GMP、5′-IMP、5′-XMP和5′-AMP组成[20],本研究所测香菇柄中含有所有的呈鲜味核苷酸,所提取的香菇柄中呈鲜味核苷酸质量比为2.86 mg·g-1,占5′-核苷酸的62.63%,高于Chen等[22]所测定香菇柄中呈鲜味核苷酸质量比1.00 mg·g-1,其占5′-核苷酸23.64%的结果,这可能与所测定到的5′-核苷酸组成有关。
3 结 论
通过单因素实验和正交试验纤维素酶酶解反应条件的优化,得出纤维素酶酶解提取香菇柄中5′-核苷酸的优选工艺条件为液固比20∶1,加酶量0.8%,酶解温度40 ℃,pH值5.4,酶解时间4 h,此时5′-核苷酸得率为4.08 mg·g-1。
经HPLC检测,纤维素酶酶解提取香菇柄5′-核苷酸由5′-GMP、5′-UMP、5′-CMP、5′-AMP、5′-IMP和5′-XMP组成,5′-核苷酸含量高于采用过碘酸氧化法所测定结果,其中呈鲜味核苷酸占5′-核苷酸的62.63%。
参考文献:
[1] 弋淮. 香菇栽培技术研究[J]. 农业科技与信息, 2017(6): 60-61.
[2] WANG X M, ZHANG J, WU L H, et al. A mini-review of chemical composition and nutritional value of edible wild-grown mushroom from China[J]. Food Chemistry, 2014, 151(s): 279-285.
[3] ZHANG Z, LÜ G, PAN H, et al. Effects of different drying methods and extraction condition on antioxidant properties of shiitake (Lentinusedodes)[J]. Food Science and Technology Research, 2009, 15(5): 547-552.
[4] CHEN H, JU Y, LI J, et al. Antioxidant activities of polysaccharides fromLentinusedodesand their significance for disease prevention[J]. International Journal of Biological Macromolecules, 2012, 50(1): 214-218.
[5] ZHAO Y M, WANG J, WU Z G, et al. Extraction, purification and anti-proliferative activities of polysaccharides fromLentinusedodes[J]. International Journal of Biological Macromolecules, 2016, 93: 136-144.
[6] CHIEN R C, YEN M T, MAU J L. Antimicrobial and antitumor activities of chitosan from shiitake stipes, compared to commercial chitosan from crab shells[J]. Carbohydrate Polymers, 2016, 138: 259-264.
[7] DERMIKI M, PHANPHENSOPHON N, MOTTRAM D S, et al. Contributions of non-volatile and volatile compounds to the umami taste and overall flavour of shiitake mushroom extracts and their application as flavour enhancers in cooked minced meat[J]. Food Chemistry, 2013, 141(1): 77-83.
[8] PHAT C, MOON B, LEE C. Evaluation of umami taste in mushroom extracts by chemical analysis, sensory evaluation, and an electronic tongue system[J]. Food Chemistry, 2016, 192: 1068-1077.
[9] POOJARY M M, ORLIEN V, PASSAMONTI P, et al. Improved extraction methods for simultaneous recovery of umami compounds from six different mushrooms[J]. Journal of Food Composition and Analysis, 2017, 63: 171-183.
[10] 戴龙. 香菇柄纤维低聚化及其产品的研制[D]. 长春: 吉林农业大学, 2014.
[11] 刘丽娜, 王安建, 李顺峰, 等. 香菇柄热风干燥特性及微粉性质研究[J]. 食品工业科技, 2016, 37(5): 126-131.
LIU L N, WANG A J, LI S F, et al. Study on hot air drying characteristics of mushroom stem and its properties of micro-powder[J]. Science and Technology of Food Industry, 2016, 37(5): 126-131.
[12] 高虹, 程薇, 史德芳, 等. 香菇柄复合酶解工艺研究[J]. 湖北农业科学, 2014,23: 5823-5827.
GAO H, CHENG W, SHI D F, et al. Hydrolysis effects of cellulase and nuetral protease onLentinusedodesstipe[J]. Hubei Agricultural Sciences, 2014,23: 5823-5827.
[13] LIN L Y, TSENG Y H, LI R C, et al. Quality of shiitake stipe bread[J]. Journal of Food Processing and Preservation, 2008, 32(6): 1002-1015.
[14] 翟洪民. 香菇柄蜜饯制作工艺[J]. 保鲜与加工, 2006(1): 20.
[15] 王安建, 刘丽娜, 魏书信, 等. 香菇柄松加工工艺的研究[J]. 农产品加工(学刊), 2013(1): 48-50.
WANG A J, LIU L N, WEI S X, et al. Processing technology of the mushroom stem floss[J]. Academic Periodical of Farm Products Processing, 2013(1): 48-50.
[16] LIN P H, HUANG S Y, MAU J L, et al. A novel alcoholic beverage developed from shiitake stipe extract and cane sugar with variousSaccharomycesstrains[J]. LWT-Food Science and Technology, 2010, 43(6): 971-976.
[17] 吴关威, 李敏, 刘吟, 等. 纤维素酶法提取香菇柄中呈味核苷酸工艺研究[J]. 中国调味品, 2010, 35(12): 41-43,59.
WU G W, LI M, LIU Y, et al. Studies on extraction of flavor nucleotide from the foot body ofLentinusedodeswith cellulose enzyme[J]. China Condiment, 2010, 35(12): 41-43,59.
[18] 陈钧辉, 陶力, 李俊, 等. 生物化学实验:第3版[M]. 北京: 科学出版社, 2003:131-134.
[19] TAYLOR M W, HERSHEY H V, LEVINE R A, et al. Improved method of resolving nucleotides by reversed-phase high-performance liquid chromatography[J]. Journal of Chromatography, 1981, 219(1): 133-139.
[20] MAU J L, LIN H C, CHEN C C. Non-volatile components of several medicinal mushrooms[J]. Food Research International, 2001, 34(6): 521-526.
[21] PAN S, WU S. Cellulase-assisted extraction and antioxidant activity of the polysaccharides from garlic[J]. Carbohydrate Polymers, 2014, 111: 606-609.
[22] CHEN W, LI W, YANG Y, et al. Analysis and evaluation of tasty components in the pileus and stipe ofLentinulaedodesat different growth stages[J]. Journal of Agricultural and Food Chemistry, 2015, 63(3): 795-801.
[23] 赵静, 丁奇, 孙颖, 等. 香菇菌汤及酶解液中滋味成分及呈味特性的对比分析[J]. 食品科学, 2016, 37(24): 99-104.
ZHAO J, DING Q, SUN Y, et al. Comparison of taste compounds and taste characteristics of shiitake mushroom soup and enzymatic hydrolysate[J]. Food Science, 2016, 37(24): 99-104.
