苦丁茶多酚提取物对四氯化碳诱导小鼠肝损伤的改善作用及机制研究
2018-04-13,,,,,,*
,,,,,,*
(1.重庆第二师范学院,重庆市功能性食品协同创新中心,重庆市功能性食品工程技术研究中心,功能性食品研发重庆市工程实验室,生物与化学工程学院,重庆 400067;2.桂林医学院公共卫生学院食品卫生与营养学教研室,广西高校预防医学重点实验室,广西桂林 541004)
肝脏是机体的重要器官,担负营养和药物新陈代谢的功能,能够清除体内的毒素和细菌,具有很强的再生和修复能力[1]。物理和化学因素都可能导致肝损伤,进而影响肝脏的解毒功能,引起肝功能障碍,引发其他多器官功能失调,甚至导致肝衰竭,威胁生命[1-3]。
苦丁茶是一种特殊的类茶饮品,是由冬青科冬青属的苦丁茶种常绿乔木树叶制成[4]。作为一种天然饮品,苦丁茶在中国西南地区和华南地区比较普遍,常用来清热消暑、生津止渴和润喉止咳[5]。研究证实苦丁茶具有抑制氧化应激、预防炎症和癌症等活性功能[6-7],这与其含有的多酚类组分密切相关[8-9]。苦丁茶多酚类化合物主要是绿原酸及其衍生物[10]。有研究表明苦丁茶提取物对肝损伤有较好的抑制作用[11],所以其抗肝损伤成为研究热点,但其在作用机制需要进一步的研究;同时,由于苦丁茶多酚物质的成分与绿茶多酚有所不同,绿茶多酚物质发挥生物活性作用的机制已有一定研究[11-12],但苦丁茶多酚物质的相关研究还是不足。因此,本研究将针对苦丁茶多酚对四氯化碳诱导小鼠肝损伤进行研究,并对作用机制进行分析,研究结果将对苦丁茶多酚的深入应用提供理论依据。
1 材料与方法
1.1 材料与仪器
野生苦丁茶安国市祁珍养生食品有限公司;绿原酸标准品上海源叶生物科技有限公司;水飞蓟素美国Sigma公司;天门冬氨酸氨基转移酶(AST)测定试剂盒、丙氨酸氨基转移酶(ALT)测定试剂盒、碱性磷酸酶(ALP)测定试剂盒、甘油三酯(TG)测定试剂盒、总胆固醇(TC)测定试剂盒、尿素氮(BUN)测定试剂盒、白蛋白(ALB)测定试剂盒、总超氧化物歧化酶(SOD)测定试剂盒、一氧化氮(NO)测定试剂盒、过氧化氢酶(CAT)测定试剂盒、丙二醛(MDA)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒南京建成生物工程研究所;IL-6、IL-12、TNF-α和IFN-γ酶联免疫试剂盒美国Biolegend公司;CycleTESTTM PLUS DNA染色试剂盒德国Becton Dickinson公司;Trizol试剂、oligodT18、RNase、dNTP、MLV和PCR引物美国Invitrogen公司;其余试剂均为国产分析纯;清洁级昆明小鼠60只(6周龄、雌雄各半),购于重庆医科大学实验动物中心,动物许可证SCXK(渝)2012-0001,在温度(22±4) ℃、湿度50%±20%下饲养1周后进行实验。
Biomate3S型紫外可见光分光光度仪、SimpliAmp梯度PCR仪、LUX多功能性酶标仪美国Thermo Fisher Scientific公司;ICEN-24R高速冷冻离心机杭州奥盛仪器有限公司;BX43生物显微镜日本奥林巴斯公司。
1.2 实验方法
1.2.1苦丁茶多酚的提取纯化取1 kg苦丁茶粉碎后加入9 L的纯水,在90 ℃下水浴提取30 min后收集提取液,然后重复1次,收集2次的提取液后将提取液过大孔树脂HP20,经过大孔树脂吸附后,在2 mL/min速度下以70%的乙醇洗脱,得到苦丁茶多酚提取物(PEK)[13]。
1.2.2苦丁茶多酚的含量测定称取一定量绿原酸标准品,加入去离子水配制成绿原酸标准液,然后吸取1.0 mL不同浓度的绿原酸标准液于25 mL的容量瓶中,再加入3.0 mL的Folin-Ciocalteu试剂冲划分混合,待反应5 min后在容量瓶总加入4.5 mL的饱和Na2CO3溶液,加水定容后在30 ℃下避光反应30 min,最后在747 nm处测定吸光度值,绘制绿原酸的标准曲线[14]。将PEK进行梯度稀释至10-4倍,按上述方法测定PEK的吸光度值,对照标准曲线计算PEK的多酚物质含量。
1.2.3动物实验将小鼠平均分为5组,每组12只小鼠,雌雄各半,分别为正常组、模型组、水飞蓟素灌胃组(阳性对照组)、PEK低剂量(50 mg/kg·bw)和高剂量灌胃组(100 mg/kg·bw)。正常组和模型组小鼠每天灌胃2 mL的生理盐水;水飞蓟素灌胃组每天灌胃0.2 mL水飞蓟素溶液(100 mg/kg·bw);PEK低、高浓度组小鼠每天分别按浓度50和100 mg/kg·bw灌胃PEK溶液0.2 mL,实验持续28 d。第28 d对除正常组外所有小鼠腹腔注射四氯化碳诱导剂(2 mL/kg·bw,CCl4∶橄榄油=1∶1,v/v)诱导急性肝损伤,然后对所有小鼠实施禁食,但允许自由饮水。禁食24 h后断颈处死小鼠,解剖后心脏取血并取肝脏组织[15]。
1.2.4小鼠肝指数测定称量小鼠的体质量和肝质量,按公式肝指数(%)=肝脏质量/小鼠体质量×100。
1.2.5小鼠血清水平测定将小鼠血浆在4000 r/min离心10 min后分离血清,使用AST、ALT、ALP、TG、TC、BUN、ALB、SOD、NO、CAT、MDA和GSH-Px试剂盒测定小鼠血清相关生化指标的水平[15],每只小鼠的以上指标重复测定3次。
1.2.6小鼠血清细胞因子水平测定采用IL-6、IL-12、TNF-α和IFN-γ细胞因子测定试剂盒检测1.2.3中所制备小鼠血清中细胞因子水平[15],每只小鼠的以上指标重复测定3次。
1.2.7肝组织病理学观察取肝组织切块,用10%的福尔马林溶液固定,并用浓度为95%(v/v)的乙醇脱水,然后用二甲苯置换出肝组织内的乙醇,采用石蜡包埋后冷却切片,采用HE染色法对切片进行染色,并在光学显微镜下观察[16]。
研究对象来源于我院收治的85例脑卒中后焦虑抑郁患者,选取时间为2016年1月-2017年6月。其分组资料整理如下:对照组男女比例为27:15,平均年龄(55.3±6.7)岁。观察组男女比例为28:15,平均年龄(55.6±6.2)岁。纳入标准:所有患者经脑卒中诊断和抑郁评分确诊为脑卒中后抑郁[2];签署知情同意书。排除标准:卒中前存在精神心理疾病、中途退出、护理依从性差者。上述组间数据对比均保持同质性(P>0.05)。

表1 引物序列Table 1 Sequences of reverse transcription polymerase chain reaction primers used in this study
1.2.8RT-PCR实验测定小鼠肝组织mRNA表达取小鼠的肝组织匀浆后用RNAzol提取肝组织的总RNA,然后将肝组织的总RNA浓度稀释到1 μg/μL。取稀释定量后的总RNA提取液2 μL,在其中依次加入1 μL的oligodT18、1 μL的RNase、1 μL的dNTP、1 μL的MLV酶和10 μL的5×buffer,在条件37 ℃、120 min,99 ℃、4 min,4 ℃、3 min合成cDNA。然后以反转录-聚合酶链反应法扩增Mn-SOD、Gu/Zn-SOD、CAT、GSH-Px、NF-κB-p65、IκB-α、iNOS和COX-2的mRNA表达(见表1),同时以持家基因GAPDH作为内参照按同样条件进行扩增。最后用含1%溴化乙锭琼脂电泳检查PCR扩增产物[17]。半定量分析按以下公式计算:表达相对模型组倍数=(样品组表达强度÷对应组GAPDH表达强度)÷(模型组表达强度÷模型组GAPDH表达强度)。其中样品组指正常组,PEK低剂量组、PEK高剂量组和水飞蓟素灌胃组。
1.3 数据统计
使用SAS 9.1统计学软件对平行实验结果进行one-way ANOVA方法分析,判断各组数据在p<0.05水平上是否具有显著性差异。
2 结果与分析
2.1 苦丁茶多酚提取物的含量
按照1.2.2节方法绘制绿原酸标准液的标准曲线,得出标准曲线的回归方程为Y=0.215X-0.002(R2=0.998),Y为绿原酸浓度,X为吸光度值。通过标准曲线计算可知提取纯化后的苦丁茶多酚(绿原酸计)的含量达到71.3%。
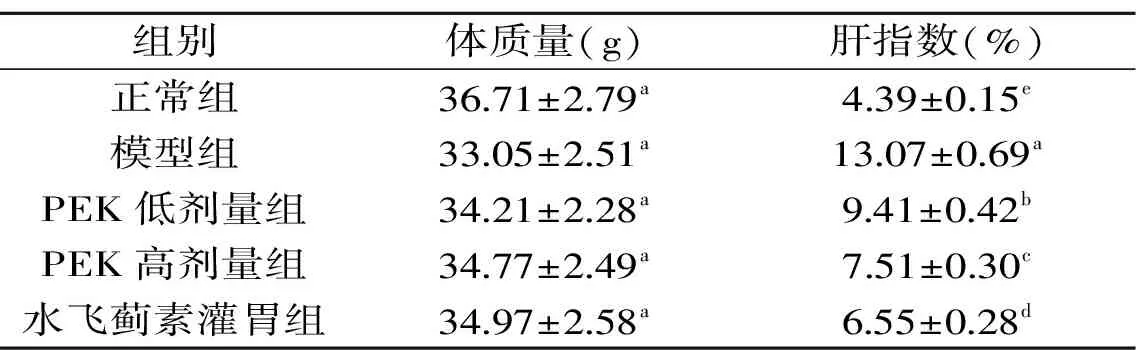
表2 各组小鼠的肝指数Table 2 Liver index of mice in different groups
注:字母不同表示组间存在显著差异(p<0.05),表3~表7同。
2.2 苦丁茶多酚提取物对小鼠肝指数的影响
肝脏是机体的重要器官,肝脏出现损伤后,将出现肝指数提高的现象,四氯化碳作为实验性肝损伤诱导剂,可使动物的肝指数增大,通过计算肝指数可以快速判断肝损伤程度[18]。如表2所示,模型组小鼠的肝指数显著高于其他各组(p<0.05),水飞蓟素灌胃组小鼠的肝指数显著低于模型组,随着PEK浓度的提高,PEK灌胃组小鼠的肝指数显著下降(p<0.05)。
2.3 苦丁茶多酚提取物对小鼠血清生化指标的影响
AST和ALT是重要的转氨酶,常作为肝功能检查的指标,用来判断肝脏是否受到损害,主要存在于肝细胞浆内,是一种重要的转氨酶,肝细胞坏死会导致ALT和AST在血清内增加[19]。四氯化碳可导致肝组织发生严重的脂质过氧化反应,造成干细胞坏死和组织纤维化,此过程中肝组织的ALP水平急剧上升[20]。四氯化碳诱导的肝损伤能使脂肪酸向肝组织内转移,造成肝组织的TG含量的上升,同时TC也是肝损伤造成脂质过氧化的表现,肝损伤发生后由于脂质过氧化TG和TC含量均增加[21]。肝损伤后也进一步对肾功能造成影响,使蛋白质代谢的产物BUN在机体中的含量升高,同样由于肝损伤对机体合成、运输和释放ALB的影响,机体的ALB含量也下降[22]。
由表3可知,与正常组相比,四氯化碳处理组小鼠血清中AST、ALT、ALP、TG、TC、BUN水平显著升高(p<0.05),而ALB水平显著降低(p<0.05),表明四氯化碳对小鼠肝组织造成了损伤,造模成功。PEK灌胃可以显著缓解四氯化碳造成的AST、ALT、ALP、TG、TC、BUN水平升高和ALB水平降低(p<0.05),且高浓度的PEK效果更为明显,其中高浓度的PEK灌胃可以使BUN和ALB水平与药物水飞蓟素灌胃达到相似的效果。

表3 各组小鼠血清AST、ALT、ALP、TG、TC、BUN和ALB的水平Table 3 AST,ALT,ALP,TG,TC,BUN and ALB serum levels of mice in different groups

表4 各组小鼠血清SOD、NO、CAT、MDA和GSH-Px的水平Table 4 SOD,NO,CAT,MDA and GSH-Px serum levels of mice in different groups

表5 各组小鼠血清IL-6、IL-12、TNF-α和IFN-γ细胞因子水平的影响Table 5 IL-6,IL-12,TNF-α and IFN-γ serum cytokine levels of mice in different groups
2.4 苦丁茶多酚提取物对小鼠血清SOD、NO、CAT、MDA和GSH-Px水平的影响
四氯化碳在肝脏将引起强烈的氧化反应,提高动物体内SOD、CAT和GSH-Px的活力是通过酶性抗氧化达到抗氧化作用的主要机制[21]。SOD、CAT和GSH-Px是机体内重要的抗氧化酶,而且CAT和SOD具有协同作用,可增强抗氧化效果[23-24]。GSH-Px也是一种与机体氧化线管的酶,可催化过氧化氢分解,起到保护细胞膜,避免细胞损伤的作用[25]。MDA是体内脂质过氧化产生的代谢产物,肝损伤后MDA也在肝组织内大量积累[21]。一氧化氮及其氧化产物能使细胞表面的磷脂和蛋白发生损伤,导致机体组织出现炎性渗出和组织损伤[26]。另外,一氧化氮还能使氧化应激反应加强,导致细胞毒性进一步加剧从而使肝损伤加重[27]。
由表4可知,正常组小鼠血清中的SOD、CAT、GSH-Px活力最高,而NO、MDA含量最低;而模型组小鼠的SOD、CAT、GSH-Px活力最低,NO、MDA含量最高,表明肝损伤可显著导致SOD、CAT、GSH-Px活力降低和导致NO、MDA含量升高。PEK可使肝损伤小鼠血清中的SOD、NO、CAT、MDA和GSH-Px水平接近于药物水飞蓟素的效果,且PEK高剂量灌胃使血清中的SOD、CAT、MDA和GSH-Px水平与水飞蓟素灌胃组小鼠无显著差异(p>0.05)。由此可以看出,PEK可以提高肝损伤小鼠血清的抗氧化酶活力,起到改善肝损伤的作用。
2.5 苦丁茶多酚提取物对小鼠血清细胞因子水平的影响
IL-6、IL-12、TNF-α和IFN-γ是重要的细胞炎症因子,机体出现炎症反应后其含量在体内大幅度上升[23]。IL-6是一种参与机体免疫应答的因子,IL-6的含量升高时可引发内脏发生功能性损害[28]。同时IL-6还能使T淋巴细胞发生分化、增殖和提升抗体含量,从而加剧机体炎症反应[29]。IL-12也是一种在体细胞过度凋亡或过强的免疫应答情况下大量体现的因子,在肝损伤出现时作用十分强烈[30]。TNF-α能导致干细胞大量凋亡;同时,TNF-α可以激活NF-κB信号通路从而增强机炎症反应,和肝损伤[31]。IFN-γ是前炎症的细胞因子,能够加强肝细胞对TNF-α的敏感性,使肝细胞更容易受损[32]。四氯化碳能够通过加剧肝组织的氧化反应,使肝脏发生强烈的炎症反应,使动物体内的IL-6、IL-12、TNF-α和IFN-γ含量上升[15]。
由表5可知,与正常组小鼠相比,模型组小鼠血清中IL-6、IL-12、TNF-α和IFN-γ细胞因子水均显著升高(p<0.05),说明四氯化碳造模肝损伤后小鼠肝脏出现炎症,使小鼠体内出现炎症反应。与模型组小鼠相比,PEK低剂量组、PEK高剂量组和水飞蓟素灌胃组均能显著降低以上细胞因子水平。可见,PEK能够降低小鼠血清中IL-6、IL-12、TNF-α和IFN-γ细胞因子水平,达到降低小鼠体内炎症水平的目的,从而通过减轻炎症反应实现减轻肝损伤的作用。
2.6 苦丁茶多酚提取物对小鼠肝组织病理学变化的影响
如图1所示,正常组小鼠肝组织细胞结构正常,肝细胞以中央静脉为中心呈放射状分布;模型组小鼠肝组织细胞排列不均,中央静脉呈现不规则,细胞结构被破坏,出现大量细胞坏死。PEK和水飞蓟素均能够减轻四氯化碳对肝细胞造成的坏死以及肝组织形态不完整,其中高浓度的PEK效果更为明显,接近药物水飞蓟素。
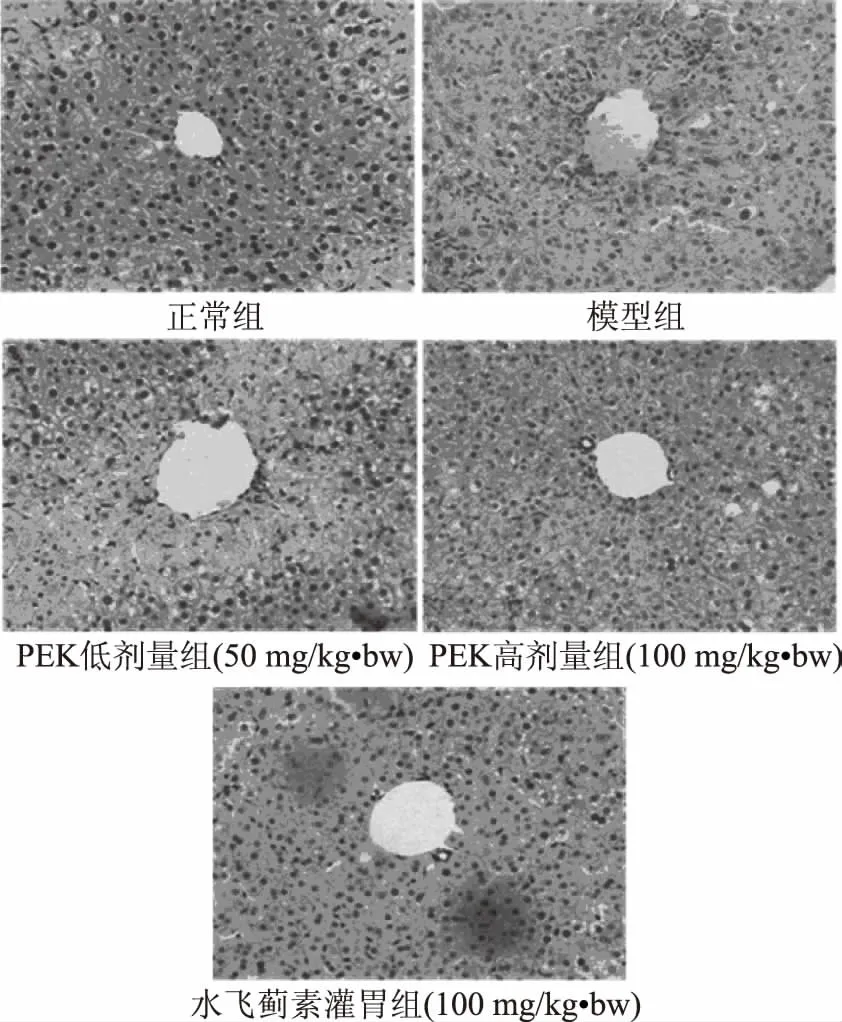
图1 各组小鼠肝组织的病理学变化(200×)Fig.1 Pathological observation of liver of mice in different group(200×)

表6 各组小鼠肝组织中Mn-SOD、Gu/Zn-SOD、CAT和GSH-Px mRNA表达的半定量分析Table 6 Semi-quantitative analysis of Mn-SOD,Gu/Zn-SOD,CAT and GSH-Px mRNA expressions in liver of mice in different groups
2.7 苦丁茶多酚提取物对小鼠肝组织中抗氧化酶mRNA表达的影响

由图2和表6可知,正常组小鼠肝组织中的Mn-SOD、Gu/Zn-SOD、CAT和GSH-Px表达水平高于其他各组小鼠(p<0.05)。四氯化碳(模型组)导致小鼠肝组织中的Mn-SOD、Gu/Zn-SOD、CAT和GSH-Px表达强度下降,PEK可以显著缓解表达下降(p<0.05),且高浓度的PEK效果更为明显,作用效果接近于水飞蓟素。

图2 各组小鼠肝组织中Mn-SOD、Gu/Zn-SOD、CAT和GSH-Px的mRNA表达Fig.2 Mn-SOD,Gu/Zn-SOD,CAT and GSH-Px mRNA expressions in liver of mice in different group
2.8 苦丁茶多酚提取物对小鼠肝组织中COX-2、IL-1β和TNF-α mRNA表达的影响
COX-2是机体内重要的炎症因子,机体组织出现炎症后大量表达,是炎症的标志性产物,肝损伤发生后由于炎症反应使肝细胞损伤,Kupffer细胞被激活,COX-2被大量的表达及合成,进而促进肝损伤的加剧[35-36]。肝脏中的Kupffer细胞可以分泌的炎性细胞因子IL-1β和TNF-α,加剧肝损伤[37]。同时,TNF-α是细胞因子网络中介导肝损伤的终末介质,能够直接促进肝损伤[38]。
由图4和表7可知,与正常组相比,四氯化碳使模型组小鼠肝脏组织中的COX-2、IL-1β和TNF-α表达显著增强(p<0.05)。与模型组相比,PEK和水飞蓟素灌胃均能下调四氯化碳造成的COX-2、IL-1β和TNF-α表达加强,且高浓度PEK灌胃组小鼠的COX-2、IL-1β和TNF-α表达显著低于低浓度PEK灌胃组,但略高于正常组和水飞蓟素灌胃组。由此可见,PEK可显著下调肝损伤小鼠的COX-2、IL-1β和TNF-α表达(p<0.05),且效果接近于相同浓度的水飞蓟素。

图3 各组小鼠肝组织中COX-2、IL-1β和TNF-α的mRNA表达Fig.3 COX-2,IL-1β and TNF-α mRNA expressions in liver mice in different group
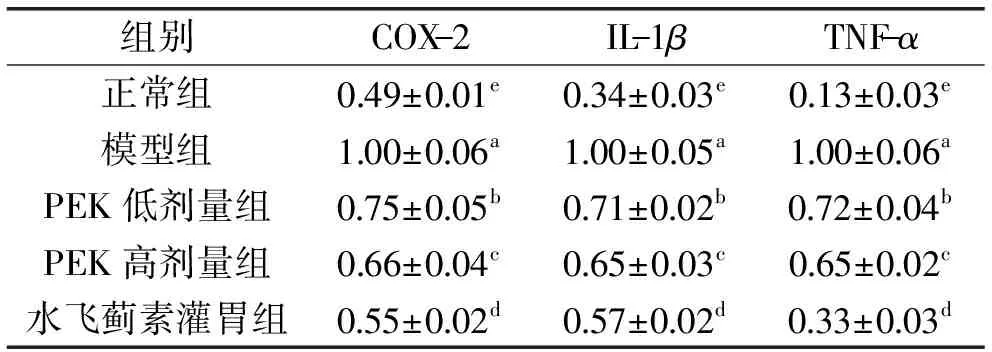
组别COX-2IL-1βTNF-α正常组0 49±0 01e0 34±0 03e0 13±0 03e模型组1 00±0 06a1 00±0 05a1 00±0 06aPEK低剂量组0 75±0 05b0 71±0 02b0 72±0 04bPEK高剂量组0 66±0 04c0 65±0 03c0 65±0 02c水飞蓟素灌胃组0 55±0 02d0 57±0 02d0 33±0 03d
3 结论
本研究通过建立动物模型观察了PEK对四氯化碳诱导肝损伤的改善作用,针对其多酚物质的肝损伤改善效果进行了机制研究。结果显示PEK可以显著缓解四氯化碳对小鼠体内血清和肝组织造成的影响,且PEK的作用接近于肝损伤治疗药物水飞蓟素。本研究是基于动物体内进行了实验,为了进一步验证PEK的作用,未来需要在临床研究中进行深入研究。基于动物体内实验的结果可以看出,PEK作为一类从天然植物中提取的有效生物活性物质,具有较好的肝损伤预防效果,具有很好的开发利用价值。
[1]张文娟,郭昱. 肝损伤修复机制的研究进展[J]. 世界华人消化杂志,2013,21(31):3369-3375.
[2]蒋华,周江,戴林峰,等. 危重病患者肝损伤的研究进展[J]. 东南大学学报(医学版),2015,34(6):1041-1044.
[3]张东梅,黄欣,闫春雷,等. 实验性肝损伤模型的研究进展[J]. 中国医院药学杂志,2013,33(22):1871-1874.
[4]Zhao X,Wang Q,Qiao Y,et al. Ilex kudingcha C.J. Tseng(Kudingcha)hasinvitroanticancer activities in MCF-7 human breast adenocarcinoma cells and exerts anti-metastatic effectsinvivo[J]. Oncology Letters,2013,5(5):1744-1748.
[5]冯霞,赵欣. 苦丁茶对SD大鼠的胃损伤预防效果[J]. 现代食品科技,2014,30(4):21-25.
[6]王睿,赵欣. 苦丁茶香气成分分析和体外功能性效果研究[J]. 食品工业科技,2013,35(8):131-134.
[7]刘佳,焦士蓉,唐远谋,等. 苦丁茶多酚的提取及抗氧化活性[J]. 食品科学,2011,32(14):134-138.
[8]Song J L,Qian Y,Li G J,et al. Anti-inflammatory effects of kudingcha methanol extract(IlexkudingchaCJ Tseng)in dextran sulfate sodium-induced ulcerative colitis[J]. Molecular Medicine Reports,2013,8(4):1256-1262.
[9]刘丽香,Tanguy Laura,梁兴飞,等. Folin-Ciocalteu比色法测定苦丁茶中多酚含量[J]. 茶叶科学,2008,28(2):101-106.
[10]孙怡,张鑫,张文芹,等. 苦丁茶冬青苦丁茶中多酚类物质的分离纯化与结构解析[J]. 食品科学,2011,32(11):60-63.
[11]陈瑞仪,谭剑斌,王凤岩,等. 苦丁茶提取物对酒精性肝损伤的保护作用[J]. 中华现代内科学杂志,2007,4(4):301-302.
[12]史秀玲,高银辉. 绿原酸对小鼠急性肝损伤的保护作用[J]. 中国实验方剂学杂志,2011,17(19):199-202.
[13]许文清. 苦丁茶冬青苦丁茶多酚类物质的生物活性及分离纯化研究[D]. 南京:南京农业大学,2010:39-49.
[14]孙怡. 冬青苦丁茶多酚和多糖的提取、分离纯化、结构与抗氧化活性研究[D]. 南京:南京农业大学,2010:29-30.
[15]王睿,孙鹏,赵欣. 虫茶粗多糖对四氯化碳诱导小鼠肝损伤预防效果研究[J]. 现代食品科技,2015,31(5):6-11.
[16]易若琨,赵欣. 太明清对扑热息痛致小鼠肝损伤的保护作用[J]. 现代食品科技,2015,31(1):11-15.
[17]Liu Y,Wang X,Jia Y,et al. Effects of bufalin on the mTOR/p70S6K pathway and apoptosis in esophageal squamous cell carcinoma in nude mice[J]. International Journal of Molecular Medicine,2017,40(2):357-366.
[18]黄铁军,余琼华,戴列军. 虾青素对四氯化碳诱导的慢性肝损伤大鼠的保护作用[J]. 实用肝脏病杂志,2014,17(4):404-407.
[19]Tan Y,Kim J,Cheng J,et al. Green tea polyphenols ameliorate non-alcoholic fatty liver disease through upregulating AMPK activation in high fat fed Zucker fatty rats[J]. World Journal of Gastroenterology,2017,23(21):3805-3814.
[20]杨云,胡筱希,周凌凌,等. 龙葵多糖对CCl4致急性肝损伤小鼠的保护作用研究[J]. 中成药,2014,36(12):2602-2605.
[21]罗慧英,刘渊,席国柱,等. 肉苁蓉总苷对小鼠酒精性肝损伤的保护作用[J]. 中国临床药理学与治疗学,2009,14(11):1225-1228.
[22]易若琨,赵欣. 太明清对扑热息痛致小鼠肝损伤的保护作用[J]. 现代食品科技,2015,31(1):11-15.
[23]El-Newary S A,Shaffie N M,Omer E A. The protection of Thymus vulgaris leaves alcoholic extract against hepatotoxicity of alcohol in rats[J]. Asian Pacific Journal of Tropical Medicine,2017,10(4):361-371.
[24]艾青,葛璞,代洁,等. 过氧化氢酶抑制剂氨基三唑减轻急性酒精性肝损伤[J]. 生理学报,2015,67(1):97-102.
[25]赵翠霞,袁雪芬,孙莉,等. 香参软胶囊对溴代苯致肝损伤小鼠肝组织中MDA、GSH-Px的影响[J]. 中国卫生检验杂志,2010,20(12):3270-3270.
[26]Suo H Zhao X,Qian Y. Lactobacillus fermentum Suo attenuates HCl/ethanol induced gastric injury in mice through its antioxidant effects[J]. Nutrients,2016,8(3):155.
[27]Ouelaa W,Jegatheesan P,M’bouyou-Boungou J,et al. Citrulline decreases hepatic endotoxin-induced injury in fructose-induced non-alcoholic liver disease:an ex vivo study in the isolated perfused rat liver[J]. British Journal of Nutrition,2017,117(11):1487-1494.
[28]Chen Y,Guo J,Qian G,et al. Gut dysbiosis in acute-on-chronic liver failure and its predictive value for mortality[J]. Journal of Gastroenterology and Hepatology,2015,30(9):1429-1437.
[29]王春妍,杨世忠,迟宝荣,等. TNF-α,IL-6及ICAM-1在急性肝损伤时肠源性内毒素血症中的作用[J]. 中国老年学杂志,2008,28(5):960-961.
[30]姜雪强,程良斌. 二草清肝汤抗大鼠免疫性肝损伤作用机制的研究[J]. 中西医结合肝病杂志,2006,16(3):158-159.
[31]Deng Y,Tang Q,Zhang Y,et al. Protective effect of Momordica charantia water extract against liver injury in restraint-stressed mice and the underlying mechanism[J]. Food & Nutrition Research,2017,61(1):1348864.
[32]张国良,黄川锋. 芦荟苷对急性肝损伤小鼠NO和IFN-γ的影响[J]. 中药药理与临床,2010,26(1):27-29.
[33]刘朝明,杨红,石达友,等. 氨基胍对山羊内毒素血症心肌抗氧化能力的影响[J]. 华南农业大学学报,2010,31(3):79-82.
[34]Medeiros MH,Wefers H,Sies H,et al. Generation of excited species catalyzed by horseradish peroxidase or hemin in the presence of reduced glutathione and H2O2[J]. Free Radical Biology & Medicine,1987,3(2):107-110.
[35]Martín-Sanz P,Mayoral R,Casado M,et al. COX-2 in liver,from regeneration to hepatocarcinogenesis:what we have learned from animal models?[J]. World Journal of Gastroenterology,2010,16(12):1430-1435.
[36]Wójcik M,Ramadori P,Blaschke M,et al. Immunodetection of cyclooxygenase-2(COX-2)is restricted to tissue macrophages in normal rat liver and to recruited mononuclear phagocytes in liver injury and cholangiocarcinoma[J]. Histochemistry and Cell Biology,2012,137(2):217-233.
[37]Liu L M,Tu W J,Zhu T,et al. IRF3 is an important molecule in the UII/UT system and mediates immune inflammatory injury in acute liver failure[J]. Oncotarget,2016,7(31):49027-49041.
[38]Li X,Wang L,Chen C,et al. Effects of exogenous thymosinβ4 on carbon tetrachloride-induced liver injury and fibrosis[J]. Scientific Reports,2017,7(1):5872.
