超高效液相色谱-串联质谱法同时测定蜂蜜中8种生物胺
2018-04-13,,,
, , ,
(1.西北大学分析科学研究所,陕西西安 710069; 2.西北大学化工学院,陕西西安 710069; 3.河南科技学院,河南新乡 453003)
生物胺是一类含氮的小分子量碱性有机化合物,广泛存在于动植物的组织和多种发酵与非发酵食品中,如:乳制品、酒、肉制品、水产品等[1-2]。食品中的生物胺生成途径主要有以下几类:由机体自身细胞代谢过程产生。此为内源性生物胺有助于维持细胞膜的稳定性,其含量较低[3-4];由醛或酮通过氨基化和转胺作用产生,其量较少;在食品加工和贮藏过程中,由于被微生物侵染,微生物释放氨基酸脱羧酶并催化氨基酸脱羧途径生成[5-6],大部分生物胺在此过程形成。
蜂蜜中含有少量蛋白质和多种游离氨基酸[7],具有多种适宜微生物生长繁殖的营养物质,且在酸性环境下容易生成生物胺,因此在加工、储存和运输过程中易被微生物侵染引起发酵从而产生生物胺,存在危害消费者健康的潜在危险。过量摄入生物胺后会引发人体不适、损害人体健康,如组胺、酪胺等[8]。目前很少有关蜂蜜中生物胺种类及含量的研究报道,也未见蜂蜜中生物胺的相关限量标准,因此,有必要建立一种快速有效检测蜂蜜中生物胺的方法。
生物胺的常见检测方法有毛细管电泳法(CE)[9-10]、酶联免疫吸附法(ELISA)[11-12]、生物传感器法(Biosensor)[13-14]、化学比色法[15]、离子色谱法(IC)[16-17]、薄层色谱法(TLC)[18-19]、气相色谱法(GC)[20-21]、高效液相色谱法(HPLC)[22-25]和超高效液相色谱-串联质谱法(UHPLC-MS)[26-27]等。由于UHPLC-MS方法具有分析速度快、检测灵敏度高、定量分析准确的特点,且蜂蜜样品基质复杂,大大增加了同时测定8种生物胺的难度,此外,生物胺本身没有紫外和荧光吸收基团,需对生物胺进行衍生化,衍生后的生物胺极性减小,有利于实现其在色谱柱上的分离。因此,本文采用UHPLC-MS技术结合丹磺酰氯柱前衍生法同时测定蜂蜜中8种常见生物胺的含量与分布,以期能为市售蜂蜜质量安全控制提供可靠依据。
1 材料与方法
1.1 材料与仪器
32个蜂蜜样品样品信息如表1;组胺(Histamine,HIS)、色胺(Tryptamine,TR)、酪胺(Tyramine,TYR)、精胺(Spermine,SP)、亚精胺(Spermidine,SPD)、2-苯乙胺(Phenylethylamine,PHE)、尸胺(Cadaverine,CAD)、腐胺二盐酸盐(Putrescine dihydrochloride)标准品纯度均大于99%,北京百灵威科技有限公司;浓盐酸、无水碳酸钠、碳酸氢钠北京化工厂;三氯乙酸济宁宏明化学试剂有限公司;5-磺基水杨酸天津市北联精细化学品开发有限公司;高氯酸国药集团化学试剂有限公司;丹磺酰氯衍生剂美国Sigma公司;乙腈、丙酮、甲酸、乙酸乙酯均为色谱纯,美国MREDA公司。

表1 蜂蜜样品信息Table 1 The information of honey samples
Agilent 1290超高效液相色谱仪、6495三重四级杆串联质谱仪美国Agilent公司;Inolab pH level 1酸碱度计(720型)德国WTW公司;十万分之一天平上海梅特勒-托利多仪器有限公司;Milli-Q纯水发生器美国Millipore公司;CR22G高速冷冻离心机日本日立公司;G560E涡旋混匀器美国Scientific Industries公司;N-EVAP112氮气吹干仪美国OA-SYS公司。
1.2 实验方法
1.2.1实验所需溶液的配制
1.2.1.10.1 mol/L HCl溶液的配制吸取8.33 mL 12 mol/L浓盐酸于1000 mL容量瓶中,用去离子水定容,混匀。移至锥形瓶中,密封待用。
1.2.1.2碳酸钠-碳酸氢钠缓冲溶液(pH=11.5)的配制称取18.70 g碳酸钠以及1.00 g碳酸氢钠于500 mL锥形瓶中,加入300 mL去离子水溶解,用1 mol/L NaOH溶液调节pH至11.5。
1.2.1.3丹磺酰氯丙酮溶液(10 mg/mL)的配制准确称取100 mg丹磺酰氯粉末于15 mL离心管中,加入10 mL丙酮溶解,现用现配。
1.2.1.4标准溶液的配制准确称取8种生物胺标准品各50 mg,置于 50 mL棕色容量瓶中,用0.1 mol/L HCl定容至刻度,得到1.0 mg/mL的单标储备液。在50 mL棕色容量瓶中加入8种生物胺的单标储备液各500 μL,用0.1 mol/L HCl定容至刻度,即为10 μg/mL的混合标准溶液,所有标准溶液均密封保存于4 ℃冰箱中。用于实验测定和方法验证的标准溶液需现用现配。
1.2.2pH的选择由于生物胺在碱性环境中才能与丹磺酰氯发生反应,因而本实验对样品的pH(8.0~14.0的碳酸钠-碳酸氢钠缓冲溶液)进行了研究。
1.2.3衍生剂浓度的选择为筛选更佳的衍生剂浓度,用1~14 mg/mL的丹磺酰氯衍生生物胺,并对其在高效液相色谱串联质谱上的响应做了对比研究。
1.2.4衍生温度和衍生时间的选择分别以室温-隔夜,30 ℃-90 min,40 ℃-75 min,50 ℃-30 min,50 ℃-60 min,60 ℃-15 min,60 ℃-30 min,65 ℃-15 min,65 ℃-25 min,70 ℃-10 min,70 ℃-20 min,75 ℃-10 min,80 ℃-10 min,90 ℃-5 min组合进行衍生,考察衍生温度和衍生时间对衍生效果的影响。
1.2.5衍生试剂的稳定性衍生剂丹磺酰氯粉末于-20 ℃冰箱冷冻室内避光保存,现用现配。分别在衍生剂开封当天及开封后不同时间配制丹磺酰氯丙酮溶液,与相对较稳定的尸胺标准溶液进行衍生化反应来考察衍生试剂的稳定性。
1.2.6样品前处理样品处理方法参照Sanghee Lee等人[27]的方法,准确称取1.00 g蜂蜜样品于50 mL离心管中,加入15 mL 5% 三氯乙酸溶液,涡旋混合均匀,置于4 ℃冰箱中避光过夜以沉淀样品中的蛋白。将过夜后的样品于4 ℃下8000 r/min离心10 min。取1 mL上清液于10 mL离心管中,加入1 mL pH=11.5的碳酸钠-碳酸氢钠缓冲溶液,充分混匀后,再加入1 mL 10 mg/mL的丹磺酰氯丙酮溶液,迅速混匀后,于60 ℃下避光衍生15 min。衍生后将样品避光冷却至室温,用2 mL乙酸乙酯萃取两次,合并有机相,加入1.5 mL去离子水洗涤,收集有机相,氮气吹干后采用1 mL乙腈复溶,再过尼龙滤膜(0.22 μm),后进行UHPLC-MS/MS样品分析。配制标准品除不需去蛋白步骤,其它步骤同样品处理方法。
1.2.7色谱和质谱条件
1.2.7.1色谱条件本实验选择色谱柱Agilent Poroshell 120 SB-C18(50 mm×2.1 mm,2.7 μm),以0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B)作为流动相,流速为0.3 mL/min,柱温为40 ℃,进样量为5 μL。洗脱程序:0~1 min,B为30%;1~5 min,B为30%~80%;6.5~7.5 min,B为80%~100%;9.0~9.5 min,B为100~30%;9.5~12.5 min,B为30%。
1.2.7.2质谱条件离子源:离子漏斗,电喷雾离子源(ESI);扫描方式:正离子扫描方式;监测模式:多反应监测(MRM)模式;气体温度(Gas Temp):200 ℃;干燥器流速(Gas Flow):15 L/min;雾化器压力(Nebulizer):40 psi;鞘流气气体温度(Sheath Gas Temp):350 ℃;鞘流气气体流速(Sheath Gas Flow):11 L/min;毛细管电压:4000 V;喷嘴电压:1000 V。
1.2.8基质效应本实验通过稀释来减少蜂蜜样品的基质效应,为考察稀释倍数对基质效应的影响,用乙腈将已处理好的蜂蜜样品分别稀释2、5、10、20、50、100、200倍,分别测定各样品中生物胺含量,再乘以各稀释倍数后与未稀释样品中生物胺含量进行对比。
1.2.9方法学考察为考察分析方法的可靠性,用8种生物胺标准品对方法做了线性范围、检出限、回收率及精密度的测定。
2 结果与分析
2.1 样品前处理条件的选择
由于蜂蜜样品中的蛋白会与丹磺酰氯发生反应,影响样品中生物胺的含量测定,因此,在衍生化反应之前,需进行除蛋白处理。本实验选择三氯乙酸作为蛋白质的沉淀试剂。
2.1.1pH的选择以缓冲溶液的pH为横坐标,各生物胺的色谱峰面积(以百万为单位)的相对百分比为纵坐标作图。从图1中可看到,色胺、腐胺、尸胺在pH为9.5时有最大生成量,在pH为11.5时略有减少,但其余6种生物胺此时有最大生成量,最终选择pH为11.5的碳酸钠-碳酸氢钠缓冲溶液来处理样品。这与前人[28-29]的研究结果一致。

图1 生物胺衍生物的生成量随缓冲溶液pH升高的变化趋势Fig.1 The change of biogenic amine derivatives under different pH conditions of buffer solution
2.1.2衍生剂浓度的选择以丹磺酰氯衍生剂的浓度为横坐标,各生物胺的色谱峰面积(以百万为单位)的相对百分比为纵坐标作图,图2表示生物胺衍生产物的生成量随衍生剂丹磺酰氯浓度变化的变化趋势。结果显示8种标样均在衍生剂浓度为10 mg/mL时,衍生物的生成量达到最大,再增加浓度,基本不变。因此,10 mg/mL为最佳衍生剂浓度,这与杨贤庆等人[30]的研究结果一致。

图2 生物胺衍生产物的生成量随衍生剂浓度变化的变化趋势Fig.2 The change of biogenic amine derivatives with the different concentration of derivation agent
2.1.3衍生温度和衍生时间的选择不同温度和时间的组合条件下均能衍生成功,且生物胺衍生物的种类一致、生成量基本相同。但考虑到省时、节能等因素,选择60 ℃水浴15 min为实验最终衍生条件。
2.1.4衍生试剂的稳定性分别在衍生剂开封当天及开封后10、20、30、60、90、120 d配制的10 mg/mL的丹磺酰氯丙酮溶液,与尸胺标准溶液(1 μg/mL)进行衍生化反应,利用UHPLC-MS方法检测生物胺衍生物的含量。以衍生剂开封当日配制的溶液生成的尸胺衍生物的量为基准,丹磺酰氯在30 d内的衍生效果基本稳定,之后配制的衍生剂溶液与尸胺反应生成的衍生物量开始下降,因此,丹磺酰氯衍生剂开封后可在-20 ℃条件下避光保存1个月左右。
2.2 色谱与质谱条件的优化

表2 8种生物胺的结构信息及质谱条件Table 2 MRM acquisition settings for the dansyl derivatives of 8 BAs
注:“a”表示定量离子对。
为选择流动相,本实验对比了有机相分别为甲醇和乙腈以及是否加甲酸的流动相组成条件下8种生物胺的响应值和峰形。结果发现加入甲酸不仅能提高目标物的分离效果还能改善峰形,乙腈为流动相时响应比甲醇更高,因此,选择0.1%甲酸水溶液-0.1%甲酸乙腈溶液作为流动相比较合适。另外,还比较了三种色谱柱:Agilent ZORBAX SB-C18(50 mm×2.1 mm,3.5 μm)、Phenomenex Kinetex C18(50 mm×2.1 mm,2.6 μm)、Agilent Poroshell 120 SB-C18(50 mm×2.1 mm,2.7 μm)的分离性能,结果表明8种目标分析物可以在Agilent Poroshell 120 SB-C18(50 mm×2.1 mm,2.7 μm)完全分离,峰型尖锐对称无拖尾现象,且该色谱柱对于目标物的保留和分离能力明显高于其他两个色谱柱。图3为8种生物胺标准品的色谱图。

图3 生物胺标准品的色谱图Fig.3 Chromatogram of the 8 standard mixtures注:1:色胺,TR;2:2-苯乙胺,PHE;3:腐胺,PUT;4:尸胺:CAD; 5:组胺,HIS;6:酪胺,TYR;7:亚精胺,SPD;8:精胺,SP。
生物胺结构上N原子具有孤对电子,容易接受质子呈碱性即容易加和氢离子生成带有正电荷的离子,故选择电喷雾正离子(ESI+)扫描方式,根据[M+H]+离子找到分子离子峰。在MRM模式下对目标物进行子离子扫描,进而优化碰撞能量、驻留时间及离子加速电压,在MRM监测模式下选取定性和定量离子作为特征离子对,具体质谱条件优化结果见表2。
2.3 基质效应

表3 8种生物胺的线性关系及检出限、定量限Table 3 Linearities,LODs,and LOQs of the standard BAs
在液质联用方法中的基质效应是由分析物的共流出组分影响电喷雾接口的离子化效率所致,会使离子强度增加或降低,从而影响检出限、定量限以及实验结果的准确性。由于本实验的样品中均含少量生物胺,且没有空白基质样品,因此,只能通过稀释来减少基质效应。初步研究表明稀释后的蜂蜜样品中生物胺的含量均高于未稀释的样品,说明蜂蜜基质对于测定生物胺结果具有抑制作用,而对样品进行稀释能够降低抑制作用。随着稀释倍数的增加,乘以稀释倍数后可检测到的生物胺含量逐渐升高,20倍时达最高,此后含量基本保持不变。因此,本实验选取最佳稀释倍数为20倍,这与Stahnke等[31]研究结果一致。
2.4 方法的线性范围及检出限
由于8种生物胺的检测灵敏度差异很大,配制混合标准溶液是根据各生物胺的响应灵敏度高低进行浓度差异配制。混合标准溶液中SPD、SP的质量浓度范围为5~500 μg/L,TR、PHE、PUT、CAD、TYR、HIS的质量浓度范围为1~500 μg/L。标准曲线以各生物胺色谱峰面积与其对应的质量浓度(μg/L)呈线性关系,各标准曲线的相关系数均大于0.99。逐级稀释生物胺混合标准溶液,当信噪比(S/N)为3和10时确定为各生物胺的检出限(LOD)和定量限(LOQ)。结果表明该方法的检出限(LODs)为0.01~0.51 μg/L,定量限(LOQs)为0.03~1.67 μg/L,具体结果见表3。
2.5 回收率和精密度
在已知各生物胺含量的蜂蜜样品中分别添加100、500、1000 μg/kg的混合标准溶液,按已优化的样品处理方法进行前处理,平均回收率为76%~112%。为评价方法精密度,每日平行测定5次,连续进行3 d。结果表明日内精密度(n=5)均小于等于9.8%,日间精密度(n=15)均小于等于13.1%,表4为各生物胺的回收率和精密度。
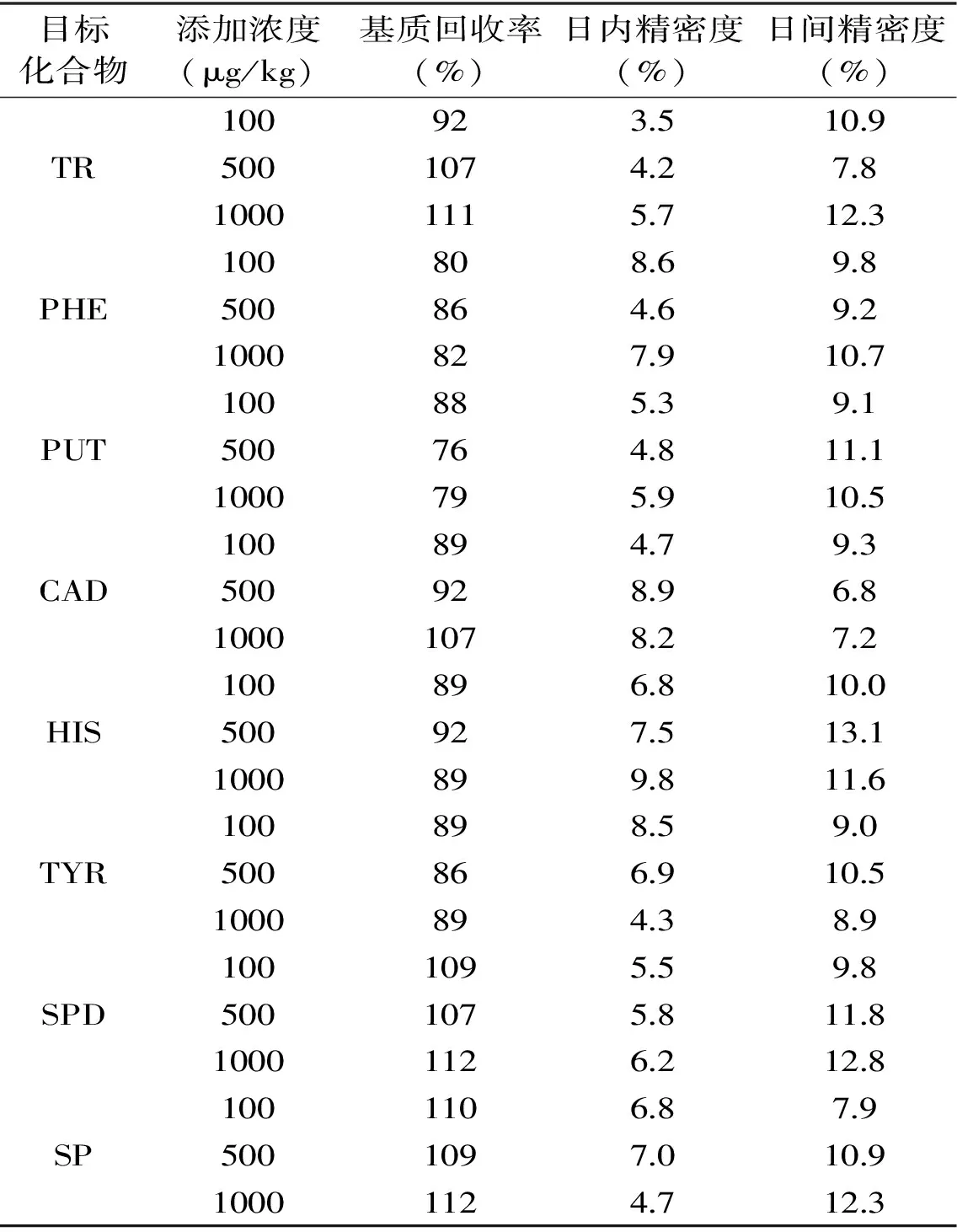
表4 8 种生物胺的基质回收率及精密度Table 4 Recoveries,intra-day(n=3)and inter-day (n=5)precision data for 8 standard BAs
2.6 实际蜂蜜样品的测定
按上述优化方法对22种不同植物源市售蜂蜜样品进行了检测,图4为枣花蜜的总离子流图及色胺和2-苯乙胺的MRM图谱。22种蜂蜜样品中生物胺的种类及含量总结如表5所示,结果显示色胺(TR)、2-苯乙胺(PHE)、腐胺(PUT)、尸胺(CAD)、组胺(HIS)、酪胺(TYR)、亚精胺(SPD)和精胺(SP)共8种生物胺分别在32个蜂蜜样品中检出,其中,色胺仅存在于枣花蜜中,平均含量为192.6 μg/kg,这可能与枣花蜜独特的酸性环境有关。Koessler等[32]认为合成生物胺是为了抵抗酸性环境而产生的一种应激反应,由于色氨酸是在脱羧酶的作用下生成的色胺,而氨基酸脱羧酶的活性最适pH是4.0~5.5,因此,枣花蜜较低的pH为色胺的生成提供了有利条件。2-苯乙胺和腐胺在所有蜂蜜样品中均能检出,含量范围不等。2-苯乙胺平均含量为670.5 μg/kg,但在3个椴树蜜样品中含量尤高。另外鸭脚木蜂蜜也检测到高含量的2-苯乙胺,但是一个样品不具代表性,其具体原因有待深入研究。腐胺平均含量为65.9 μg/kg,其中欧洲百花蜜(黑蜂蜂种)及葵花蜂蜜较其余植物源的蜂蜜的含量都高。欧洲百花蜜及葵花蜂蜜腐胺含量高的原因可能跟蜂种和植物源有关。只有少量蜂蜜样品中可检测到尸胺、组胺、酪胺、亚精胺和精胺,尸胺在可检出蜂蜜样品中含量均在30 μg/kg以下;组胺仅在葵花蜜和欧洲百花蜜(黑蜂蜂种)中被检出,含量分别为22.0和15.9 μg/kg;酪胺在14个蜂蜜样品中检出,平均含量为48.0 μg/kg;组胺和酪胺的毒性较高,一般认为发酵食品中允许的组胺含量范围在50~100 mg/kg,酪胺为100~800 mg/kg[33]。但结果表明其在蜂蜜中含量很低,对人体健康不会产生危害。亚精胺也仅在葵花蜜和欧洲百花蜜(黑蜂蜂种)中被检出,含量分别为58.2 μg/kg和47.1 μg/kg。而精胺仅在葵花蜜中被检测到,含量为15.6 μg/kg。
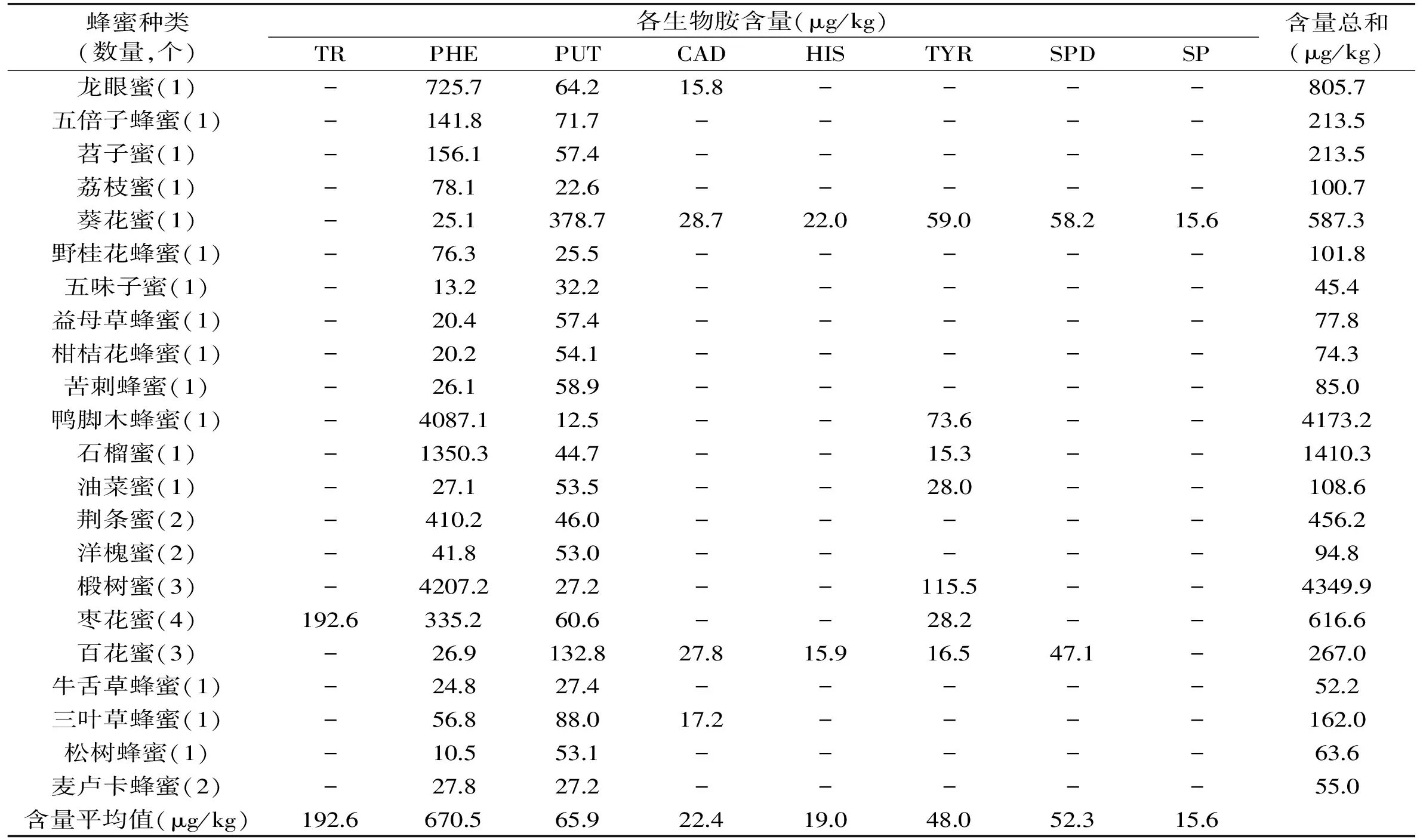
表5 22种不同植物源的蜂蜜样品中生物胺的种类及含量分布Table 5 Distributions and levels of BAs in 22 kinds of honey samples from different botanical origins
注:“-”表示没有检出;同种蜂蜜的数量>1时,含量为平均值。

图4 枣花蜜的特征图谱及其主要峰的MRM图谱(色胺和2-苯乙胺)Fig.4 Representative chromatogram of data honey and MRM chromatograms of the main peaks(TR and PHE)
不同植物源的蜂蜜中生物胺的总含量也相差较大,范围在45.4~4349.9 μg/kg之间。五味子蜂蜜生物胺总含量最低,只含有2-苯乙胺和腐胺两种生物胺,且含量均很低。椴树蜜因其所含2-苯乙胺的含量很高,因而生物胺总含量最高。葵花蜜和百花蜜含有的生物胺种类较多,分别为7种和6种,其他植物源的蜂蜜一般含有2~4种生物胺。另外,枣花蜜中特有的色胺和椴树蜜中较高含量的2-苯乙胺均可作为其潜在的花源标志物。
蜂蜜中生物胺含量与分布的显著差异,很可能与蜜种、蜂种、地理源及其他因素相关,具体影响机制和相关性还有待深入研究。
3 结论
本文建立了超高效液相色谱-串联质谱仪结合柱前衍生方法对常见商品种类的蜂蜜中生物胺的种类及含量分布进行了调查研究。该方法对于蜂蜜中生物胺定性和定量检测具有较高的灵敏度、准确性和可靠性,满足蜂蜜中生物胺检测和分析的需要,为蜂产品行业制定相关限量标准提供了基础数据,有利于进一步研究植物源、地理源、蜂种及其他因素对蜂蜜中生物胺种类及含量的相关性。
[1]李志军,吴永宁,薛长湖. 生物胺与食品安全[J]. 食品与发酵工业,2004,30(10):84-91.
[2]Shalaby A R. Significance of biogenic amines to food safety and human health[J]. Food Research International,1996,29(7):675-690.
[3]Esti M,Volpe G,Massignan L,et al. Determination of amines in fresh and modified atmosphere Packaged fruits using electrochemical biosensors[J]. Journal of Agricultural and Food Chemistry,1998,46(10):4233-4237.
[4]Tassoni A,van Buuren M,Franceschetti M,et al. Polyamine content and metabolism in Arabidopsis thaliana and effect of spermidine on plant development[J]. Plant Physiology and Biochemistry,2000,38(5):383-393.
[5]Eitenmiller R R. Enzymatic Mechanisms for Amine Formation in Fish[M]. ACS Symposium series American Chemical Society,1984,262:431-442.
[6]Tassoni A,Germana M,Bagni N. Free and conjugated polyamine content inCitrussinensisOsbeck,cultivar Brasiliano N.L. 92,a Navel orange,at different maturation stages[J]. Food Chemistry,2004,87(4):537-541.
[7]孙长波,张晶. 蜂蜜化学成分研究概况[J]. 农业与技术,2014(8):242-243.
[8]丁卓平,刘辰麒,陈迪,等. 高效液相色谱法同时测定水产品中 10 种生物胺的研究[J]. 分析测试学报,2006,25(4):59-62.
[9]Rossano R,Mastrangelo L,Ungaro N,et al. Influence of storage temperature and freezing time on histamine level in the European anchovyEngraulisencrasicholus(L.,1758):A study by capillary electrophoresis[J]. Journal of Chromatography B,2006,830(1):161-164.
[10]Zhang L Y,Tang X C,Sun M X. Simultaneous determination of histamine and polyamines by capillary zone electrophoresis with 4-fluor-7-nitro-2,1,3-benzoxadiazole derivatization and fluorescence detection[J]. Journal of Chromatography B,2005,820(2):211-219.
[11]Marcobal A,Polo M C,Martn-álvarez P J,et al. Biogenic amine content of red Spanish wines:comparison of a direct ELISA and an HPLC method for the determination of histamine in wines[J]. Food Research International,2005,38(4):387-394.
[12]Serrar D,Brebant R,Bruneau S,et al. The development of a monoclonal antibody-based ELISA for the determination of histamine in food-application fishery products and comparison with HPLC assay[J]. Food Chemistry,1995,54:85-91.
[13]Draisci R,Volpe G,Lucentini L. Determination of biogenic amines with an electrochemical biosensor and its application to salted anchovies[J]. Food Chemistry,1998,62(2):225-232.
[14]Tombelli S,Mascini M. Electrochemical biosensor for biogenic amines-a comparison between different approaches[J]. Analytica Chimica Acta,1998,358:277-284.
[15]赖小玲,何志军,陈华絮,等. 几种海产品储藏期间组胺含量及其品质的变化[J]. 食品科学,2007,28(1):333-336.
[16]Favaro G,Pastore P,Saccani G,et al. Determination of biogenic amines in fresh and processed meat by ion chromatography and integrated pulsed amperometric detection on Au electrode[J]. Food Chemistry,2007,105(4):1652-1658.
[17]Draisci R,Giannetti L,Boria P,et al. Improved ion chromatography-integrated pulsed amperometric detection method for the evaluation of biogenic amines in food of vegetable or animal origin and in fermented foods[J]. Journal of Chromatography A,1998,798:109-116.
[18]Shalaby A R. Multidetection,semiquantitative method for determining biogenic amines in foods[J]. Food Chemistry,1995,52(4):367-372.
[19]Shalaby A R. Simple,rapid and valid thin layer chromatographic method for determining biogenic amines in foods[J]. Food Chemistry,1999,65(1):117-121.
[20]Antoine F R,Wei C,Otwell W,et al. Gas chromatographic analysis of histamine in mahi-mahi(Coryphaenahippurus)[J]. Journal of Agricultural and Food Chemistry,2002,50(17):4754-4759.
[21]Fernandes J O,Judas I C,Oliveria M B,et al. A GC-MS method for quantitation of histamine and other Biogenic Amines in Beer[J]. Chromatographia,2001,53(1):327-331.
[22]Vandenabeele O,Garrelly L,Ghelfenstein M,et al. Use of 2-chloroethylnitrosourea,a new type of pre-column derivatizing agent for the measurement of biogenic amines,by high-performance liquid chromatography with ultraviolet detection[J]. Journal of Chromatography A,1998,795(2):239-250.
[23]Soufleros E H,Bouloumpasi E,Zotou A,et al. Determination of biogenic amines in Greek wines by HPLC and ultraviolet detection after dansylation and examination of factors affecting their presence and concentration[J]. Food Chemistry,2007,101(2):704-716.
[24]赵庆喜,薛长湖,徐杰,等. 反相高效液相色谱_柱后衍生法分析检测鱿鱼中的生物胺[J]. 食品与生物技术学报,2007,26(3):14-19.
[25]赵中辉,林洪,徐杰. 高效液相色谱法检测牙鲆体内的生物胺[J]. 现代食品科技,2011,27(2):228-231.
[26]Lee S,Eom H S,Yoo M,et al. Determination of biogenic amines in Cheonggukjang,using ultra high pressure liquid chromatography coupled with mass spectrometry[J]. Food Science & Biotechnology,2011,20(1):123-129.
[27]Lee S,Yoo M,Shin D. The identification and quantification of biogenic amines in Korean turbid rice wine,Makgeolli by HPLC with mass spectrometry detection[J]. LWT-Food Science and Technology,2015,62(1):350-356.
[28]董伟峰,李宪臻,林维宣. 丹磺酰氯作为生物胺柱前衍生试剂衍生化条件的研究[J]. 大连轻工业学院学报,2005,24(2):115-118.
[29]Manetta A C,Di Giuseppe L,Tofalo R,et al. Evaluation of biogenic amines in wine:Determination by an improved HPLC-PDAmethod[J]. Food Control,2016,62:351-356.
[30]杨贤庆,瞿红蕾,郝淑贤,等. 高效液相色谱法测定生物胺衍生条件的优化研究[J]. 南方水产科学,2012,8(1):49-53.
[31]Stahnke H,Kittlaus S,Kempe G,et al. Reduction of matrix effects in liquid chromatography-electrospray ionization-mass spectrometry by dilution of the sample extracts:how much dilution is needed?[J]. Analatical Chemistry,2012,84(3):1474-1482.
[32]Koessler K K,Hanke M T,Sheppard M S. Production of histamine,tyramine,brochospastic and arteriospastic substance in blood broth by pure cultures of microorganisms[J]. The Journal of Infectious Diseases,1928,3:363-377.
