银白色葡萄球菌实时荧光PCR快速检测方法的建立
2018-04-12郭正洋刘钟栋王远洋陈国培兰全学刘小青
郭正洋,刘钟栋,王远洋,陈 晶,陈国培,兰全学,刘小青,*
(1.河南工业大学,河南郑州 450001;2.深圳市计量质量检测研究院,广东深圳 518131)
银白色葡萄球菌(Staphylococcusargenteus)作为一种新型葡萄球菌,与金黄色葡萄球菌极其相似[1]。早在2002年在澳大利亚就有相关报道[2],由于银白色葡萄球菌缺少合成类胡萝卜素的基因,在培养基上菌落形态呈现银白色,与部分金黄色葡萄球菌的形态一致[3],通过API生化鉴定系统和vitic2的鉴定方法,也达不到区分金黄色葡萄球菌和银白色葡萄球菌的目的[4]。目前有关银白色葡萄球菌感染的报道有限,但针对银白色葡萄球菌的致病性先后在柬埔寨[5]、尼日利亚[6]、法国[7]、斐济[8]、泰国[9]和多巴哥共和国[10]等国都有相关描述,在我们国家也有发现银白色葡萄球菌的存在[11]。有研究者认为银白色葡萄球菌与金黄色葡萄球菌会以同样的方式威胁人体健康[12],在泰国侵袭性葡萄球菌引起的败血症,其中五分之一是有银白色葡萄球菌导致的[1314];在澳大利亚的一项研究中发现,银白色葡萄球菌会导致皮肤感染和软骨症[1]。因此,加强对该菌的认识了解,提高对它的重视,加强对它的监测管理已刻不容缓。
Taqman实时荧光PCR技术从众多检测技术中脱颖而出,它不仅具有快速、简便、灵敏等优点,而且与普通PCR方法相比,由于引物和探针的“双保险”,因此特异性更强、自动化程度更高,并实现了实时在线检测,同时适用范围广泛,目前已经成为一种常用分子生物学检测技术[15]。而非核糖体多肽合成酶基因(NRPS)在金黄色葡萄球菌和银白色葡萄球菌中都有存在,但在两种菌种之间该基因一段序列存在明显差异,这就有利于开发分子学方法进行区别验证。本文根据NRPS基因设计引物探针,建立一种Taqman实时荧光PCR的方法快速检测银白色葡萄球菌。
1 材料与方法
1.1 材料与仪器
实验所需标准菌株 广州环凯微生物科技有限公司代为购买(表1);Premix预混合液RR390A(TAKALA) 由广州环凯微生物科技有限公司;引物和探针 均由上海生物工程股份有限公司合成;所用培养基 北京陆桥技术股份有限公司;血琼脂平板 郑州安图生物工程股份有限公司。

表1 实验菌株Table 1 Experimental strains
330K冷冻离心机 Sigma公司;ND1000分光光度计 Gene Company Limited;实时荧光PCR仪MX3005P 美国安捷伦公司;金属干浴器D1100 Labnet International公司;凝胶成像系统、电泳仪 BioRad公司;恒温振荡器 上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 引物及探针 根据NCBI上已经公布的银白色葡萄球菌的非核糖体多肽合成酶基因,选择特异性序列设计引物和探针。探针5′末端用FAM修饰,3′末端利用猝灭基团C3spacer标记,并由上海生物工程有限公司合成其序列见表2。
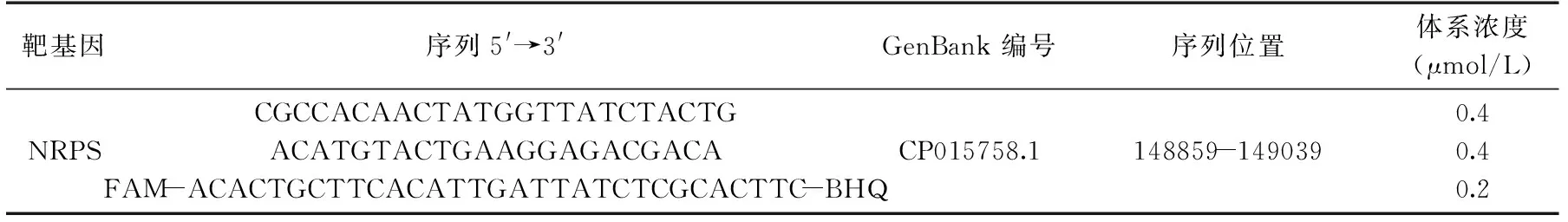
表2 银白色葡萄球菌NRPS基因引物及Taqman探针序列Table 2 The primers and probe of Staphylococcus argenteus NRPS
1.2.2 细菌基因组DNA的提取 将本研究中所用的菌株分别接种到营养肉汤中,放置在恒温振荡培养箱中,振荡时的温度为35 ℃,振幅160 RPM,过夜培养,吸取1 mL培养菌液滴加到1.5 mL离心管内,在4 ℃条件下12000 r/min离心2 min,弃去上清液,加入500 μL无菌生理盐水,充分振荡混匀,在4 ℃条件下12000 r/min离心1 min,弃上清,重复添加无菌生理盐水,再离心,弃上清。添加50 μL生理盐水,100 ℃水浴10~15 min,待冷却至室温,之后在4 ℃条件下12000 r/min离心1 min,上清液于20 ℃保存备用。
1.2.3 实时荧光PCR检测方法的建立 根据 Premix Ex Taq TM(Probe q PCR)Kit试剂盒推荐的各组分浓度和循环参数,初步建立Taqman探针实时荧光PCR反应体系,其中Premix taq(Ex Taq Version 2.0)12.5 μL,上游引物和下游引物各1 μL,探针为0.5 μL,去离子水为8 μL,最后添加2 μL待测模板。并根据引物、探针的退火温度,调整优化退火温度,根据Ct值确定较为合适的退火温度。
1.2.4 实时荧光PCR特异性实验 以银白色葡萄球菌(DAM 28299)作为阳性对照,无菌生理盐水作为空白对照,分别对金黄色葡萄球菌,表皮葡萄球菌,白色葡萄球菌,木糖葡萄球菌,假中间葡萄球菌,头状葡萄球菌,山羊葡萄球菌,以及单核细胞增生李斯特菌,阪岐肠杆菌,志贺氏菌,沙门氏菌,副溶血性弧菌,大肠O157等进行检测。
1.2.5 实时荧光PCR灵敏度实验 将水煮法提取的编号为DSM 28299的银白色葡萄球菌的DNA模板,等梯度稀释至10-5,6个梯度,其DNA模板的浓度为111.7、11.2、1.1、0.1 ng/μL、10、1 pg/μL,无菌生理盐水作为空白对照,对该方法的灵敏度进行分析。
1.2.6 实验室分离菌株的鉴定 利用建立的实时荧光PCR方法检测实验室通过传统分离方法得到的金黄色葡萄球菌,其中以DSM 28299的银白色葡萄球菌为阳性对照,无菌生理盐水为空白对照。
1.2.7 普通PCR检测方法的验证实验 利用Daofeng Zhang等[12]建立普通PCR方法,对银白色葡萄球菌的标准菌株,以及本方法从实验室分离株中确定为银白色葡萄球菌的菌株进行鉴定验证,序列如表3所示。

表3 常规PCR鉴定银白色葡萄球菌的引物Table 3 Conventional PCR primers for the identification of Staphylococcus argenteus
1.2.8 人工模拟污染实验 取25 g经传统检测方法未检出银白色葡萄球菌的新鲜奥尔良鸡肉样品,加入225 mL 7.5%的生理盐水,制成匀浆;从上述匀浆中吸取0.5 mL于装有的营养肉汤的试管中,并再加入0.5 mL浓度为5×108cfu/mL DSM28299 的银白色葡萄球菌,充分混匀;放置在恒温振荡培养箱中,振荡时的温度为35 ℃,振幅160 r/min,过夜培养,参照1.2.2中提取DNA的方法,将提取的DNA等梯度稀释至10-5,6个梯度,其DNA模板的浓度为101.4、10.2、1.0、0.1、0.01、0.001 ng/μL,然后进行模拟污染的灵敏度实验分析。
2 结果与分析
2.1 实时荧光PCR检测方法的建立
根据引物及探针的退火温度,在扩增时设计不同的退火温度,提高该方法的特异性。本实验以编号为DSM 28299的银白色葡萄球菌为阳性对照,去离子水作为空白对照,通过在不同退火温度条件下(55、58、60 ℃)进行扩增,荧光PCR的循环条件为预变性95 ℃ 3 min;变性94 ℃ 5 s,退火延伸55 ℃/58 ℃/60 ℃ 30 s,40个循环。结果如图1(退火温度为58 ℃)所示,无论从扩增效率还是Ct值来分析,当退火温度为58 ℃时更符合我们的要求。

图1 银白色葡萄球菌实时荧光PCR方法的建立Fig.1 The establishment of a realtime PCR method for Staphylococcus argenteus注:1表示编号为DSM 28299银白色葡萄球菌的扩增曲线;2表示空白对照的扩增结果。
2.2 实时荧光PCR特异性分析
1.2.4中各种菌的扩增结果如图2和图3所示,本实验所建立的实时荧光PCR方法可以检测出编号为DSM 28299和SITUF 20420的银白色葡萄球菌,同属不同种以及常见的致病菌的扩增曲线与空白的扩增曲线呈阴性,从而说明我们所建立的PCR方法的特异性良好,能够有效的将银白色葡萄球菌从其他菌中区分鉴定出来。

图2 实时荧光PCR方法的特异性实验1Fig.2 Detection specificity 1 of Staphylococcus argenteus by RTPCR注:1为DSM28299银白色葡萄球菌;2为SITUF银白色葡萄球菌;3~8为阴性对照,分别为单增李斯特菌、阪岐肠杆菌、沙门氏菌、志贺氏菌、大肠杆菌、副溶血性弧菌;9为空白对照。

图3 实时荧光PCR方法的特异性实验2Fig.3 Detection specificity 2 of Staphylococcus argenteus by RTPCR注:1为DSM28299银白色葡萄球菌;2为SITUF银白色葡萄球菌;3~9为阴性对照,分别为金黄色葡萄球菌、表皮葡萄球菌、白色葡萄球菌、头状葡萄球菌、假中间葡萄球菌、山羊葡萄球菌、木糖葡萄球菌;10为空白对照。
2.3 实时荧光PCR灵敏度分析
利用建立的实时荧光PCR方法分别对不同梯度的模板进行检测(见图4),结果表明,当DNA模板浓度为0.01 ng/μL,结果呈现规则的,典型的扩增曲线;而当模板浓度为0.001 ng/μL时,也就是1 pg/μL,虽然扩增曲线与空白之间存在差异,但其Ct值偏大,影响结果的判定。从而说明本实验实时荧光PCR方法检测银白色葡萄球菌的灵敏度为0.01 ng/μL。
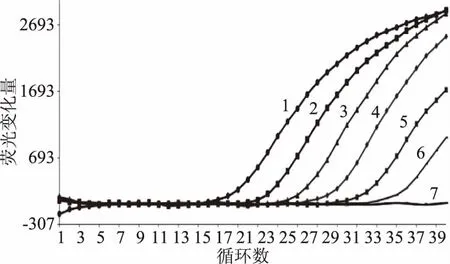
图4 实时荧光PCR方法的灵敏度实验Fig.4 Detection sensitivity of Staphylococcus argenteus by RTPCR注:1~7分别代表DNA模板的浓度为111.7、11.2、1.1、0.1、0.01、0.001 ng/μL以及空白对照的扩增结果。
2.4 分离菌株的检测
采用建立的荧光PCR方法对实验室通过传统分离得到的SA 2016026、SA 21016027、SA 2016028、SA 2016029、SA 2016030、SA 2016031、SA 2016040、SA 2016041、SA 2016047、SA 2016048、SA 2017001、SA 2016002等12株金黄色葡萄球菌鉴定分析。实验结果如图5所示,并由此看出SA 2016030、SA 2016047的扩增曲线呈阳性。

图5 实时荧光PCR方法对分离菌株的鉴定实验Fig.5 Identification test of isolated strains by RTPCR注:1代表菌株SJTUF 20420;2代表实验室分离菌株SA 2016030;3代表DSM28299;4代表实验室分离菌株SA 2016047;曲线5~14分别为实验室分离的金黄色葡萄球菌SA 2016026、SA 21016027、SA 2016028、SA 2016029、SA 2016031、SA 2016040、SA 2016041、SA 2016048、SA 2017001、SA 2016002;曲线15为空白对照。
2.5 普通PCR检测方法的验证实验
利用文献中提到的普通PCR检测方法[12],对金黄色葡萄球菌的标准菌株,银白色葡萄球菌的标准菌株以及本实验鉴定得到的银白色葡萄球菌(SA 2016030、SA 2016047)进行检测,其中金黄色葡萄球菌的扩增产物的长度136 bp,而银白色葡萄球菌的扩增长度为316 bp。扩增结果如图6所示,银白色葡萄球菌SJTUF 20420、DSM 28299、分离菌株SA 2016030和SA 2016047的扩增产物的长度为316 bp,而金黄色葡萄球菌ATCC 27217、ATCC 25923、CMCC 26003、GIM 1.481的扩增产物的长度为136 bp。所以,实验室分离菌株SA 2016030、SA2016047为银白色葡萄球菌。

图6 普通PCR扩增结果Fig.6 PCR amplicons of the nonribosomal peptide synthetase gene from different strains注:M代表Maker;1代表SJTUF 20420;2代表DSM 28299;3代表SA 2016030;4代表SA 2016047;5代表ATCC 25923;6代表为ATCC 27217;7代表为CMCC 26003;8代表GIM 1.481;NC为空白对照。
通过利用普通PCR检测方法的验证,进一步的证明本文所建立的方法具有极强的准确性。虽然文献中的PCR方法相比于传统的多位点序列分型(MLST)的鉴定方法,节约时间,但其不足之处是在结果判定的过程中,容易引起污染,影响结果的判读。而本文所建立的方法相对文献中方法更快,并能通过荧光实时观察。
2.6 模拟污染实验
将DSM28299银白色葡萄球菌接种于含有新鲜奥尔良鸡肉的营养肉汤中,过夜培养,之后提取DNA模板,等梯度稀释,分别对不同梯度的模板进行检测结果见图7。结果表明,当DNA模板浓度为0.01 ng/μL,结果呈现规则的,典型的扩增曲线;而当模板浓度为0.001 ng/μL时,也就是1 pg/μL,虽然扩增曲线与空白之间存在差异,但其Ct值偏大,与空白的差异不明显,影响结果的判定。从而说明本实验实时荧光PCR方法对污染样品中银白色葡萄球菌的灵敏度为0.01 ng/μL。

图7 污染食品中银白色葡萄球菌实时荧光PCR方法的灵敏度实验Fig.7 Sensitivity of RTPCR method for Staphylococcus argenteus in contaminated foods注:1~7分别代表DNA模板的浓度为101.4、10.2、1.0、0.1、0.01、0.001 ng/μL以及空白对照的扩增结果。
3 结论
本研究利用银白色葡萄球菌和金黄色葡萄球菌在NRPS基因上的差异设计引物及探针,通过引物对的筛选及反应体系的优化,建立银白色葡萄球菌的Taqman实时荧光PCR检测方法,并利用建立的方法在对实验室通过传统生化鉴定得到的金黄色葡萄球菌分离菌株的鉴定,发现在12株原本鉴定为金黄色葡萄球菌中,存在2株银白色葡萄球菌,且其检出率相当于金黄色葡萄球菌的1/6,进一步证实银白色葡萄球菌在我国的存在,为银白色葡萄球菌的开发利用提供基础;在特异性实验中,可以检测到银白色葡萄球菌,葡萄球菌属中同属不同种以及其他不同属的常见致病菌的扩增结果全部呈阴性,且本方法对银白色葡萄球菌的检测灵敏度可以达到为10 pg/μL,整个检测过程只需60 min,可以短时间获得检测结果。
综上所述,本实验建立的Taqman实时荧光PCR方法特异性强,灵敏度高,检测时间短,操作简便,并且对样品中分离菌株也能够有效的区分,在实际检测中具有很强的适用性,为银白色葡萄球菌快速精准的检测提供可靠的技术手段,适合在检验检疫系统内、食品安全监管及食品加工等部门推广应用。
[1]Steven Ye Ching Tong,Batu KSharmaKuinkel,Joshua Thaden,et al. Virulence of endemic nonpigmented northern AustralianStaphylococcusaureusclone(Clonal Complex 75,S.argenteus)is not augmented byStaphyloxanthin[J]. Oxford University Press on Behalf of the Infectious Diseases Society of America,2013,208(3):520527.
[2]Okuma K,Iwakawa K,Turnidge JD,et al. Dissemination of new methicillinresistantStaphylococcusaureusclones in the community[J]. Journal of Clinical Microbiology,2002,40(11):42894294.
[3]Tong SY,Schaumburg F,Ellington MJ,et al. Novel staphylococcal species that form part of aStaphylococcusaureus-related complex:the nonpigmentedStaphylococcusargenteussp. nov. and the nonhuman primateassociatedStaphylococcusschweitzerisp. Nov[J]. International Journal of Systematic and Evolutionary Microbiology,2015,65(Pt 1):1522.
[4]Schaumburg F,Pauly M,Anoh E,et al.Staphylococcusaureus complex from animals and humans in three remote African regions[J]. Clinical Microbiology and Infection the Official Publication of the European Society of Clinical Microbiology and Infectious Diseases,2015,21(4):345348.
[5]Ruimy R,ArmandLefevre L,Barbier F,et al. Comparisons between geographically diverse samples of carriedStaphylococcusaureus[J]. Journal of Bacteriology,2009,191(18):55775583.
[6]Akobi B,Aboderin O,Sasaki T,et al. Characterization ofStaphylococcusaureusisolates from faecal samples of the straw-coloured fruit bat(Eidolonhelvum)in obafemi awolowo university(OAU),nigeria[J]. Bmc Microbiology,2012,12(1):18.
[7]Ruimy R,Angebault C,Djossou F,et al. Are host genetics the predominant determinant of persistent nasalStaphylococcusaureuscarriage in humans[J]. Journal of Infectious Diseases,2010,202(6):924934.
[8]Jenney A,Holt D,Ritika R,et al. The clinical and molecular epidemiology ofStaphylococcusaureusinfections in Fiji[J]. BMC Infectious Diseases,2014,14(1):160.
[9]Ritchie SR,Thomas MG,Rainey PB. The genetic structure ofStaphylococcusaureuspopulations from the Southwest Pacific[J]. PLoS One,2014,9(7):e100300.
[10]Monecke S,Stieber B,Roberts R,et al. Population structure ofStaphylococcusaureusfrom Trinidad and Tobago[J]. PLoS One,2014,9(2):e89120.
[11]DaoFeng Zhang,Xuebin Xu,Qifa Song,et al. Identification ofStaphylococcusargenteusin Eastern China based on a nonribosomal peptide synthetase(NRPS)gene[J]. Future Microbiol,2016,11(9):11131121.
[12]Dupieux C,Blonde R,Bouchiat C,et al. Community-acquired infections due toStaphylococcusargenteuslineage isolates harbouring the PantonValentine leucocidin,France,2014[J]. Eurosurveill,2015,20(23):68.
[13]Thaipadungpanit J,Amornchai P,Nickerson EK,et al. Clinical and molecular epidemiology ofStaphylococcusargenteusinfections in Thailand[J]. Journal of Clinical Microbiology,2015,53(3):10051008.
[14]Chantratita N,Wikraiphat C,Tandhavanant S,et al. Comparison of communityonsetStaphylococcusargenteusandStaphylococcusaureussepsis in Thailand:A prospective multicentre observational study[J]. Clinical microbiology and infection,2016,22(5):1119.
[15]Holt D,Holden MT,Tong SY,et al. A very earlybranchingStaphylococcusaureuslineage lacking the carotenoid pigment Staphyloxanthin[J]. Genome Biology and Evolution,2011,3(1):881895.
