新型植酸酶基因YkAPPAS在毕赤酵母中的表达及其酶学特性分析
2018-03-07朱恒文田永生李大伟于成野彭日荷姚泉洪
朱恒文,田永生,李大伟,于成野,陈 磊,彭日荷,姚泉洪*
(1上海海洋大学食品学院,上海201306;2上海市农业科学院生物技术研究所,上海201106;3未名生物医药有限公司,福建361009)
磷是动物生长、繁殖及代谢所必须的矿物质元素之一,它构成机体的组成部分,还分布于皮肤、肌肉和韧带等组织和组织液中。机体中的磷参与维持机体环境稳定、脂类化合物及脂溶性维他命的利用和转运等很多新陈代谢及生理过程,缺乏无机磷会造成动物机体生长迟缓、食欲不振等问题。作物中的磷有60%—80%是以植酸的形式存在的[1],植酸是一种肌醇六磷酸酯,属于维生素B族,它的水解终产物是肌醇和无机磷酸。植酸广泛存在于农副产品中,尤其是在禾谷类和油料作物的种子中含量丰富[2],而人和单胃动物缺乏分解植酸的酶类,所以无法利用植酸中的磷。此外,植酸能与矿物质元素和蛋白质形成不溶性的稳定复合物,从而降低了矿质元素和蛋白质的利用率[3-4]。然而,研究发现将植酸酶添加到动物饲料中释放出植酸中的磷分子,不但可以提高食物以及饲料对磷的吸收利用率,而且还能降解植酸和蛋白质的络合物,从而降低动物排泄物中有机磷的含量,减少对自然环境的污染[5],因而将微生物植酸酶添加到动物饲料中正在被推广和应用[6]。
植酸酶(Phytase)是催化植酸以及植酸盐水解成肌醇和磷酸(或盐)的一类酶的总称[7],属磷酸单酯水解酶。根据国际纯化学与应用化学联合会和国际生物化学联合会定义,依据植酸酶水解植酸的位点的不同,将植酸酶分为3种类型:肌醇六磷酸3-磷酸水解酶(EC.3.1.3.8)、肌醇六磷酸6-磷酸水解酶(EC.3.1.3.26)和非特异性的正磷酸盐单脂磷酸水解酶[8]。目前,植酸酶作为一种饲料添加剂,有着广泛的应用前景,但植酸酶在单胃动物中的推广和应用往往受到其酶性质的局限[9]。天然来源的植酸酶普遍存在提取困难、分泌量太低、成本高的问题,这些问题都导致其难以满足现实生产的需要。所以构建基因工程菌作为微型生物反应器来实现异源高水平分泌表达[10],成为解决这一问题的关键。
本研究根据密码子偏好性设计并合成了一个来源于Yersinia kristensenii的新型植酸酶基因YkAPPAS,并且成功地在毕赤酵母中分泌和表达。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
由本实验室保存的大肠杆菌(Escherichia coli)DH5α菌株;巴斯德毕赤酵母GS115(His-,Mut+)购自Invitrogen公司;载体pYPX88(基因登录号AY178045)由本实验室构建。
1.1.2 酶和试剂
限制性内切酶、Taq DNA聚合酶、T4 DNA连接酶、蛋白marker均购自Takara公司;胃蛋白酶和胰蛋白酶以及其他试剂均购自生工生物工程(上海)股份有限公司;植酸钠购自Sigma公司。
1.1.3 培养基
LB、YPD、BMGY和BMMY培养基。
1.1.4 主要仪器
多功能酶标仪购自TECAN Infinite M200瑞士帝肯公司;电击仪购自Bio-Rad公司。
1.2 方法
1.2.1 表达载体构建
在不改变植酸酶氨基酸序列的前提下,根据巴斯德毕赤酵母密码子的偏爱性对植酸酶氨基酸序列进行优化改造。采用PTDS(PCR-based two-step DNA synthesis)方法[11]将来源于Yersinia kristensenii的新型植酸酶基因进行化学合成,并且在其3’末端加上6个组氨酸标签(便于后续表达的重组蛋白纯化)。将优化后的基因连接到克隆载体pUC18上,转化大肠杆菌DH5α进行序列测定。测序正确后,将酶切得到的基因连接到毕赤酵母表达载体pYPX88上,获得重组质粒pYPX88-YkAPPAS。
1.2.2 表达载体的电击转化
将毕赤酵母GS115于50 mL YPD液体培养基中30℃恒温过夜培养,取1 mL菌液接种于100 mL新鲜的YPD液体培养基(酵母提取物10 g/L,胰化蛋白胨20 g/L,pH 5.5,用前加入2%的葡萄糖),30℃培养至OD600=1.6—1.8,离心收集菌体,用预冷的无菌水洗菌体,4℃下8 000 r/min离心除去上清液,用20 mL预冷的山梨醇悬浮菌体,再离心收集菌体并用0.5 mL预冷的山梨醇悬浮,根据Invitrogen手册的方法制备毕赤酵母感受态细胞。取80μL菌液,加入2μL重组质粒pYPX88-YkAPPAS,冰浴5 min后电击,结束后立即加入800μL预冷的0.6 mol/L山梨醇溶液,混合后取0.2 mL菌液涂布于SD-山梨醇平板上,30℃培养72 h。
1.2.3 重组酵母的诱导表达
挑取阳性菌落接种在100 mL BMGY(含1%甘油)培养基中,28℃、220 r/min摇床培养至OD600值约5.0,离心收集菌体,加入适量无菌水清洗沉淀,清除残留的甘油。将菌体加入20 mL BMMY诱导培养基中,28℃继续诱导培养,每隔24 h添加250μL 100%甲醇至终浓度为1%,每隔6 h进行酶活测定,直到72 h。将菌液加入50 mL离心管中,于4℃下8 000 r/min离心5 min,收集上清,即为粗酶液,放置于4℃下保存。
1.2.4 重组酵母植酸酶酶蛋白的纯化及分析
取诱导后的粗酶液上清1.5mL,加入已经用平衡缓冲液(50mmol/L Tris-HCl,pH 7.5,10mmol/L咪唑和300 mmol/L NaCl)平衡好的镍柱(Ni2+-NTA agarose affinity column)中,待粗酶液完全流过镍柱后,用洗涤液B(50mmol/L Tris-HCl,pH 7.5,20mmol/L咪唑和300mmol/L NaCl)洗涤,将杂蛋白清洗掉,最后用洗脱液 C(50 mmol/L Tris-HCl,pH 7.5,250 mmol/L咪唑和300 mmol/L NaCl)洗脱,将柱子上的重组植酸酶YkAPPAS蛋白洗脱下来。纯化后的重组蛋白用SDS-PAGE进行电泳分析,并且通过考马斯亮蓝法测定蛋白含量。
1.3 重组酶酶学性质测定
植酸酶酶活单位定义为:在37℃和pH 5.5的条件下,1 min内从5.0mmol/L的植酸钠溶液中水解释放出1μmol无机磷所需的酶量为1个酶活单位,以U表示[12]。
1.3.1 最适pH和pH稳定性的测定
用不同pH缓冲液调节底物pH,再将不同pH的底物与酶液在37℃反应30min后,根据钒-钼黄分光光度法测OD415计算酶的相对酶活,最适pH值就是其相对活性最高时所对应的pH。pH稳定性是在不同pH的缓冲液条件下,37℃处理24 h,然后在最适条件下(最适pH,37℃,反应30 min)测定酶活,以上每个反应设置3次重复。
本试验所用不同 pH缓冲液为:0.2 mol/L Gly-HCl(pH 1.0—3.5),0.2 mol/L NaAc-HAc(pH 4.0—6.5),0.2 mol/L Tris-HCl(pH 7.0—8.5)和 Gly-NaOH(pH 9.0—10.0)。
1.3.2 最适温度和温度稳定性的测定
最适温度的测量:先用0.2 mol/L NaAc-HAc(pH 4.0)稀释植酸酶酶液,再把稀释好的植酸酶酶液与底物植酸钠在不同的温度(10—80℃,每个温度间隔5℃)下反应30 min后,在OD415时测定相应的酶活性,以最高相对活性所对应的温度为最适温度。
温度稳定性的测定:将稀释好的酶液分别在90℃和100℃水浴加热5 min、10 min、15 min、20 min、25 min、30 min后立即冰置冷却,在45℃,pH 4.5条件下反应30 min测定OD415时的相对酶活,以上每个反应设置3次重复。利用变性失活的粗酶液作为空白对照。
1.3.3 不同金属离子及化学试剂对植酸酶的影响
试验分两组,以不加任何金属离子及其他化学试剂的缓冲溶液做空白对照;试验组将底物0.75 mmol/L植酸钠加入NaAc-HAc(pH 4.5)缓冲溶液中,再分别加入不同的金属离子(K+、Na+、NH4+、Ca2+、Ba2+、Li+、Ni2+、Mg2+、Pb2+、Zn2+、Fe3+、Fe2+、Cu2+、Mn2+、Al3+、Co2+和 Cr3+)、巯基化合物(DTT)、金属螯合剂(EDTA)和变性剂(SDS),在45℃、pH 4.5反应30 min后测得重组植酸酶的剩余酶活性。
1.3.4 胃蛋白酶和胰蛋白酶对植酸酶影响的测定
试验分两组,以未经过消化酶液处理的初酶活作对照。用0.2 mol/L Gly-HCl(pH 2.0)和0.2 mol/L Tris-HCl(pH 7.5)缓冲液分别稀释胃蛋白酶和胰蛋白酶,将稀释液与植酸酶按一定重量比例(蛋白酶/植酸酶 w/w:1/500,1/250,1/100,1/50,1/1,50/1,100/1)混合,然后在 37℃下分别处理 4 h后,在最适条件下(45℃,pH 4.5)反应30 min,测定酶活,每个反应设3次重复。
2 结果与分析
2.1 YkAPPAS基因的合成
本试验根据毕赤酵母密码子的偏好性进行了化学合成和结构优化,并且为了便于对表达后蛋白的分离纯化,在基因的3’端引入了编码6×His的核苷酸序列。BLAST对比显示YkAPPAS基因和野生型基因YkAPPA有69.62%的相似性(图1)。

图1 合成基因YkAPPAS和野生型基因YkAPPA序列比对Fig.1 Sequence alignment of YkAPPAS synthetic gene and YkAPPA w ild-type gene
2.2 SDS-PAGE分析及重组植酸酶基因在毕赤酵母中的表达
将粗酶液浓缩纯化后,通过SDS-PAGE分析重组植酸酶的表达,结果如图2所示,纯化后的蛋白大小约为46 kD左右,且蛋白条带单一,与生物信息学预测的理论分子量(46.11 kD)一致,表明重组植酸酶基因经电击转化后在毕赤酵母中成功表达。将表达的外源蛋白进行脱糖基化处理后,发现蛋白带仍为46 kD,证明该外源蛋白并没有进行糖基化修饰。
2.3 最适pH和pH稳定性
如图3所示,重组植酸酶YkAPPAS最适pH分别为4.5和6.0,pH 6.0时酶活达到最大值,在pH 3—12时的活性都在30%以上,说明该酶的pH的适宜范围较广泛,耐碱性很强。
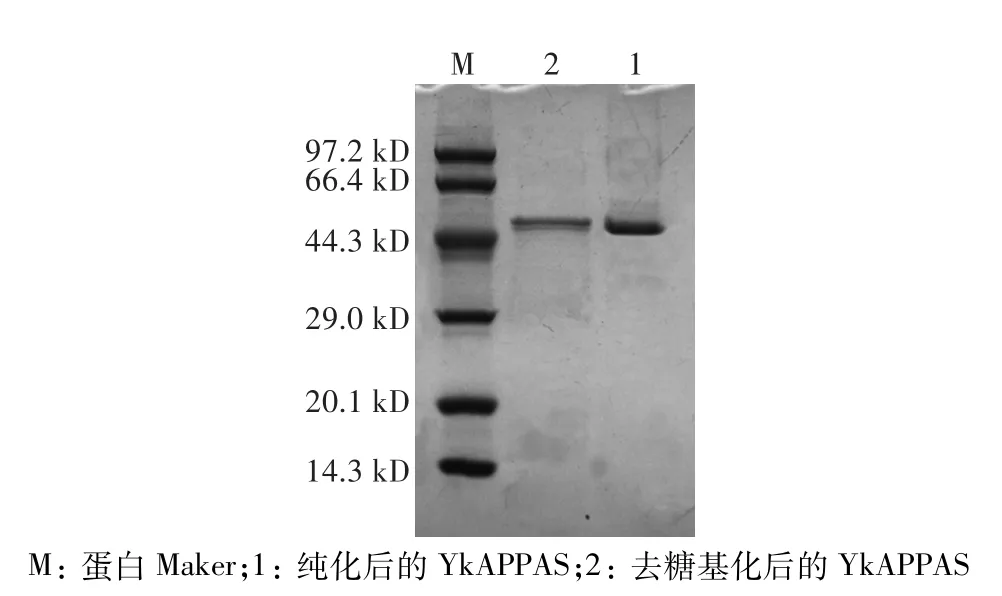
图2 SDS-PAGE检测YkAPPASFig.2 Detection of YkAPPAS by SDS-PAGE

图3 植酸酶的最适pH和pH稳定性Fig.3 The optimum pH and pH stability of phytase
2.4 最适温度和温度稳定性
如图4-a所示,重组植酸酶YkAPPAS最适温度为45℃,在10—65℃有超过20%的活力。如图4-b所示,重组植酸酶YkAPPAS在100℃处理5 min后其活性为47.55%,90℃处理5 min后其活性为56.75%,而100℃和90℃处理30 min后该酶的剩余酶活分别为4.17%和8.5%。

图4 植酸酶的最适温度(a)和热稳定性(b)Fig.4 The optimum tem perature(a)and thermal stability(b)of phytase

图5 金属离子对植酸酶的影响Fig.5 Effects ofmetal ions on phytase activity
2.5 不同金属离子及化学试剂对植酸酶的影响
如图5所示,将不同的金属离子加入含有0.75 mmol/L植酸钠的NaAc-HAc(pH 4.5)缓冲溶液中,然后分别测定酶活性,结果表明:金属离子Li+、Mn2+以及金属螯合剂EDTA对重组植酸酶有一定的激活作用,其中EDTA和Li+对重组植酸酶YkAPPAS的激活作用比较明显;K+、Na+、Fe2+、Fe3+、NH4+、Ca2+、Co2+、Ni2+、Cr3+、Al3+、Pb2+、Zn2+、Cu2+及变性剂 SDS对 YkAPPAS的酶促反应均有抑制作用,尤其是 SDS抑制力最强。Ba2+、巯基化合物DTT、Mg2+对YkAPPAS的活性无明显影响。
2.6 蛋白酶对YkAPPAS植酸酶活性的影响
将胃蛋白酶和胰蛋白酶液与重组植酸酶按不同重量比例混合处理4 h后,植酸酶对胃蛋白酶和胰蛋白酶的耐受性如图6所示。在胃蛋白酶浓度最低时(w/w为1/500),重组植酸酶有99%的酶活;在最强抑制作用下(w/w为100/1),重组植酸酶仍有56%的活性。随着胰蛋白酶的比例增加,重组植酸酶的活性逐渐降低,在相对重量比为100/1时,此时抑制作用最强,酶活性最低约为60%。以上说明了重组植酸酶YkAPPAS对于胰蛋白酶和胃蛋白酶都有良好的抗水解的能力。
2.7 酶反应动力学参数
通过Lineweaver-Burk双倒数作图法,以反应速度的倒数(1/V)对底物质量浓度的倒数(1/[S])作图,得到一条直线(图7)。根据回归方程得到该重组酶YkAPPAS的米氏常数Km=0.5686μmol/mL,最大反应速度 Vmax=1.2086μmol/(mL·min)。

图6 胃蛋白酶和胰蛋白酶对植酸酶的影响Fig.6 Effects of pepsin and trypsin on phytase activity

图7 双倒数图Fig.7 The Lineweaver-Burk plot
3 讨论
本研究根据密码子偏好性设计并合成了一个来源于Yersinia kristensenii的新型植酸酶基因YkAPPAS,根据本研究室建立的PTDS法对YkAPPAS基因进行了化学合成,并且成功在毕赤酵母中实现了高水平的异源表达。该重组植酸酶的产量较高,达到106.73μg/mL。由此可见,将该酶应用于大规模的工业生产将会降低生产成本。
与动物、真菌、细菌等表达载体相比,本研究采用毕赤酵母作为表达载体具有相对优势。首先酵母的遗传背景较清楚,便于遗传操作,使用较安全;其次来自细菌和霉菌的异源植酸酶基因已经在酵母表达系统中表达;第三,现今只有少数的酵母可以表达,而主要的表达载体就是毕赤酵母[13];最后,过度的糖基化会阻碍外源蛋白的分泌运输,而本试验利用的巴斯德毕赤酵母GS115分泌表达的外源蛋白就没有被糖基化修饰。
植酸酶分为PhyA和PhyB两种类型,PhyA具有两个最适pH,一般在pH 2.5—7.5,而PhyB只有一个最适pH[14]。有研究报道,黑曲霉植酸酶由于具有PhyA基因,其分泌出的植酸酶通常含有两个pH最适值,例如A.niger NRRL3135和A.niger SK-57均有两个最适pH,且这两种黑曲霉植酸酶的最适pH均为pH 2.5和pH 5.5。除此之外,A.niger 113也有两个最适pH,分别为pH 2.0与pH 5.0[15]。由于本试验得到的重组植酸酶YkAPPAS也具有两个最适pH,所以可推测出重组植酸酶属于PhyA类型的植酸酶。目前,在动物饲养中,饲料酶制剂以其高效、安全、低成本等特点,已成为饲料添加剂研究和应用的热点[16]。因为植酸酶是一种生物催化活性蛋白,只有当其酶活特性(如最适温度、最适pH等)与动物肠道生理特点相吻合时,才能充分发挥其催化水解活性,所以在饲料中添加植酸酶作为添加剂主要有三方面的问题制约其大规模的生产应用,即pH最适范围、热稳定性以及肠胃中各种消化蛋白酶的作用[17]。本研究所得到的重组植酸酶具有明显的优势:首先,畜禽采食饱腹后胃内pH在4.0—5.0,且随着胃酸的不断分泌以及食糜的不断排入后肠道,胃内酸度逐渐增大,进而影响植酸酶的活性[18]。而该酶具有较广泛的最适pH,pH在1.5—7.0时其相对酶活能保持在30%以上,说明该酶在动物消化道内的适应性较强。有文献报道,基因工程酵母生产的植酸酶在pH高于6.0时活性急剧下降,且pH在1.5以下或者7.5以上时酶活性接近为零[19]。本试验重组植酸酶YkAPPAS有两个最适pH,分别是pH 4.5和6.0,且pH 4.5时的酶活性是pH 6.0时的79.79%,在pH 1.0和pH 7.5时重组植酸酶YkAPPAS的酶活性都在20%以上。与文献报道相比,本试验的重组植酸酶耐酸性相对更强,且pH范围相对更广,更适宜在动物肠胃道内发挥有效活性。其次,该酶具有较好的耐热性,90℃处理20 min后其活性为16%,能够较好地解决饲料在生产过程中因高温制粒而造成植酸酶活性损失的问题。有文献选取具有代表性的商品植酸酶昕大洋进行热稳定性试验,发现商品酶昕大洋在90℃下处理5 min后几乎丧失了所有酶活[20]。本试验获得的重组植酸酶在90℃下处理5 min后其酶活性为56.75%,与商品植酸酶昕大洋相比,重组植酸酶YkAPPAS在热稳定性方面具有较大的优越性。
植酸能与金属离子形成螯合物[21],抑制了植酸酶对植酸的水解作用,降低了植酸酶的活性,所以植酸酶的利用率受多种金属离子的影响。例如Zn2+、Fe3+等离子易与植酸形成络合物,所以重组植酸酶的活性受到了抑制作用。有文献记载DTT对多种植酸酶的活性有强烈的抑制作用,而DTT对重组植酸酶YkAPPAS的活性却没有明显影响。通过重组植酸酶对抗胃蛋白酶和胰蛋白酶能力的研究发现,在胃蛋白酶/植酸酶(w/w)为100/1,作用4 h后,酶活为56%,在胰蛋白酶/植酸酶(w/w)为500/1,作用4 h后,酶活性为60%,说明该重组酶具有良好的抗胃蛋白酶和胰蛋白酶水解的能力。
我国是农业大国,通过基因工程的手段构建植酸酶高产菌株是有重要意义的。植酸酶作为饲料给动物饲喂的效果已得到广泛确证[22],但是在饲料工业中植酸酶还没有得到很好的推广利用,随着科技的进一步发展,本试验得到的相关酶活数据将为应用基因工程和蛋白质工程的方法对植酸酶进行改造的研究提供重要的借鉴和参考价值。
[1]朱靖环,杨永红,毛华明.植酸酶的研究与应用进展[J].微生物学杂志,2002,22(1):43-46.
[2]彭日荷,郭美锦.应用毕氏酵母高效表达耐高温植酸酶[J].生物化学与生物物理学报(英文版),2002,34(6):725-730.
[3]邹立扣,王红宁.植酸酶及其植物基因工程[J].微生物学通报,2005,32(6):128-132.
[4]HOLM PB,KRISTIANSEN K N,PEDERSEN H B.Transgenic approaches in commonly consumed cereals to improve iron and zinc contentand bioavailability[J].Journal of Nutrition,2002,132(3):514S-516S.
[5]汪世华,吕茂洲,孙长春,等.植酸酶的现状及其研究进展[J].广州食品工业科技,2002,18(1):54-57.
[6]CROMWELL G L.ASAS centennial paper:Landmark discoveries in swine nutrition in the past century[J].Journal of Animal Science,2009,87(2):778-792.
[7]马玺,单安山.植酸酶研究进展及其在饲料工业中的应用[J].粮食与饲料工业,2001(4):27-30.
[8]VATSP,BANERJEE U C.Production studies and catalytic properties of phytases(myo-inositol hexakisphosphate phosphohydrolases):an overview[J].Enzyme&Microbial Technology,2004,35(1):3-14.
[9]赵翠燕,许钦坤,柯野.植酸酶的来源及合成研究进展[J].中国饲料,2009(8):11-12.
[10]姚斌,张春义,王建华,等.产植酸酶的黑曲霉菌株筛选及其植酸酶基因克隆[J].农业生物技术学报,1998,6(1):1-6.
[11]XIONG A S,YAO Q H,PENG R H,et al.A simple,rapid,high fidelity and cost-effective PCR based two-step DNA synthesis(PTDS)method for long gene sequences[J].Nucleic Acids Res,2004,32(12):437-442.
[12]VATSP,BANERJEE U C.Biochemical characterization of extracellular phytase(myo-inositolhexakisphosphate phosphohydrolase)from a hyperproducing strain of Aspergillus niger van Teighem[J].Journal of Industrial Microbiology&Biotechnology,2005,32(4):141-147.
[13]王凯,张威,李师翁.植酸酶及其应用[J].中国生物工程杂志,2015,35(9):85-93.
[14]周小玲.粗糙脉孢菌一种新植酸酶基因的克隆、鉴定和重组酶的生化特性[D].无锡:江南大学,2004.
[15]XIONG A S,YAO Q H,PENG R H,et al.Isolation,characterization,and molecular cloning of the cDNA encoding a novel phytase from Aspergillus niger 113 and high expression in Pichia pastoris[J].Journal of Biochemistry&Molecular Biology,2004,37(3):282-291.
[16]李旋亮,吴长德,李建涛.植酸酶的研究进展与应用[J].饲料博览,2009(8):21-23.
[17]姚斌,范云六.植酸酶的分子生物学与基因工程[J].生物工程学报,2000,16(1):1-5.
[18]李富伟,汪勇,汤海鸥.胃蛋白酶、胰酶及酸度对植酸酶稳定性的影响[J].饲料与畜牧,2008(10):18-20.
[19]慕跃林,李凤梅,王忆平.基因工程酵母产植酸酶的应用性质研究[J].饲料研究,2000(6):11-12.
[20]WANG X Y,MENG F G,ZHOU H M.The role of disulfide bonds in the conformational stability and catalytic activity of phytase[J].Biochemistry&Cell Biology,2004,82(2):329-334.
[21]贺建华.植酸磷和植酸酶研究进展[J].动物营养学报,2005,17(1):1-6.
[22]SHARMA C B,GOEL M,IRSHAD M.Myoinositol hexaphosphate as a potential inhibitor ofα-amylases[J].Phytochemistry,1978,17(2):201-204.
