纳米镍对大鼠睾丸生精-支持共培养细胞的凋亡作用及机制研究
2018-02-05高晓洁薛玉英
高晓洁 孔 璐* 薛玉英*
(1. 东 南大学公共卫生学院,环境医学工程教育部重点实验室,江苏 南 京 210009;2. 江 苏省生物材料与器件重点实验室,江苏 南 京 210009)
纳米镍作为一种金属纳米材料,除具备纳米粒子自身性质之外,还具有一系列磁、电、光及力学等方面的新异特性,已经被应用到各种消费产品和行业中,如催化剂、陶瓷、润滑剂、涂料、电子和燃料[1],在镍氢电池、太阳能涂层、集成电路、靶向药物载体、磁共振成像、肿瘤热疗、磁疗保健产品等领域[1-2]具有广泛的应用,使其通过不同途径进入人体的机会大大增加,对机体的影响越来越引起人们的重视。研究[3-7]表明纳米镍可引起氧化应激、细胞毒性、细胞周期改变、细胞凋亡以及DNA损伤等反应。研究[8]还显示纳米材料的超微性使其可以轻松通过血睾屏障,引起生殖细胞损害。本课题组前期研究[9-10]发现,纳米镍对大鼠和线虫均具有生殖毒性作用,尤其对雄性大鼠生殖细胞具有明显损害。研究[11-13]发现,长链非编码RNA(long non-coding RNA,lncRNA),是一类长度一般超过200 nt的非蛋白编码RNA,主要从表观遗传、转录调控及转录后调控等层面调控基因表达。LncRNA与生殖发育及细胞凋亡关系密切,但lncRNA在环境污染物所致生殖损伤中的作用及其机制研究报道极少。因此,本研究应用SD大鼠睾丸生精-支持共培养细胞作为研究对象,探讨纳米镍对大鼠睾丸生精-支持共培养细胞凋亡的作用,以及凋亡相关lncRNA的表达变化。
1 材料与方法
1.1 材料
纳米镍,粒径90 nm,产品代号FNiN-80,黑色粉体,纯度99%,比表面积≥8 m3/g,松装密度0.06~0.80 g/cm3,购自昆山密友纳米科技有限公司。22~28 d龄SPF级雄性SD大鼠8只,每个实验2只,购自上海西普尔-必凯实验动物有限公司,生产许可证号SCXK(沪)2013-0016。DMEM高糖培养液,购于美国GE公司;Schiff试剂,购于北京Solarbio科技有限公司,噻唑蓝(MTT)购于美国Sigma公司,细胞凋亡-Hoechst染色试剂盒,购于上海碧云天生物技术有限公司,Annexin V-FITC细胞凋亡检测试剂盒,购于南京凯基生物科技发展有限公司。主要仪器:3423型CO2培养箱(美国Thermo Scientific公 司 ), FSX型 生 物 导 航 仪 (日 本Olympus公司),Epoch型酶标仪(美国Bio Tek公司),FACSCantoTMII流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 纳米镍的表征 使用含10%胎牛血清的DMEM培养液配制纳米镍溶液滴在铜网上,使用扫描电子显微镜和透射电子显微镜进行检测,结果用Nano Measurer 1.2.5软件分析纳米镍粒径分布。
1.2.2 大鼠睾丸生精-支持共培养细胞的提取取22~28 d雄性SD大鼠2只,颈椎脱臼处死,75%乙醇消毒阴囊皮肤,取双侧睾丸,放入预冷的D-Hank’s液中。剥除睾丸被膜,将实质剪碎成约1 mm3大小,加入D-Hank’s 液静置3 min,用D-Hank’s液冲洗2遍后转入三角烧瓶中。加0.25%的胰酶6 mL,37 ℃恒温水浴振荡30 min,至组织碎块变成线索状。加入少许血清终止消化,1 000 r/min离心5 min,2次。D-Hank’s液洗涤沉淀后加入0.1%胶原酶,37 ℃恒温低速振荡30 min。75 μm细胞筛过滤,将滤液800 r/min离心5 min,2次,用DMEM培养液洗涤,加入一定量培养液重悬沉淀物,吹打混匀。将细胞置于饱和湿度、37 ℃、CO2体积分数为5%的培养箱中孵育[14]。
1.2.3 大鼠睾丸生精-支持共培养细胞的鉴定在Feulgen染色法的基础上将盐酸水解的浓度、温度和时间进行了一定的改进。生精-支持共培养细胞接种于预置盖玻片的6孔板中,将共培养细胞爬片用PBS浸洗2次,95%酒精室温固定15 min,蒸馏水洗片。置于25℃、5 mol/L盐酸中30 min,蒸馏水冲洗2 min。加入Schiff试剂,37 ℃恒温箱放置50 min。0.5%偏重亚硫酸水洗3次,每次5 min。流水冲洗5 min,蒸馏水冲洗2 min。酒精梯度脱水,二甲苯透明,中性树胶封片。生物导航仪下观察结果,依据细胞形态鉴定生精细胞和支持细胞。
1.2.4 纳米镍染毒液的配制 设对照组与实验组,对照组不做处理,实验组分别加入不同浓度的纳米镍溶液。纳米镍染毒液配制方法如下:称取一定量的纳米镍粉体,使用DMEM培养液配置成800 μg/mL 的储备液,超声(100 W)分散30 min后使用0.22 μm滤器(美国Millipore公司)过滤除菌,4 ℃保存1周使用。检测前将纳米镍储备液超声分散30 min,使用DMEM培养液将储备液分别稀释到400、200、100、50和25 μg/mL。
1.2.5 MTT法检测细胞存活率 将大鼠睾丸生精-支持共培养细胞接种于96孔板中,37 ℃恒温培养过夜。对照组加入细胞培养液,实验组分别加入5、50、100、200、400和800 μg/mL纳米镍溶液,每组设定4个复孔。培养24 h后吸去染毒液,将MTT溶液使用不含血清的培养液稀释至0.5 mg/mL,每孔加入200 μL,继续培养4 h。弃上清,每孔加入150 mL的DMSO,轻微振荡,使结晶充分溶解。采用酶标仪测定490 nm处的吸光度D(490)值,计算细胞存活率,公式为:
细 胞 存 活 率(%)=[D(490)实验组- D(490)空白组] /[D(490)对照组-D(490)空白组]×100%
1.2.6 Hoechst33258染色法检测细胞凋亡形态将生精-支持共培养细胞接种于预置盖玻片的6孔板中,37 ℃恒温培养过夜。对照组加入细胞培养液,实验组分别加入25、50、100、200 μ g/mL纳米镍溶液,每组设定4个复孔。24 h 后,弃培养液,加入0.5 m L固定液,固定10 min或更长时间(可4 ℃过夜)。去除固定液,PBS洗两次,每次3 m in。0.5 m L H oechst33258染液染色5 m in。去染色液,PBS洗两次,每次3 min。滴1滴抗荧光淬灭封片液于载玻片上,盖上已贴附细胞的盖玻片,让细胞接触封片液。生物导航仪观察细胞形态。
1.2.7 流式细胞术检测细胞凋亡 将生精-支持共培养细胞接种于6孔板中培养24 h,对照组加入细胞培养液,实验组分别加入 25、50、100和200、400 μg/mL纳米镍溶液。每组4个复孔,继续培养24 h。染毒结束后,弃染毒液,PBS清洗2次,每孔加入300 μL不含EDTA的胰酶消化,1 min后加600 μL含10%胎牛血清培养液终止消化。细胞收集于EP管中,1 000 r/min离心10 min,用PBS洗涤细胞2次。将细胞悬浮于200 μL结合缓冲液中,加入5 μL的膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和5 μL碘化丙啶(PI),轻轻混匀,进行双染,室温避光反应15 min。加入200 μL结合缓冲液,采用流式细胞仪检测(激发波长为488 nm,发射波长为530 nm,Annexin V-FITC的绿色荧光通过FL1通道检测,PI红色荧光通过FL2通道检测)。1.2.8 LncRNA表达谱芯片检测 染毒24 h后,对照组和100 μg/mL纳米镍染毒组(根据细胞凋亡实验结果,发现100 μg/mL纳米镍染毒组的凋亡率与对照组比较有显著性差异,但又不会产生过高毒性,符合基因芯片检测要求)分别加入1 mL Trizol收集细胞;使用NanoDrop ND-1000分光光度计测D(260)/D(280)值,以评估总RNA的纯度,使用标准变性琼脂糖胶凝电泳检测总RNA的完整性;送至上海高通生物科技有限公司进行检测。
1.3 统计学方法
用Excel建立数据库,数据用SPSS for Windows 20.0统计软件进行处理。多组间的比较采用方差齐性检验和单因素方差分析(One-Way ANOVA)。剂量效应分析,采用两变量直线相关分析(bivariate correlation)。进一步进行组间两两比较时,若方差齐,采用LSD-t检验;若方差不齐,采用Games-Howell检验。检验水准α=0.05。
2 结果
2.1 纳米镍表征结果
扫描电子显微镜观察,纳米镍呈球形,粒径在30~100 nm,有一定团聚。透射电子显微镜观察,纳米镍呈规则球状,粒径分布不均匀,在25~125 nm ,有一定团聚。如图1所示。

图1 纳米镍电子显微镜观察图
2.2 Feulgen染色法鉴定生精-支持共培养细胞
Feulgen染色结果见图2。如图所示,支持细胞形状不规则,胞体较大,胞核呈椭圆形,胞质呈网状,核仁区着色较淡,紫色的细胞核内清晰可见染成深紫色的双极小体;生精细胞呈圆形或卵圆形,胞核较大,胞质极少,圆形或卵圆形的核占据了整个细胞体积的 90%。
2.3 纳米镍对大鼠睾丸生精-支持共培养细胞存活率的影响
不同浓度纳米镍染毒大鼠睾丸生精-支持共培养细胞24 h后细胞存活率变化如图3所示。大鼠睾丸生精-支持共培养细胞暴露于不同剂量的纳米镍24 h后,细胞存活率呈现剂量依赖性下降(P<0.01,r=0.784)。与对照组比较,所有剂量组细胞存活率均降低(P<0.01)。
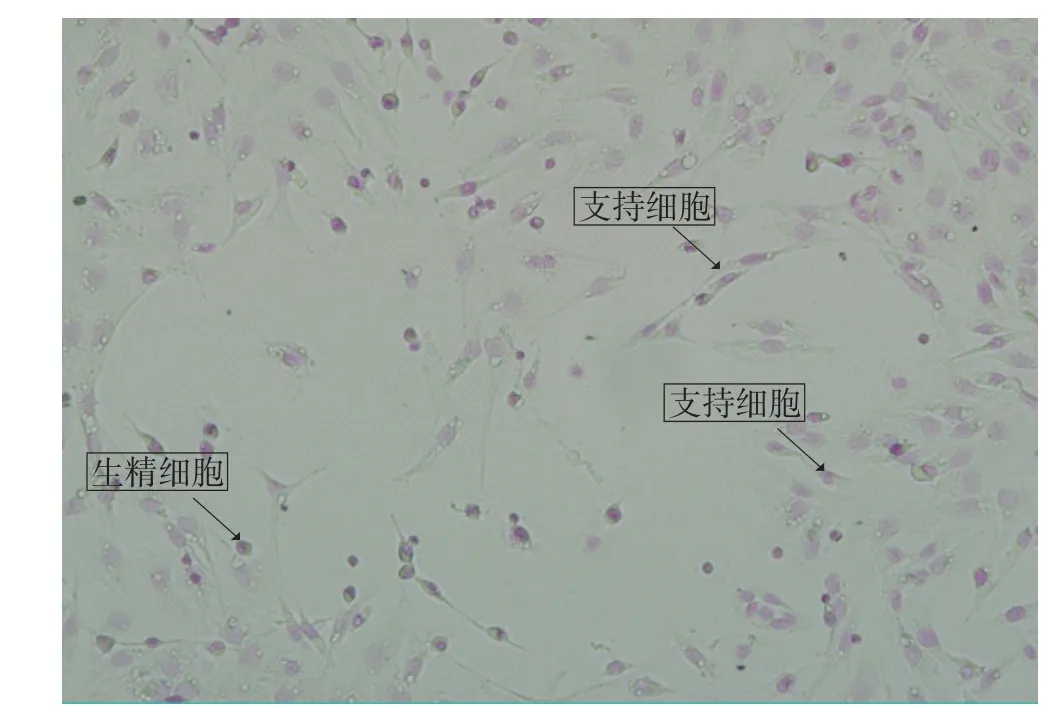
图2 Feulgen染色法鉴定生精-支持共培养细胞(×200)
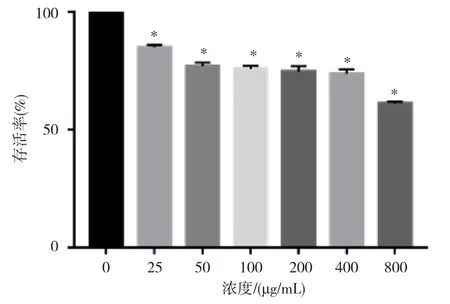
图3 纳米镍染毒后大鼠生精-支持共培养细胞存活率的改变(,n=4)
2.4 纳米镍对SD大鼠生精-支持共培养细胞形态的影响
Hoechst33258染色后,在荧光显微镜下观察,正常细胞的细胞核呈正常的蓝色,细胞发生凋亡时,染色质会固缩。所以染色时,细胞核会呈致密浓染,或呈碎块状致密浓染。如图4所示,倒置显微镜下观察,对照组细胞(图4A)呈正常蓝色,细胞核内DNA分布相对均匀,细胞核无固缩,在视野中呈现体积较大的且染色颜色较浅的核形态。处理组细胞(图4B、C、D、E)细胞核出现不同程度的固缩、染色质聚集、边缘化等典型的细胞凋亡核形态学改变。
2.5 纳米镍对大鼠睾丸生精-支持共培养细胞凋亡率的影响
如图5所示,在Annexin V/PI双染法流式检测结果中,不同浓度纳米镍染毒大鼠睾丸生精-支持共培养细胞总凋亡率的改变见图6。与对照组相比,染毒24 h后,随着染毒剂量的升高,细胞凋亡率呈剂量依赖性增加(P<0.01,r=0.844):染毒剂量为25、50、100、200、400 μg/mL时,其凋亡率分别为8.80%±0.50%、11.00%±0.70%、12.53%±0.71%、15.95%±0.54%和17.80%±0.76%,且各剂量组细胞凋亡率与对照组(2.65%±0.74%)比较均明显增加(P<0.01)。
2.6 总RNA质量检测结果
对实验组和对照组细胞样品提取的总RNA进行吸光度D(260)值测定,样本浓度分别为344.9和346.1 ng/μL,具体结果见表1,RNA总量及质量符合lncRNA微阵列的检测要求。总RNA经琼脂糖电泳后,可见18 S和28 S两条清晰的条带(图7),证实已经获得高纯度完整的总RNA。

图4 Hoechst33258染色法观察纳米镍对大鼠生精-支持共培养细胞形态的影响(×250)
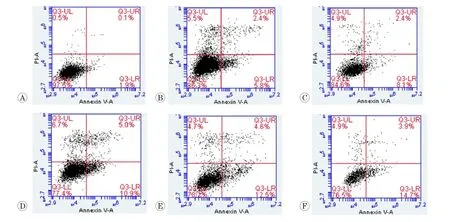
图5 Annexin V/PI双染法检测不同剂量纳米镍对大鼠睾丸生精-支持共培养细胞凋亡率的影响

图6 纳米镍对大鼠睾丸生精-支持共培养细胞总凋亡率的影响(n=4,)
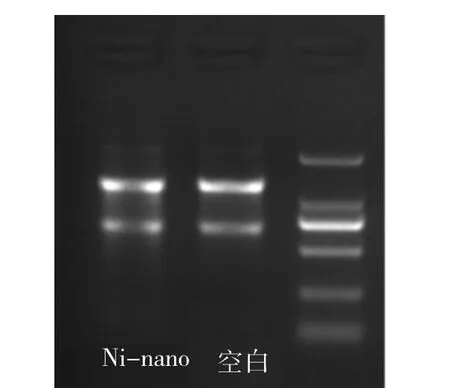
图7 细胞总RNA琼脂糖电泳结果
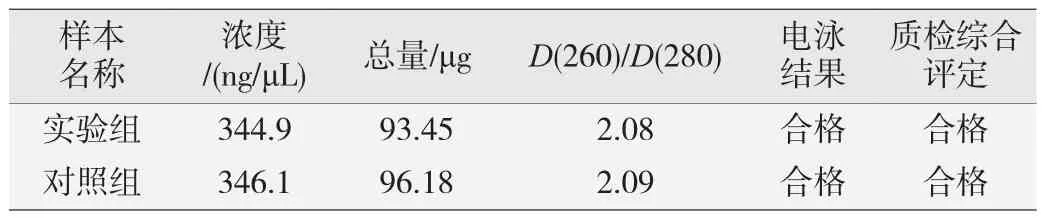
表1 总RNA质量检测结果
2.7 凋亡相关lncRNA挑选结果
基因芯片检测结果显示,涉及的凋亡相关通路有PI3K-Akt信号通路、HIF-1信号通路、p53信号通路、MAPK信号通路、Gap junction信号通路、Hippo信号通路、Chemokine信号通路、TGF-beta信号通路,Protein processing in endoplasmic reticulum信号通路和Jak-STAT信号通路。其中,参与这些凋亡通路的lncRNA共169个,实验组与对照组相比,上调的有117个,下调的有52个(倍数绝对值≥2.0,P≤0.05)。本研究在前期芯片检测基础上进一步构建lncRNA-miRNA-mRNA共表达网络,结合生物信息学分析,从中挑选凋亡相关lncRNA,为进一步的功能及机制研究提供参考。

图8 凋亡相关lncRNA-miRNA-mRNA共表达网络图
3 讨论
本文选择大鼠睾丸生精-支持共培养细胞来研究纳米镍对睾丸细胞的凋亡作用,并以此为基础进一步探讨纳米镍生殖损害作用的分子机制问题。本研究首先建立大鼠睾丸生精-支持细胞原代共培养模型,并在Feulgen染色法基础上进行一定的改进,对生精-支持共培养细胞进行鉴定分析,发现本研究所建立的生精-支持细胞体系中支持细胞形状不规则,胞体较大、胞核呈椭圆形、胞质呈网状、核仁区着色较淡,紫色的细胞核内清晰可见染成深紫色的双极小体;而生精细胞呈圆形或卵圆形,胞核大,胞质极少,核占据绝大部分细胞体积。结果表明本课题建立的大鼠睾丸生精-支持细胞原代共培养模型与资料和其他文献是相符的,可以应用于其他研究。本课题应用MTT法检测大鼠睾丸生精-支持共培养细胞的细胞活性、Hoechst33258染色法和Annexin V-FITC法检测了纳米镍对大鼠睾丸生精-支持共培养细胞的凋亡作用的影响,发现纳米镍能引起大鼠睾丸生精-支持共培养细胞存活率的下降,并表现出剂量效应关系;同时,导致大鼠睾丸生精-支持共培养细胞凋亡率的显著性增加,且在高剂量时(400 μg/mL)时,凋亡细胞大量出现,凋亡率达17.8%。lncRNA基因芯片检测结果显示与凋亡相关的LncRNA共169个,实验组与对照组相比,上调的有117个,下调的有52个。接着建立lncRNA-miRNA-mRNA共表达网络,通过生物信息学对lncRNA共表达的miRNA和mRNA进行分析,从而明确lncRNA对关键信号通路的调控作用不仅可深入探讨环境污染物毒性作用的调控机制,更重要的是为疾病的预防、诊断和治疗提供可能的有潜力的生物标志和治疗靶标。
在本课题组前期的研究当中,体内研究表明[9]纳米镍对雄性SD大鼠有生殖毒性,可损伤大鼠睾丸结构和精子运动功能。纳米镍诱导秀丽线虫生殖毒性的结果表明,与微米镍相比较,纳米镍具有更高的生殖毒性,包括育雏数量减少,受精卵和精子激素活化,世代时间和不成熟的精子细胞增加[10]。 Gallo等[15]研究了纳米镍暴露对海洋无脊椎动物(海鞘类)精子质量的影响。研究结果提示,纳米镍诱导氧化应激导致脂质过氧化和DNA片段化并改变线粒体膜电位和精子形态。研究显示[1-5],纳米镍能改变细胞周期、升高ROS水平、损伤DNA和改变某些细胞因子,最终导致一系列毒性。我们前期研究还显示纳米镍可通过诱导生殖细胞凋亡产生生殖损害,并且Caspase通路在其中发挥着重要作用[12]。本次研究表明纳米镍可以导致大鼠睾丸生精-支持共培养细胞凋亡,凋亡可能是纳米镍引起细胞毒性的关键机制,lncRNA和生殖发育及细胞凋亡关系密切,但lncRNA在环境污染物所致生殖损伤中的作用及其机制研究报道极少。因此,本研究在基因芯片的检测基础上进一步构建lncRNA-miRNA-mRNA共表达网络,本课题组将结合生物信息学分析进一步筛选凋亡相关lncRNA,后期准备深入研究纳米镍引起的生殖细胞凋亡过程中的分子机制及lncRNA在其中的调控作用,不仅可以明确纳米材料生殖毒性的分子机制,更重要的是为生殖损伤的预防和治疗提供生物标志和治疗靶标,对保护生殖健康以及制定纳米镍安全性评价标准有着极其重要的科学和实际意义。
[1] SANTOS F C F,GOMES S I L,SCOTT-FORDSMAND J J,et al. Hazard assessment of nickel nanoparticles in soil-The use of a full life cycle test with enchytraeus crypticus[J]. Environ Toxicol Chem,2017,36(11):2934-2941.
[2] MIRI A H,SHAKIB E S,EBRAHIMI O,et al. Impacts of nickel nanoparticles on grow characteristics,photosynthetic pigment content and antioxidant activity of coriandrum sativum L[J]. Orient J Chem,2017,33(3):1297-1303.
[3] WAN R,MO Y,CHIEN S,et al. The role of hypoxia inducible factor-1α in the increased MMP-2 and MMP-9 production by human monocytes exposed to nickel nanoparticles[J]. Nanotoxicology,2011,5(4):568-582.
[4] ZHANG W,LI Y,NIU J,et al. Photogeneration of reactive oxygen species on uncoated silver,gold,nickel,and silicon nanoparticles and their antibacterial effects[J]. Langmuir,2013,29(15):4647-4651.
[5] PETERS K,UNGER R E,GATTI A M,et al. Metallic nanoparticles exhibit paradoxical effects on oxidative stress and pro-inflammatory response in endothelial cells in vitro[J]. Int J Immunopathol Pharmacol,2007,20(4):685-695.
[6] AHAMED M. Toxic response of nickel nanoparticles in human lung epithelial A549 cells[J]. Toxicol In Vitro,2011,25(4):930-936.
[7] ALARIFI S,ALI D,ALAKHTANI S,et al. Reactive oxygen species-mediated DNA damage and apoptosis in human skin epidermal cells after exposure to nickel nanoparticles[J]. Biol Trace Elem Res,2014,157(1):84-93.
[8] ISPAS C,ANDREESCU D,PATEL A,et al. Toxicity and developmental defects of different sizes and shape nickel nanoparticles in zebrafish[J]. Environ Sci Technol, 2009,43(16):6349-6356.
[9] KONG L,TANG M,ZHANG T,WANG D,HU K,LU W,et al. nickel nanoparticles exposure and reproductive toxicity in healthy adult rats[J]. Int J Mol Sci,2014,15(11):21253-21269.
[10] KONG L, GAO X,ZHU J,et al. Reproductive toxicity induced by nickel nanoparticles in Caenorhabditis elegans[J].Environ Toxicol,2017,32(5):1530-1538.
[11] KINO T,HURT D E,ICHIJO T,et al. Noncoding RNA gas5 is a growth arrest- and starvation-associated repressor of the glucocorticoid receptor[J]. Sci Signal,2010,3(107):8.
[12] HUARTE M,GUTTMAN M,FELDSER D,et al. A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response[J]. Cell,2010,142(3):409-419.
[13] HUNG T, WANG Y, LIN M F, et al. Extensive and coordinated transcription of noncoding RNAs within cell-cycle promoters[J]. Nat Genet,2011,43(7):621-629.
[14] 季佳佳. 二硫化碳对共培养大鼠睾丸支持—生精细胞凋亡和凋亡相关蛋白表达的影响[D]. 武汉:华中科技大学,2008.
[15] GALLO A,BONI R,BUTTINO I,TOSTI E. Spermiotoxicity of nickel nanoparticles in the marine invertebrate Ciona intestinalis (ascidians)[J]. Nanotoxicology, 2016, 10(8):1096-1104.
