大蒜素对顺铂肾毒性的保护作用
2018-02-05韩何丹高丽萍
韩何丹 王 海 高丽萍*
(1. 北京联合大学生物化学工程学院,北京100023;2. 生物活性物质与功能食品北京市重点实验室,北京 100023)
顺铂(cisplatin,DDP)作为第1个铂类药物目前依旧是肿瘤化疗的常用药物,无论是单独施药还是和其他药物联用都表现出明显的抗肿瘤作用,它对睾丸癌、卵巢癌、乳腺癌、肺癌、胃癌、膀胱癌、恶性淋巴瘤和软组织肉瘤等均有较好疗效,且抗肿瘤效果与剂量使用呈现一定的关系[1-4]。但顺铂在临床治疗上常伴随有一定的毒副作用,并随着使用剂量的增加顺铂的毒副作用也越来越明显,这些毒副作用包括恶心、呕吐、骨髓抑制引起的过敏反应、肾毒性、心脏毒性等,其中肾毒性是限制顺铂临床使用剂量的主要原因[5-7]。DDP肾毒性的表现形式多种多样,包括从可逆的急性肾功能损伤到伴有显著的肾组织学改变的不可逆慢性肾功能衰竭[8]。因此,减轻DDP肾毒性显得尤为重要。
实验研究表明使用一些天然产物或合成抗氧化剂可有效减轻顺铂的毒副作用,如葡萄籽原花青素,在体内抗氧化及消除自由基的能力是维生素C的20倍,Yousef等[9]发现葡萄籽原花青素能够降低DDP诱导的机体各组织中硫代巴比妥酸反应物的水平,提高抗氧化酶的活性以及谷胱甘肽和总蛋白来对抗顺铂肾毒性;El-Sayed等[10]研究表明肉毒碱可以通过提高心肌组织中的抗氧化水平来拮抗顺铂引发的大鼠血清心肌酶谱变化,改善心肌氧化损伤。因此,寻找合适的抗氧化物质用于临床减轻顺铂毒副作用有很重要的意义[11-13]。
大蒜素(allicin)是从大蒜头中提取的一种天然有机硫化合物,学名二烯丙基硫代亚磺酸酯,结构式为CH2=CHCH2S(O)SCH2CH=CH2。大蒜素常应用于临床治疗中,药物动力学与流行病学研究表明,大蒜素对肝癌、肺癌等肿瘤有较好的疗效,且大蒜素还具有抑菌、抗氧化、提高免疫力、降低血压、血脂等广泛的生物学活性[14-15]。目前国内关于大蒜素对顺铂肾毒性影响的研究仍处于起步阶段,大蒜素减轻DDP所致肾损伤的具体原因尚不清楚。为此,本课题以人胚肾细胞(human embryonic kidney 293 cell,HEK293)为研究对象,对大蒜素拮抗DDP肾毒性的作用机制进行探讨。
1 材料与方法
1.1 材料与试剂
HEK293细胞购自中国医学科学院基础医学研究所北京协和医学院基础学院细胞中心;DDP(注射用粉剂)购自齐鲁制药公司(无菌生理盐水溶解);大蒜素(纯度≥90%)由生物活性物质与功能食品北京市重点实验室提取(无水乙醇溶解后双蒸水稀释,大蒜素工作液乙醇含量<0.1%);胎牛血清购自Hyclone公司;DMEM培养基胰酶、双抗均购自北京鼎国昌盛生物技术有限责任公司;四甲基偶氮噻唑蓝(methyl thiazolyl tetrazolium,MTT),购自美国Sigma公司;BCA蛋白浓度测定试剂盒、丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathion,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒,均购自南京建成生物工程研究所;其他试剂均为分析纯。
1.2 细胞培养
HEK293细胞常规培养于含有15%新生胎牛血清和双抗(100 μg/mL链霉素,100 U/mL青霉素)的DMEM高糖培养基中,培养箱环境为37 ℃、CO2体积分数5%、饱和湿度。待细胞汇合度至80%~90%时,用胰酶消化,1∶3进行传代,每隔1 d换一次培养基,每2~3 d传代1次,取对数生长期细胞接种于培养瓶中。
1.3 MTT法检测细胞活力
1.3.1 DDP对HEK293细胞的毒性作用 将100 μL (浓度为1×105/mL) 的HEK293细胞接种到96孔板中,待细胞生长到汇合状态,加入终浓度分别为0、0.5、1、2、4、8、16、32、64、128 mg/L的DDP,每组设6个复孔,培养箱孵育24 h,然后加入终浓度为0.5 mg/mL MTT,继续孵育4 h,弃上清后每孔加入DMSO 150 μL,混合均匀,570 nm处检测吸光度D(570)值,以未添加DDP组作为空白对照孔,细胞抑制率计算方法:细胞抑制率=1-D(570)实验组/ D(570)对照组,并计算DDP对HEK293细胞的LD50值,由此确定DDP诱导HEK293细胞损伤模型的最佳使用浓度。
1.3.2 大蒜素作用后HEK293细胞的存活率 处理方法同上,大蒜素终浓度依次为0、0.25、0.5、1、2、4、8、16、32 mg/L,细胞生长存活率计算方法:
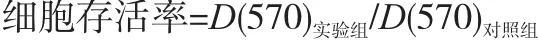
1.3.3 大蒜素对DDP所致HEK293细胞毒性作用的影响 将100 μL(浓度为1×105/mL)处于生长期的细胞接种到96孔板中,待细胞生长至汇合状态时,加药处理。试验分4组:①对照组,未加入DDP和大蒜素;②DDP组,HEK293细胞DDP浓度为20 mg/L;③大蒜组+DDP,在加DDP前24 h分别加入不同浓度大蒜素(1、2、3、4、5、6、7、8 mg/L)孵育细胞。不加药的组在加药时加入相应体积的溶剂做为对照。每组设6个复孔,在 37 ℃、CO2体积分数为5%的孵育培养箱中培养24 h测定细胞存活率。
1.4 HEK293细胞蛋白浓度测定及细胞内GSH、SOD、MDA的测定
细胞分为4个组:①正常对照组,未加入DDP和大蒜素;②大蒜素保护组,加入2 mg/L大蒜素;③DDP模型组,加入20 mg/L DDP;④大蒜素和DDP 联合处理组,加入4 mg/L大蒜素和20 mg/L DDP;将2 mL(浓度为1×105/mL)处于生长期的细胞接种到6孔板中,待细胞生长至融合状态时,按照实验分组加药处理。继续培养24 h后除去培养液,PBS洗一遍,每孔加入300 μL PBS,用细胞刮收集细胞后,将装有细胞悬液的离心管放在冰水浴中,用细胞破碎仪破碎1 min;取匀浆液12 000 r/min离心10 min,收集上清液,按照测试盒说明进行操作,测定细胞蛋白浓度,并采用黄嘌呤氧化酶法检测各组细胞内超氧化物歧化酶(SOD)活力,硫代巴比妥酸法测定细胞内丙二醛(MDA)含量,二硫代二硝基苯甲酸法测定还原型谷胱甘肽(GSH)的含量。
1.5 统计学方法
2 结果
2.1 DDP对HEK293细胞的毒性作用
DDP对HEK293细胞存活率的影响见图1,不同浓度的DDP作用于HEK293细胞24 h后,对细胞生长有不同程度的抑制作用。随着DDP浓度不断升高,细胞抑制率逐渐升高,且呈现剂量依赖性。由SPSS统计分析得出,DDP对HEK293的半数致死剂量(LD50)为19.78 mg/L,其中,20 mg/L是与半数致死剂量最为接近的整数浓度,为提高后续试验的效率,选择将其作为建立DDP损伤模型的浓度。

图1 不同浓度DDP对HEK293细胞生长抑制率的影响(n=6)
2.2 大蒜素对HEK293细胞存活率的影响
大蒜素对HEK293细胞存活率的影响见图2,不同浓度的大蒜素作用于HEK293细胞24 h后,对细胞存活率有不同程度的影响。在一定范围内(0~2 mg/L)细胞存活率随大蒜素浓度的增加而逐渐升高,且与正常对照组相比,差异均有统计学意义(P<0.05或P<0.01)。大蒜素浓度为2 mg/L时,细胞存活率最高,当浓度大于最佳生长浓度时,细胞存活率逐渐下降,当大蒜素浓度高于16 mg/L时,可显著抑制HEK293细胞的生长(P<0.01)。由此说明,大蒜素对HEK293细胞的影响具有“低浓度促进,高浓度抑制”的特点。

图2 不同浓度大蒜素对HEK293细胞存活率的影响(n=6)
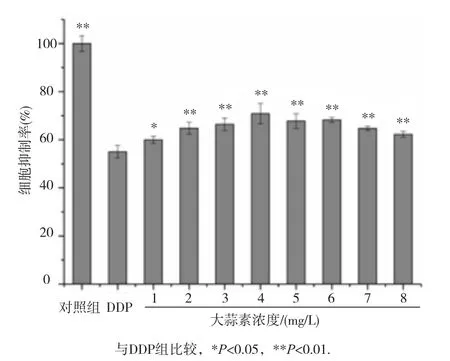
2.3 大蒜素对DDP所致HEK293细胞毒性的影响
大蒜素对DDP引起的细胞毒性的影响见图3,用终浓度为20 mg/L的DDP作用HEK293细胞24 h建立细胞损伤模型。和DDP组相比,当大蒜素浓度为4 mg/L,细胞存活率最高,当浓度高于4 mg/L,大蒜素的减毒作用逐渐减小,提示在一定浓度范围内大蒜素对DDP诱发的HEK293细胞毒性有显著的保护作用。
2.4 大蒜素对DDP作用后的HEK293细胞内GSH含量、MDA含量和SOD活力的影响
大蒜素对DDP作用后的细胞抗氧化指标的影响见图4,DDP作用于HEK293细胞24 h,GSH含量[(25.28±4.09) μmol/g]较正常对照组[(72.11±6.32) μmol/g]显著降低(P<0.01),经大蒜素提前24 h孵育后,该组GSH含量[(50.31± 8.80) μmol/g]较 DDP组 显 著 升 高 (P<0.01),SOD活力也有类似的效果。DDP造成细胞MDA含量[(0.64± 0.10) nmol/mg]较 正 常 对 照 组 [(0.38± 0.06)nmol/mg]显著升高(P<0.01),而大蒜素干预后,相对于DDP组 , MDA含 量 [(0.51± 0.08) nmol/mg]显 著 降 低(P<0.01)。结果表明,大蒜素对DDP造成的细胞氧化损伤有一定的保护作用。

图4 大蒜素对DDP所致细胞抗氧化指标变化的影响(n=3)
3 讨论
很多研究证实了顺铂所致机体毒副作用中氧化应激的重要性。顺铂所致肾毒性和肾组织中脂质过氧化反应增多密切相关[16-18],该药能引起活性氧类物质的产生如超氧化物阴离子、羟基自由基等。也有报道称,以顺铂为基础的化疗会引起病人血浆中的各种抗氧化物质浓度降低,这种情况会使“机体通过抗氧化机制对抗自由基引起的器官损伤、基因毒害”的预防方案失败,从而会进一步引起正常组织的癌变[19]。然而,顺铂所致毒性的准确机制尚不清楚,明确这些机制有助于开发新的保护措施。
日本学者藤田勋早在2006年便提出-S(O)S-CH2-CH=CH-基团是大蒜素的抗氧化活性部位,烯丙基位的氢与抗氧化活性有关[20]。已经证实大蒜素的抗氧化活性还归因于巯基(-SH)的修饰作用[21]。自由基学说认为,导致机体氧化损伤的罪魁祸首是自由基,机体在代谢过程中不断产生诸如二苯代苦味酸基自由基(DPPH·)、羟自由基(·OH)以及超氧自由基(O2-.)等,研究表明,大蒜素对各类自由基具有清除作用,可降低机体的氧化水平。García-Trejo等[22]通过建立大鼠慢性肾病模型研究大蒜素对高血压和心脏功能的影响,结果表明大蒜素治疗可降低高血压、改善肾和心脏功能障碍,大蒜素还能增强抗氧化酶活性,减少氧化应激作用。另外,大蒜素可通过激活GSH的合成来抑制肿瘤细胞的生长,具体表现为GSH可将细胞毒素迅速分解[23]。而作为细胞内主要的抗氧化剂之一,GSH在清除自由基、维持细胞膜通透性、保护细胞结构方面发挥重要作用。除此之外,GSH还对DNA的合成进行调节。Helen等[24]对尼古丁导致的脂质过氧化作用的小鼠进行试验,发现大蒜素能明显增强小鼠抵抗尼古丁脂质过氧化作用,这是因为小鼠服用大蒜素后,抗氧化物酶活性增强,且GSH得到积累。本研究结果表明,DDP导致HEK293细胞GSH含量显著降低,而大蒜素则能够明显提高GSH含量,提示大蒜素对DDP造成的细胞损伤具有一定的保护作用。
顺铂进入机体后诱发产生的大量自由基等活性氧类物质,氧自由基不但通过生物膜中多不饱和脂肪酸的过氧化引起细胞损伤,而且还能通过脂质过氧化物的分解产物造成细胞损伤。MDA作为脂质过氧化反应的一种重要代谢产物,其含量增加会破坏细胞膜。SOD是一种金属蛋白,能够清除氧自由基,从而保护细胞免受超氧化物自由基的损伤[25]。SOD活力的高低间接反映了机体清除氧自由基的能力,而MDA的高低又间接反映了机体细胞受自由基攻击的严重程度。因此,二者结合的测定结果可评价细胞的氧化还原状态。本研究结果表明DDP可诱发细胞SOD活性降低,这是DDP直接与SOD活力点巯基基团结合所致[26],也可能是由于DDP诱发细胞产生的NO可与超氧化物阴离子反应生成超氧亚硝基阴离子,后者能抑制SOD的活性。我们的研究结果发现,经4 mg/L的大蒜素干预后,相对于DDP模型组,细胞SOD活力提高35.8%,MDA含量降低23.9%,说明大蒜素能够清除超氧化物阴离子等自由基,减少脂质过氧化反应,减轻DDP引起的氧化应激,从而拮抗DDP肾毒性。
本研究结果表明,在一定浓度范围大蒜素能够提高细胞存活率,大蒜素预处理可显著提高顺铂导致的HEK293细胞的抗氧化水平的降低,提示大蒜素对顺铂肾毒性具有明显的保护作用。
[1] ABRAMS T J,LEE L B,MURRAY L J,et al. SU11248 inhibits KIT and platelet-derived growth factor receptor β in preclinical models of human small cell lung cancer[J]. Mol Cancer Ther,2003,2(5):471-478.
[2] MAURMANN L,BELKACEMI L,ADAMS N R,et al. A novel cisplatin mediated apoptosis pathway is associated with acid sphingomyelinase and FAS proapoptotic protein activation in ovarian cancer[J]. Apotosis,2015,20(7):960-974.
[3] CHAU C,WHEATER M,GELDART T,et al. Clinical outcomes following neoadjuvant cisplatin-based chemotherapy for bladder cancer in elderly compared with younger patients[J].Eur J Cancer Care(Engl),2015,24(2):155-162.
[4] PRABHAKARAN P,HASSIOTOU F,BLANCAFORT P,et al. Cisplatin induces differentiation of breast cancer cells[J].Front Oncol,2013,3:134.
[5] 邓成艳,黄荣丽,连利娟,等. 顺铂的毒副作用及其防治[J].中华妇产科杂志,1995,30(5) :376-379.
[6] KINTZEL P E. Anticancer drug-induced kidney disorders[J].Drug Saf,2001,24(1):19-38.
[7] RABIK C A,DOLAN M E. Molecular mechanisms of resistance and toxicity associated with platinating agents[J]. Cancer Treat Rev,2007,33(1):9-23.
[8] 孙家跃. 顺铂肾毒性机制及防护方法的研究进展[J]. 中国医院用药评价与分析,2010,10(5):478-480.
[9] YOUSEF M I,SAAD A A,EI-SHENNAWY L K. Protective effect of grape seed proanthocyanidin extract against oxidative stress induced by cisplatin in rats[J]. Food Chem Toxicol,2009,47(6):1176-1183.
[10] EL-SAYED E,EL-AWADY,YASSER M,et al. Cisplatineinduced cardio toxicity:mechanisms and cardio protective strategies[J]. Eur J Pharmacol,2011,650:335-341.
[11] ALI B H,AL MOUNDHRI M S. Agents ameliorating or augmenting the nephrotoxicity of cisplatin and other platinum compounds:a review of some recent research[J]. Food Chem Toxicol,2006,44:1173-1183.
[12] SAHU B D,RENTAM K K,PUTCHA U K,et al. Carnosic acid attenuates renal injury in an experimental model of rat cisplatin-induced nephrotoxicity[J]. Food Chem Toxicol,2011,49(12):3090-3097.
[13] SANDEEP D,KRISHNAN NAIR C K. Amelioration of cisplatin-induced nephrotoxicity by extracts of Hemidesmus indicus and Acorus calamus[J]. Pharm Biol,2010,48(3):290-295.
[14] 李娜. 大蒜的功效成分及其应用的研究进展[J]. 中国食物与营养,2007,11:25-27.
[15] 徐巍,苏乐群,李宏建. 大蒜素的研究进展[J]. 中国医院药学杂志,2007,06:115-121.
[16] ANTUNES L M,DARIN J D,BIANCHI M D. Protective effects of vitamin C against cisplatin-induced nephrotoxicity and lipid peroxidation in adult rats:a dose-dependent study[J].Pharmacol Res,2000,41(4):405-411.
[17] KARTHIKEYAN K, BAI B R, DEVARAJ S N.Cardioprotective effect of grape seed proanthocyanidins on isoproterenol-induced myocardial injury in rats[J].Int J Cardiol,2007,115(3):326-333.
[18] SATOH M,KASHIHARA N,FUJIMOTO S,et al. A novel free radical scavenger,edarabone,protects against cisplatininduced acute renal damage in vitro and in vivo[J]. J Pharmacol Exp Ther,2003,305(3):1183-1190.
[19] WOZNIAK K,CZECHOWSKA A,BLASIAK J. Cisplatinevoked DNA fragmentation in normal and cancer cells and its modulation by free radical scavengers and thetyrosine kinase inhibitor STI571[J]. Chem Biol Interact,2004,147(3):309-318.
[20] 贺玉琢.日本药学会第124次年会论文摘要[J].国外医学(中医中药分册),2005,2:115-121.
[21] PRASAD K,LAXDAL V A,YU M,et al. Antioxidant activity of allicin,an active principle in garlic[J]. Mol Cell Biochem,1995,148(2):183-189.
[22] GARCÍA-TREJO E M,ARELLANO-BUENDÍA A S,ARGÜ ELLO-GARCÍA R,et al. Effects of allicin on hypertension and cardiac function in chronic kidney disease[J]. Oxid Med Cell Lar Longev,2016,2016:3850402.
[23] 蒋淑婉,李云,陈鹤. 大蒜素的抗肿瘤作用及其机制研究进展[J]. 医学综述,2013,19(08):1420-1422.
[24] HELEN A,RAJASREE C R,KRISHNAKUMAR K,et al.Antioxidant role of oils isolated from garlic (Allium sativum Linn)and onion (Allium cepa Linn) on nicotine-induced lipid peroxidation[J]. Vet Hum Toxicol,1999,41(5):316-319.
[25] YILDIRIM Z,SOGUT S,ODACI E,et al. Oral erdosteine administration attenuates cisplatin-induced renal tubular damage in rats[J]. Pharmacol Res,2003,47(2):149-156.
[26] ZHANG J G,ZHONG L F,ZHANG M,et al. Protection effects of procaine in oxidative stress and toxicities of renal oortical sfices from rats caused by eisplatin in vitro[J]. Arch Toxicol,1992,66(5):354-358.
