一株优选酿酒酵母增殖培养条件优化及发酵动力学模型的构建
2018-02-01蒋艾廷李新玲姜淑娟妥彦峰马凤莲韩京津牟光庆
蒋艾廷, 李新玲,*, 姜淑娟, 妥彦峰, 钱 方, 马凤莲, 韩京津, 牟光庆,*
(1.新疆天润生物科技股份有限公司, 新疆 乌鲁木齐 830088; 2.大连工业大学 食品学院, 辽宁 大连 116034)
*李新玲,女,高级工程师,主要从事乳品方面的研究,通信作者;
*牟光庆,男,教授,博士,主要从事乳品方面的研究,通信作者。
益生菌是指在合适的剂量下能够对人或动物产生正面效益的活性微生物[1],主要包括一些乳杆菌属、双歧杆菌属和酵母[2-3]。酵母菌是与人们日常生活密切相关的微生物之一,对人体的益生作用主要表现在免疫调节、吸收胆固醇、排毒和抑制病原菌繁殖等方面[4-6],酿酒酵母因其独特的微生物学特性和优越的发酵性能,被广泛地应用于食品、饲料、医药、生物工程等领域[7-10]。
在发酵食品,如发酵乳制品、酒类以及面包的工业化生产过程中,酿酒酵母通常以直投式发酵剂的形式被添加进基料中,以达到缩短发酵时间、减少生产成本、稳定产品质量的目的[11]。而发酵剂中微生物细胞的数量与活力是影响产品品质的关键因素[12],因此增殖培养成为制备高活性发酵剂的通用手段之一。目前国内外研究人员[13-16]主要采用单因素结合响应面的方法优化微生物的增殖培养基,来获得高浓度的细胞数量或代谢产物。发酵动力学主要是研究环境因素与微生物代谢活动之间的相互作用及随时间变化的规律,客观反映发酵过程的动态特征。罗建平等[17]研究了黑曲霉在优化条件下发酵麦麸生产β-葡萄糖苷酶的动力学模型,为β-葡萄糖苷酶的工业生产提供了参考。姜勇等[18]在优化鼠李糖乳杆菌的发酵条件和培养基组成的基础上建立了发酵动力学模型,发现高浓度的初始葡萄糖底物与代谢产物乳酸的积累会抑制发酵过程中细胞的生长。而有关酿酒酵母在增殖培养基中的生长规律、发酵动力学及模型鲜有报道,因此研究拟以一株优良的乳源性酿酒酵母为实验菌株,通过正交与响应面的方法优化其增殖培养基配方与发酵条件,并在此基础上研究和建立该菌的生长规律和葡萄糖消耗的动力学方程及模型,为实现酿酒酵母的高密度发酵及在奶啤生产中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
酿酒酵母(Saccharomycescerevisiae)TR2由新疆天润生物科技股份有限公司研发部选育,中科院微生物研究所鉴定;葡萄糖、蛋白胨、酵母膏、KH2PO4、柠檬酸均为国产分析纯。
YPD液体培养基:葡萄糖20 g/L、蛋白胨20g/L、酵母膏10 g/L,115 ℃灭菌20 min。此培养基主要用于活化菌种。
YPD固体培养基:在YPD液体培养基的基础之上加入质量浓度0.02 g/mL的琼脂,煮沸熔化灭菌而成。用于酿酒酵母的计数。
增殖培养基:按照单因素实验或响应面试验设计,在YPD液体培养基的基础上加入所需增殖因子配成。
1.2 仪器与设备
SW-CJ-2FD型超净工作台,苏州安泰空气技术有限公司;S210-K 型pH计,梅特勒-托利多国际有限公司;Ci-L型显微镜,尼康仪器(上海)有限公司;Multiskan GO型酶标仪,赛默飞世尔科技(中国)有限公司;ZHWY-200D型恒温培养振荡器,上海智城分析仪器制造有限公司;LRH-250F型生化培养箱,上海一恒科学仪器有限公司;SX-500型自动高压灭菌器,日本TOMY公司;5804R型高速离心机,德国Eppendorf公司。
1.3 实验方法
1.3.1种子液的制备
用接种环挑取一环保藏于4 ℃冰箱的酿酒酵母,在YPD平板中划线,放置于28 ℃培养箱中倒置培养48 h;选取菌落形态饱满的酿酒酵母接种于YPD液体培养基中,在温度为28 ℃、转速为150r/min的摇床中培养16~18 h以获得种子液。
1.3.2单因素实验设计
在YPD液体培养基的基础上配制成含不同质量浓度的碳源、氮源与无机盐的增殖培养基,其葡萄糖、菊糖、蔗糖、麦芽糖、乳糖的添加量均分别为10、30、50、70、90 g/L;蛋白胨、硫酸铵、硝酸钾、尿素的添加量均分别为5、10、20、30、40、50 g/L;硫酸镁、氯化钾、磷酸二氢钾、氯化钙的添加量均分别为0.5、1.0、3.0、5.0、7.0 g/mL,按体积分数2%的接种量接入酿酒酵母种子液,静止培养16 h后测定OD值。
1.3.3增殖培养基的优化设计
根据单因素实验结果,选取对酿酒酵母增殖影响显著的碳源、氮源与无机盐作为实验因素,采用Box-Behnken Design设计三因素三水平的实验,通过Design-Expert 8.05对实验数据进行响应面分析,优化培养基配方。
1.3.4发酵条件的优化设计
在250 mL三角瓶中装入60 mL增殖培养基,分别按1%、3%、5%、7%、9%的接种量接入培养基中,在温度为28 ℃,转速为150 r/min的摇床中培养16 h测定活菌数;在250 mL三角瓶中分别装入40、60、80、100、120 mL的增殖培养基,在相同条件下培养16 h测定活菌数;在250 mL三角瓶中装入60 mL增殖培养基,分别将初始pH值调节为4.0、4.5、5.0、5.5、6.0,在相同条件下培养16 h测定活菌数。根据单因素实验结果,选取装液量、接种量以及培养基的初始pH值为主要因素,设计三因素三水平的正交试验。
1.3.5酿酒酵母生物量、OD值与葡萄糖浓度的测定
收集50 mL培养16 h后的菌悬液于离心管中,7 000 r/min离心10 min,在相同条件下用无菌水洗涤2次,采用干重法测定生物量[19];使用光密度法测定菌悬液的OD600值,测定体积为100 μL;通过3,5-二硝基水杨酸(DNS)法测定离心后培养基中葡萄糖含量[20]。
1.3.6数据处理
采用Minitab 16软件中的Fisher单因子多重比较对实验数据进行方差分析,置信水平为95%,图中不同字母表示同一因素不同水平之间差异显著(p<0.05);通过Matlab 2010b对实验数据进行拟合;使用Origin 2016软件作图。
2 结果与分析
2.1 酿酒酵母增殖培养基的优化结果
2.1.1碳源对酿酒酵母生长的影响
碳源是指一切能满足微生物生长繁殖所需碳元素的营养源,由于不同微生物所产生的酶系各不相同,因此对不同碳源的利用程度也存在差异[21]。酿酒酵母生长对葡萄糖、菊糖、蔗糖、麦芽糖、乳糖的利用程度各不相同,随着培养基中碳源质量浓度的增加,酿酒酵母的OD值均呈现先增大后减小的趋势(见图1)。这可能是由于碳源浓度过高导致培养基的渗透压过高,不利于酵母生长[22]。当以乳糖作为培养基的碳源时,与其他各组相比酿酒酵母的OD值最低,可能是酿酒酵母缺少与分解乳糖有关的酶类[23]。葡萄糖、蔗糖添加量为50 g/L,菊糖、麦芽糖添加量为30 g/L时,培养16 h后酿酒酵母的OD值最大,分别为0.742、0.633、0.456、0.506,其中50g/L的葡萄糖对酿酒酵母的增殖作用最为显著(p<0.05)。当葡萄糖添加量低于50 g/L或高于70 g/L、菊糖添加量低于30 g/L或高于50 g/L、蔗糖添加量低于50 g/L、麦芽糖添加量低于或高于30 g/L时,酿酒酵母的OD值均显著地下降(p<0.05)。因此选择50 g/L的葡萄糖进行下一步实验。

图1 碳源种类及浓度对酿酒酵母生长的影响Fig.1 Effect of carbon sources and concentrations on growth of Saccharomyces cerevisiae
2.1.2氮源对酿酒酵母生长的影响
氮源的主要作用是为微生物细胞生长和代谢提供氮元素及能量,不同的氮源对微生物有不同的生理学效应[24]。酿酒酵母对蛋白胨、硝酸钾、硫酸铵、尿素的利用程度具有显著差异,见图2。当以20 g/L蛋白胨、30 g/L硝酸钾、5 g/L硫酸铵、5 g/L尿素作为培养基的氮源时,培养16 h后酿酒酵母的OD值最大,分别为0.762、0.583、0.620、0.474,其中20g/L的蛋白胨对酿酒酵母的增殖作用最为显著(p<0.05)。当培养基中蛋白胨浓度低于20 g/L、硝酸钾浓度低于或高于30 g/L、硫酸铵浓度高于5 g/L、尿素浓度高于5 g/L时,酿酒酵母的OD值均显著地下降(p<0.05)。因此选择20 g/L的蛋白胨进行下一步实验。

图2 氮源种类及浓度对酿酒酵母生长的影响Fig.2 Effect of nitrogen sources and concentration on growth of Saccharomyces cerevisiae
2.1.3无机盐对酿酒酵母生长的影响
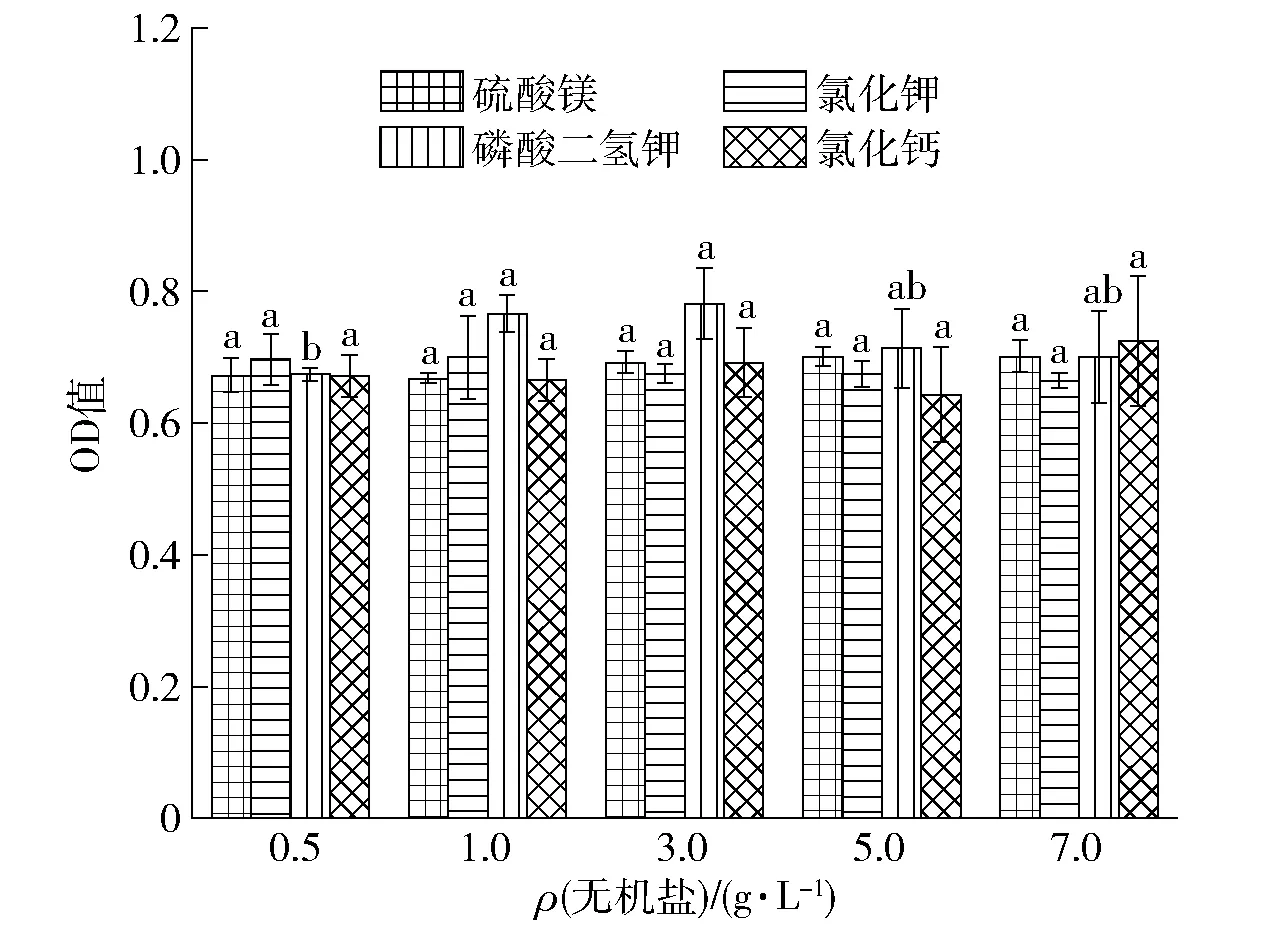
图3 无机盐种类及浓度对酿酒酵母生长的影响Fig.3 Effect of inorganic salt types and concentration on growth of Saccharomyces cerevisiae
无机盐在微生物生长繁殖与合成目的产物的过程中起着十分重要的作用,如构成细胞物质、调解代谢产物及渗透压等[25]。当培养基中添加7.0 g/L硫酸镁、1.0 g/L氯化钾、3.0 g/L磷酸二氢钾、7.0 g/L氯化钙时,16 h后酿酒酵母的OD值最大,分别为0.702、0.700、0.781、0.725,其中3 g/L的磷酸二氢钾对酿酒酵母的增殖作用最好(见图3)。当培养基中无机盐浓度在0.5~7.0 g/L时,硫酸镁、氯化钾与氯化钙对酿酒酵母的增殖作用不显著(p≥0.05),当磷酸二氢钾的浓度在1.0~7.0 g/L时,培养16 h后酿酒酵母的OD值无显著差异(p≥0.05),而当磷酸二氢钾的浓度在低于1 g/L时,培养16 h后酿酒酵母的OD值显著地下降(p<0.05)。因此选择3 g/L的磷酸二氢钾进行下一步实验。
2.1.4响应面试验优化增殖培养基结果
将50 g/L的葡萄糖、20 g/L的蛋白胨、3.0 g/L的磷酸二氢钾作为响应面设计的中心点零(0)水平,其中葡萄糖、蛋白胨、磷酸二氢钾的高(+)水平分别为70、30、5 g/L;低(-)水平分别为30、10、1 g/L。根据BBD原理设计以葡萄糖、蛋白胨、磷酸二氢钾为因素,OD值为响应值的分析实验,确定酿酒酵母的优化培养基配方,响应面试验设计及结果见表1,方差分析见表2。
对实验结果进行回归拟合分析,得到二次多元回归模型:
Y=0.84+0.053A+0.044B-2.125×10-3C-
0.046AB-0.13A2-0.12B2-0.067C2。
(1)

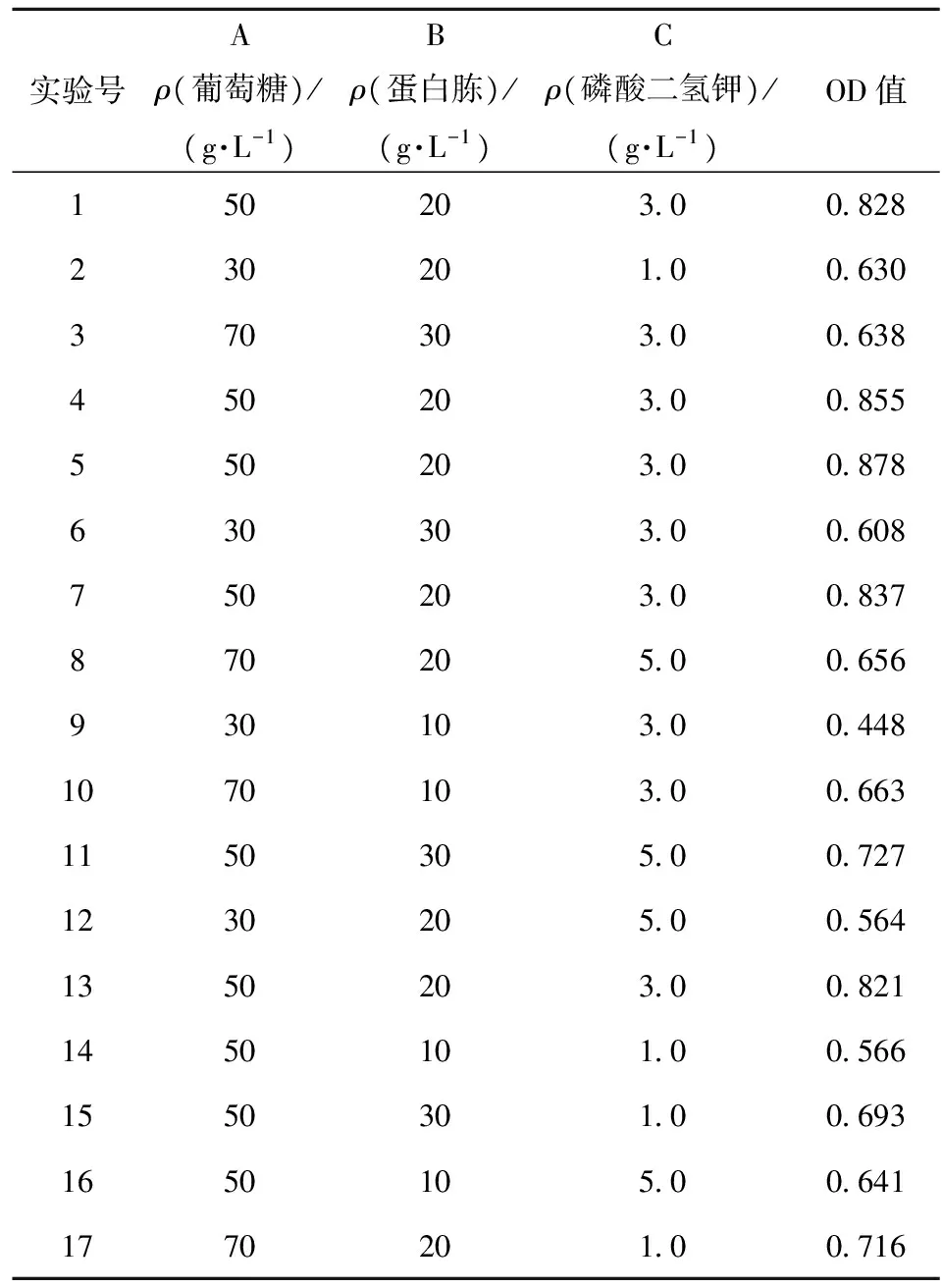
表1 BBD设计及结果

表2 回归模型方差分析
采用Design-Expert 8.05软件对回归模型进行响应面分析,可得到交互项显著(p<0.05)的葡萄糖与蛋白胨对酿酒酵母OD值影响的响应面二维等高线和三维立体图(见图4),图中椭圆排列越密集说明因素变化对结果影响越大。用此回归模型预测葡萄糖、蛋白胨、磷酸二氢钾的添加量分别为53.4、21.5 g/L和2.98 g/L时,酿酒酵母的吸光度最大为0.852。采用上述培养进行验证,酿酒酵母的OD值为0.848与预测值相近,可见该模型能较好地预测实际培养基中酿酒酵母的生长情况。

图4 葡萄糖与蛋白胨相互作用对酿酒酵母OD值的影响Fig.4 Effect of glucose and peptone on optical density of Saccharomyces cerevisiae
2.2 酿酒酵母培养条件的优化结果
培养基的初始pH、溶氧与接种量对微生物生长都有重要的影响,如培养基的pH会影响菌体的生长、目的蛋白的表达和活性;溶氧会影响与微生物呼吸链有关的能量代谢;接种量会影响菌体的生长代谢[26-28]。因此选择这3个因素进行优化,结果见表3。根据单因素实验设计正交试验,测定不同处理组的活菌数,结果如表4。各因素对于酿酒酵母活菌数的影响程度由大到小分别是 C、 B、A,较优组合为 A2B3C2。由于此项组合在实验方案中不存在,因此将较优组合与方案中活菌数最高的第9号正交试验进行对比,验证结果。结果表明,当装液量为60 mL、接种量为5%、培养基初始pH为5.0时,酿酒酵母生长较好,其活菌数为6.64×108CFU/mL。

表3 较优单因素实验条件
2.3 菌体生长动力学模型的建立
在分批发酵过程中菌体干质量的增加能够对自身生长产生抑制作用,拥有S型曲线的Logistic模型能很好地反映出这一普遍规律。该模型可描述群体前期的生长与营养供给之间的非线性关系,在细菌发酵过程中得到广泛应用[29]。
(1)

表4 正交试验设计及结果
式(2)中:X为酵母生物量,g/L;t为发酵时间,h;μm为菌体最大比生长速率,h-1;Xm为最大生物量,g/L。当t=0、X=X0时,对Logistic方程进行积分变为:
(3)
用Matlab软件按式(3)对实验值进行非线性拟合,计算得到动力学参数X0、Xm、μm分别为0.237、8.674、0.515,将其代入式(3)可得到菌体生长动力学方程:
(4)
由Logistic方程对实验数据拟合,结果见图5。由图5可知,该方程能够很好地描述酿酒酵母分批发酵过程中菌体的生长情况,计算值与实验数据吻合较好,相关系数R2=0.997 3。

图5 菌体生长动力学模型拟合曲线Fig.5 Microbial growth kinetic model fitting curve
2.4 葡萄糖消耗动力学模型的建立
根据物料平衡,发酵过程中底物的消耗通常被用作新生菌体的合成、细胞基本生命活动的维持以及产物的合成[30]。因此,底物消耗速率可用与Luedeking-Piret相似的方程式来描述。
(5)
式(5)中:μ为菌体比生长速率,h-1;YG为菌体生长得率系数,g/g;YP为产物对基质的得率系数,g/L;m为菌体对基质的维持系数,g/(L·h)。
在菌体生长期阶段,底物的消耗主要用于菌体生长和细胞维持上,因此方程(5)可转化为:
(6)
当t=t0时,X=X0,S=S0,将式(4)代入式(6)中积分,对分批发酵的数据进行拟合计算得到动力学参数YG=0.162 g/g,m=0.026 g/(L·h),S0=49.57 g/L,将各参数值代入底物消耗动力学方程中整理得:
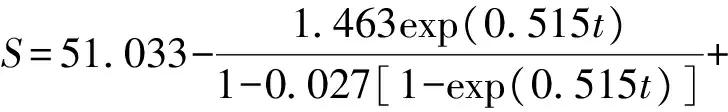
(7)
模型计算值与实验值的比较见图6,结果表明该模型能很好地描述酿酒酵母在发酵过程葡萄糖浓度的变化,拟合的相关系数R2=0.978 4。

图6 葡萄糖消耗动力学拟合曲线Fig.6 Glucose consumption kinetics fit curve
3 结 论
实验以酿酒酵母TR2为实验菌株在YPD液体培养基的基础上进行增殖培养,通过单因素实验与响应面试验分析确定了酿酒酵母TR2增殖的优化培养基配方为葡萄糖53.4 g/L、蛋白胨21.5 g/L、酵母膏10 g/L、磷酸二氢钾2.98 g/L;通过正交试验设计确定了酿酒酵母TR2的优化培养条件为初始pH值5.0、接种量5%、装液量60 mL、摇床转速150 r/min。在优化条件下28 ℃培养16 h,酿酒酵母TR2细胞数量可达到6.64×108CFU/mL。同时以葡萄糖为限制性底物通过建立数学模型分析酿酒酵母生长与底物的消耗过程,结果表明实验值与模型拟合较好,R2分别为0.997 3与0.978 4,描述了酿酒酵母在生长代谢过程中生物量与葡萄糖消耗之间的联系,为酿酒酵母TR2的发酵过程控制及在奶啤生产应用环节设计提供理论参考。
[1] KUMAR A, KUMAR D. Characterization ofLactobacillusisolated from dairy samples for probiotic properties[J]. Anaerobe, 2015, 33: 117-123.
[2] ARCHER A C, HALAMI P M. Probiotic attributes ofLactobacillusfermentumisolated from human feces and dairy products[J]. Applied Microbiology and Biotechnology, 2015, 99(19): 8113-8123.
[3] PLAZA-DIAZ J, GOMEZ-LLORENTE C, FONTANA L, et al. Modulation of immunity and inflammatory gene expression in the gut, in inflammatory diseases of the gut and in the liver by probiotics[J]. World Journal of Gastroenterology, 2014, 20(42): 15632-15649.
[4] HATOUM R, LABRIE S, FLISS I.Antimicrobial and probiotic properties of yeasts: from fundamental to novel applications[J]. Frontiers in Microbiology, 2012, 3:421.
[5] SEDDIK H A, CEUGNIEZ A, BENDALI F, et al. Yeasts isolated from Algerian infants’s feces revealed a burden ofCandidaalbicansspecies, non-albicansCandidaspecies andSaccharomycescerevisiae[J]. Archives of Microbiology,2016, 198(1): 71-81.
[6] MOSLEHI-JENABIAN S, PEDERSEN L L, JESPERSEN L. Beneficial effects of probiotic and food borne yeasts on human health[J]. Nutrients, 2010, 2(4): 449-473.
[7] JESPERSEN L. Occurrence and taxonomic characteristics of strains ofSaccharomycescerevisiaepredominant in African indigenous fermented foods and beverages[J]. FEMS Yeast Research, 2003, 3(2): 191-200.
[8] ALUGONGO G M, XIAO J X, CHUNG Y H, et al. Effects ofSaccharomycescerevisiaefermentation products on dairy calves: performance and health[J]. Journal of Dairy Science, 2017, 100(2): 1189-1199.
[9] PALMA M L, ZAMITH-MIRANDA D, MARTINS F S, et al. ProbioticSaccharomycescerevisiaestrains as bio-therapeutic tools: is there room for improvement?[J]. Applied Microbiology and Biotechnology, 2015, 99(16): 6563-6570.
[10] GALAZKA J M, TIAN C, BEESON W T, et al. Cellodextrin transport in yeast for improved biofuel production[J]. Science, 2010, 330(6000): 84-86.
[11] MALO P M, URQUHART E A.Encyclopedia of food and health[M]. Oxford: Academic Press, 2016: 681-685.
[12] KARIMI R, MORTAZAVIAN A M, AMIRI-RIGI A. Selective enumeration of probiotic microorganisms in cheese[J]. Food Microbiology, 2012, 29(1): 1-9.
[13] COMAN G, BAHRIM G. Optimization of xylanase production byStreptomycessp. P12-137 using response surface methodology and central composite design[J]. Annals of Microbiology, 2011, 61(4): 773-779.
[14] 郑苗, 邓泽元, 任志青, 等. 东方伊萨酵母高密度培养的研究[J]. 中国食品学报, 2016, 16(4): 96-103.
ZHENG M, DENG Z Y, REN Z Q, et al.Studies on the high-density cultivation ofIssatchenkiaorientalis[J].Journal of Chinese Institute of Food Science and Technology,2016,16(4):96-103.
[15] KHOSHAYAND F, GOODARZI S, SHAHVERDI A R, et al. Optimization of culture conditions for fermentation of soymilk usingLactobacilluscaseiby response surface methodology[J]. Probiotics and Antimicrobial Proteins, 2011, 3(3/4): 159-167.
[16] KIRAN B, PATHAK K, KUMAR R, et al. Statistical optimization using central composite design for biomass and lipid productivity of microalgae: a step towards enhanced biodiesel production[J]. Ecological Engineering, 2016, 92: 73-81.
[17] 罗建平, 王贵娟, 潘利华. 黑曲霉发酵麦麸生产β-葡萄糖苷酶的工艺优化及动力学研究[J]. 农业工程学报, 2007, 23(12): 252-257.
LOU J P, WANG G J, PAN L H. Technology optimization and kinetic characteristics of β-glucosidase production by fermentation ofAspergillusnigerM85 with wheat bran[J].Transactions of the Chinese Society of Agricultural Engineering,2007,23(12):252-257.
[18] 姜勇, 高莉丽, 刘天中, 等. 鼠李糖乳杆菌乳酸发酵动力学的研究[J]. 中国食品学报, 2009, 9(4): 57-63.
JIANG Y, GAO L L, LIU T Z, et al. Studies on kinetics of lactic acid fermentation byLactobacillusrhamnosus[J].Journal of Chinese Institute of Food Science and Technology,2009,9(4):57-63.
[19] 郭庆强, 林建强, 李歧强, 等. 微生物发酵过程的细胞密度在线检测与底物浓度实时控制[J]. 中国科学技术大学学报, 2012, 42(7): 584-589.
GUO Q Q, LIN J Q, LI Q Q, et al. Cell density online detection and substrate concentration real-time control of microbial fermentation process[J].Journal of University of Science and Technology of China,2012,42(7):584-589.
[20] 刘忠义, 欧昌荣, 汤海青, 等. 3,5-二硝基水杨酸法测定葡萄酒中总糖含量的条件优化[J]. 核农学报, 2013, 27(11): 1717-1723.
LIU Z Y, OU C R, TANG H Q, et al.Optimization of conditions for determination of total sugar contents in wine by 3, 5-dinitrosalicylic acid method[J].Journal of Nuclear Agricultural Sciences,2013,27(11):1717-1723.
[21] KIM H O, LIM J M, JOO J H, et al. Optimization of submerged culture condition for the production of mycelial biomass and exopolysaccharides byAgrocybecylindracea[J]. Bioresource Technology, 2005, 96(10): 1175-1182.
[22] PEREIRA F B, GUIMARAES P M, TEIXEIRA J A, et al. Optimization of low-cost medium for very high gravity ethanol fermentations bySaccharomycescerevisiaeusing statistical experimental designs[J]. Bioresource Technology, 2010, 101(20): 7856-7863.
[23] 李雪雁, 弋凌云. 乳糖酶和酿酒酵母的共固定化及其在乳清发酵中的应用[J]. 中国酿造, 2008,27(3): 54-57.
LI X Y, YI L Y. Co-immobilization and application of lactase andSaccharomycescerevisiaein whey fermentation[J].China Brewing,2008,27(3):54-57.
[24] 曹永强, 王辑, 赵笑, 等. 植物乳杆菌YW11生产胞外多糖的发酵条件研究[J]. 食品科学技术学报, 2016, 34(1): 42-49.
CAO Y Q, WANG J, ZHAO X, et al. Optimization of fermentation conditions ofLactobacillusplantarumYW11 for exopolysaccharides production[J].Journal of Food Science and Technology,2016,34(1):42-49.
[25] PALUKURTY A, TELGANA N K,MULAMPAKA S, et al. Screening and optimization of metal ions to enhance ethanol production using statistical experimental designs[J]. African Journal of Microbiology Research, 2008, 2(4): 87-94.
[26] 张盛, 郝玉有, 储炬, 等. pH对毕赤酵母表达重组人复合α干扰素的降解影响[J]. 生物工程学报, 2008, 24(1): 164-168.
ZHANG S, HAO Y Y, CHU J, et al. Effect of pH on proteolytic degradation of consensus interferon-α expressed byPichiapastoris[J].Chinese Journal of Biotechnology,2008,24(1):164-168.
[27] 赵宇, 陈忠敏. 微生物发酵过程中溶氧的影响及其调控[J]. 食品与发酵科技, 2016, 52(4): 15-19.
CHEN Y, CHEN Z M. Influence of dissolved oxygen in the process of fermentation and its regulation[J]. Food and Fermentation Sciences and Technology,2016,52(4):15-19.
[28] 孙竹萍, 张莉力, 王玉田. 副干酪乳酸菌L1产淀粉酶条件优化及温度、pH对淀粉酶酶活力的影响[J]. 食品工业科技, 2014, 35(1): 144-149.
SUN Z P, ZHANG L L, WANG Y T. Amylase fromLactobacillusparacaseiL1: optimization of its fermentation condition and reaction temperature and pH[J].Science and Technology of Food Industry,2014,35(1):144-149.
[29] 贾建萍, 裘娟萍, 周彦钢. 谷胱甘肽分批补料发酵动力学模型的建立[J]. 现代食品科技, 2012, 28(4): 391-395.
JIA J P, QIU J P, ZHOU Y G. Modeling of batch fermentation kinetics for glutathione production[J].Modern Food Science & Technology,2012,28(4):391-395.
[30] 张扬, 冯小海, 李莎, 等.Kitasatosporasp. MY5-36产ε-聚赖氨酸分批补料发酵动力学[J]. 生物加工过程, 2012, 10(3): 23-27.
ZHANG Y, FENG X H, LI S, et al. Fed-batch fermentation kinetics of ε-polylysine byKitasatosporasp. MY 5-36[J]. Chinese Journal of Bioprocess Engineering,2012,10(3):23-27.
