植物乳杆菌K25发酵产胞外多糖的影响因素及其应用
2018-02-01姜云芸邵淑娟付冰冰黎润坤李晓琬杨贞耐
姜云芸, 蔡 淼, 邵淑娟, 付冰冰, 黎润坤, 李晓琬, 张 健, 杨贞耐,*
(1.北京食品营养与人类健康高精尖创新中心/食品质量与安全北京实验室, 北京工商大学, 北京 100048; 2.菏泽市食品药品检验检测研究院, 山东 菏泽 250014)
*杨贞耐,男,教授,博士,主要从事乳品科学及加工技术方面的研究,通信作者。
植物乳杆菌胞外多糖(extracellular polysaccharide,EPS)可赋予发酵乳制品独特的质构和风味,还具有增强免疫力、抗肿瘤和调节肠道菌群平衡等生物活性,在食品和医药领域具有良好的应用前景。但是,植物乳杆菌EPS的产量偏低,而影响其产量的因素具有菌株特异性,有关添加植物乳杆菌EPS对产品稳定性影响的研究也较少。采用单因素实验和响应面法确定了植物乳杆菌K25 产EPS 的优化培养基组成:每升含胰蛋白胨10 g、酵母浸粉5 g、葡萄糖20 g、磷酸氢二钾2.0 g、无水乙酸钠5.0 g、柠檬酸钠5.0 g、硫酸镁0.2 g、硫酸锰0.05 g 和吐温80 1.0 mL。优化的发酵条件:发酵温度30 ℃、发酵时长24 h和培养基初pH值6.5。在此条件下EPS 产量为250.21 mg/L。流变学研究表明,该EPS 水溶液的黏度具有随着浓度和剪切速率升高而升高,以及剪切变稠的特性。扫描电镜观察发现,该EPS具有长方形块状微观结构,有利于稳定溶液的质构并保持水分。将该EPS 加入到酸性乳饮料中,进一步验证了其具有良好的保水特性,表明植物乳杆菌K25产生的EPS可以作为一种具有潜在应用价值的新型食品稳定剂。
植物乳杆菌; 胞外多糖; 产量; 影响因素; 乳饮料
乳酸菌胞外多糖(extracellular polysaccharide,EPS)是菌体在其生长代谢过程中分泌到细胞壁外的水溶性大分子糖类物质,是细菌的次级代谢产物[1]。乳酸菌EPS可赋予发酵乳制品特殊的质构和风味,可以作为天然安全的食品级多糖类添加剂,具有增稠、稳定、乳化、胶凝及持水等特性[1]。此外,EPS还具有调节免疫力、抗肿瘤、调节肠道菌群平衡和抑制病原菌等生物活性,可应用于功能食品和医药领域[2-6]。
一般来说,乳酸菌的EPS产量偏低,菌株产EPS的稳定性欠佳[1,7-9]。培养基组分(碳源、氮源、微量元素及无机盐等)和生长条件(接种量、培养温度、时间及发酵初始pH值等)影响EPS的最终产量[7-9]。据报道,乳酸菌以葡萄糖为碳源时,其EPS产量明显高于其他碳源[7]。例如,干酪乳杆菌CGⅡ以葡萄糖为碳源时,EPS产量比半乳糖和乳糖作为碳源的产量高。氮源的添加有利于细胞生长,增加菌体的密度,可以促进菌体将糖类物质转化为多糖[10],例如,明串珠菌NRRLB-1146产EPS受蛋白胨和酵母粉的显著影响[10]。温度是影响菌体产EPS的重要因素之一[8-9],温度过高,导致菌体在培养过程中容易过早衰老而发生自溶现象,使菌体浓度下降,从而降低EPS产量。研究表明,菌体达到一定浓度时EPS开始合成[11],温度过低,生长缓慢,使菌体浓度低而影响EPS的合成。培养基pH值的影响主要通过改变酶的活性来间接调控EPS的合成[8-9]。乳杆菌产EPS的最适pH值一般在5.8~6.0,较其他微生物偏低,但若pH值过低,会导致EPS的合成过程中失去异戊二烯类载体而受到抑制[8-9]。
前期研究表明,源于藏灵菇的一株产EPS植物乳杆菌(Lactobacillusplantarum)K25,其发酵乳对饲喂高脂饲料小鼠模型具有良好的降胆固醇功效,并可增加小鼠肠道内乳酸杆菌的数量,还具有抗氧化作用[12-13]。该菌株在发酵乳冷藏期间,表现出较好的存活能力,并且不会造成发酵乳后酸化[14]。此外,该菌株所产EPS对变异链球菌菌膜的形成具有明显抑制作用,其MIC值较低(1.25×107CFU/mL),同时可以显著降低变异链球菌的黏附率[15]。鉴于植物乳杆菌K25产EPS的优良功能特性,本研究旨在探讨该菌株发酵产EPS的影响因素,优化其发酵条件,提高EPS产量,同时进一步研究此EPS作为天然的增稠剂和稳定剂在酸性乳饮料中的作用。
1 材料与方法
1.1 主要化学试剂和培养基
三氯乙酸(TCA)、无水乙醇、浓硫酸、苯酚、盐酸、氢氧化钠、胰蛋白胨等均为分析纯,国药集团化学试剂有限公司;透析袋(截流分子质量为8 000~14 000 Da),北京生物技术有限责任公司。
半合成培养基(SDM):胰蛋白胨10.0 g、YNB(酵母氮源)6.7 g、葡萄糖20.0 g、磷酸氢二钾2.0 g、无水乙酸钠5.0 g、柠檬酸钠5.0 g、硫酸镁0.2 g、硫酸锰0.05 g、吐温80 1.0 mL,加蒸馏水至1 000 mL,调节pH值至6.6,121 ℃灭菌15 min。
磷酸盐缓冲液(PBS):1.44 g Na2HPO4,0.24 g K2HPO4,0.2 g KCl,8 g NaCl,pH值7.4。
1.2 实验菌株
植物乳杆菌K25菌株由吉林省农业科学院提供,保藏在含30%甘油的脱脂乳中,于-80 ℃冰箱保存。
1.3 仪器设备
电热恒温培养箱,上海一恒实验设备有限公司;MLS-3750 型高压蒸汽灭菌锅,日本三洋公司;CR21GⅢ型高速冷冻离心机,日本HITACHI 公司;真空冷冻干燥机,德国Christ公司;Elx800 型酶标仪,美国伯腾仪器有限公司;S20 型数显pH 计,上海梅特利-托利多公司。
1.4 实验方法
1.4.1菌株培养
植物乳杆菌K25在SDM液体培养基中活化,37 ℃培养12 h,连续活化两代作为种子培养液。
1.4.2植物乳杆菌产EPS 的提取与测定[5]
植物乳杆菌K25发酵培养24 h 后,测定发酵液pH值以及600 nm下的吸光光度值OD600。发酵液中加入质量浓度为800 g/L的三氯乙酸溶液,调节其质量浓度至40 g/L,室温下震荡2~4 h。离心(10 000 r/min,4 ℃)30 min,除去菌体细胞和蛋白质,取上清液。上清液中加入3倍体积的无水乙醇,4 ℃条件下静置12 h。离心30 min(10 000 r/min,4 ℃),弃上清液。蒸馏水溶解沉淀,透析48 h,每8 h换一次水。
采用苯酚-硫酸法测定植物乳杆菌K25 EPS含量。以葡萄糖溶液为标准品,490 nm下测吸光度,得到回归线方程,见式(1)。
y=0.008 7x+0.023 2,R2=0.999 4。
(1)
取20 μL透析液稀释至200 μL,加入100 μL的6%苯酚和500 μL浓硫酸混匀,静置20 min,置于酶标仪上测定490 nm下的吸光度。
1.4.3EPS的单因素实验
依据前期实验选定的单因素为:碳源(果糖、蔗糖、麦芽糖、乳糖、可溶性淀粉和葡萄糖)、二价金属离子(钙、镁、铁、锰、铜、锌)、钠离子、氮源(蛋白胨、大豆蛋白胨、胰蛋白胨、牛肉膏、脱脂乳粉)、发酵时间、发酵温度和培养基初始pH值。
1.4.4响应面试验
根据单因素实验结果,选取对植物乳杆菌K25产EPS影响显著的3个因素(葡萄糖浓度、发酵温度、培养基初始pH值),以EPS产量作为响应值,根据Box-Behnken软件设计三因素三水平响应面试验。Design-Expert软件设计中心组合试验,每组做3个平行样品。
1.4.5扫描电镜观察
称取5 mg EPS样品于载玻片,用双面胶均匀粘贴于云母表面,洗耳球吹去多余粉末和未帖服的样品残余,并在表面喷金(约10 nm),在扫描电子显微镜scanning electron microscope(SEM)下观察EPS样品形态。
1.4.6EPS溶液流变学分析
分别配制0.3、0.5、1.0 mg/mL的EPS溶液,使用HAAKE MARS流变仪(CC16号转子)分别测定其在不同剪切速率(0~300 r/s)以及不同温度(0~70 ℃)条件下的流变学特性。
1.4.7含EPS的酸性乳饮料稳定性实验
配制含3.6%巴氏杀菌奶和5%蔗糖的料液,然后分别加入质量比为0.1%、0.2%、0.3%、0.4%、0.5%的EPS,果胶、CMC、羟丙基淀粉酯和大豆多糖,混合均匀。静置冷却到20 ℃ 以下,用柠檬酸(10%)调节pH值至5.5。均质2 min置于牛奶瓶(50 mL/瓶),巴氏杀菌(75 ℃,15 min),室温保存。
取调制好的饮料20 mL,记录试管质量m0和加入样品后的质量m1。离心(4 500 r/min,20 min),弃去上清液,准确称量沉淀物质量m2,利用式(2)计算保水率。
保水率=(m2-m1)/(m1-m0)×100%。
(2)
用布式流变仪测定各酸性乳饮料黏度,方法同1.4.6节。
2 结果与讨论
2.1 单因素实验结果分析
2.1.1培养条件对EPS 产量的影响
1)发酵时间和温度。以SDM培养基为基础,测定分析不同的培养时间和温度对植物乳杆菌K25 EPS产量的影响(图1)。随着发酵时间的延长,EPS产量呈现出先增加后降低的趋势(图1a)。培养至24 h时,植物乳杆菌EPS 的产量达到最大值179.22 mg/L,随后大幅度下降。这可能是由于发酵时间的延长,菌体自溶释放出分解代谢多糖的酶,从而使EPS降解,降低了EPS 产量[16-18]。在后续的实验中选取24 h为植物乳杆菌K25产EPS的最佳发酵时间。
发酵温度对植物乳杆菌EPS 产量的影响如图1b。 30 ℃时,EPS产量达到最大值235.7 mg/L,但是随着温度的升高,EPS的产量下降。这可能与菌体合成多糖的酶活性在30 ℃时较高有关[16-17],因此选择30 ℃为植物乳杆菌K25产EPS的最佳发酵温度。

图1 发酵时间和温度对植物乳杆菌 EPS 产量的影响Fig.1 Effect of fermentation time and temperature on yield of EPS from L. plantarum
2)培养基初始pH值。每株菌都有最适合自身生长和产EPS的pH值范围,此范围内pH值能够最大程度地提高酶促反应速率,进而使微生物的生长和合成代谢速率达到最大值[19]。培养基初始pH值(分别为5.5、6.5、7.5、8.5、9.0)对植物乳杆菌K25产EPS的影响如图2。随着培养基初始pH值的增加,EPS产量呈现出先增大后减小的变化,当pH值为6.5时,EPS产量达到最大值198.4 mg/L,因此选择植物乳杆菌K25产EPS的最适初始pH值为6.5。

图2 培养基初始pH值对植物乳杆菌EPS产量的影响Fig.2 Effect of initial pH of culture medium on yield of EPS from L. plantarum
2.1.2培养基成分对EPS 产量的影响
碳源是微生物生长代谢重要的营养物之一,主要提供细胞合成产物的碳架及代谢所需的能量[18,20-21]。由于不同微生物的碳水化合物代谢酶系不同,因此其可利用的碳源也不同,常用的碳源有糖类(一般使用果糖、蔗糖、麦芽糖、乳糖和葡萄糖)、油脂、有机酸、有机酸酯和小分子醇等[18,20-21]。本实验选择果糖、蔗糖、麦芽糖、乳糖和葡萄糖研究不同碳源对植物乳杆菌K25 EPS 产量的影响。结果表明,以葡萄糖为碳源时EPS 的产量最大(图3a)。因此选择葡萄糖为植物乳杆菌K25产EPS的最佳碳源,且其质量浓度为15 g/L时,EPS产量达最大值为235.4 mg/L(图3b)。

图3 碳源对植物乳杆菌EPS产量的影响Fig.3 Effect of carbonsource on EPS yield of L. plantarum

图4 氮源对植物乳杆菌EPS 产量的影响 Fig.4 Effect of nitrogen source on EPS yield of L. plantarum
氮源能够为菌体生长代谢提供氮素,组成生物体的核酸、蛋白质及其他氮素化合物,是影响植物乳杆菌EPS产量的主要因素之一[8]。本实验选用大豆蛋白胨、胰蛋白胨、蛋白胨、脱脂乳粉和牛肉膏作为氮源,考察氮源对K25产EPS的影响,结果如图4a。由图4a可知,大豆蛋白胨作为氮源时EPS产量最高,为218.3 mg/L,其他依次为胰蛋白胨、蛋白胨、牛肉膏和脱脂乳粉,因此,选择大豆蛋白胨作为植物乳杆菌K25产EPS的最佳氮源。
以SDM培养基为基础,用大豆蛋白胨代替胰蛋白胨,添加量分别为0、2、4、8、12 g/L,结果如图4b。由图4b可见,随着大豆蛋白质量浓度增加,可供菌体利用的氮源增加,当大豆蛋白胨质量浓度为8 g/L时,EPS 产量达到最大值192.7 mg/L。继续增加大豆蛋白胨浓度,反而抑制菌体生长,这可能是高浓度的氮源对菌体产生渗透压胁迫[8],因此大豆蛋白胨的最适质量浓度为8 g/L。
金属离子是维持多相体系的渗透平衡的重要组成部分,也是大部分酶,尤其是金属酶类反应的必要组成部分[22]。据报道,培养基中的金属离子能影响植物乳杆菌的生长代谢,并能通过影响相关的酶活性,或者改变培养基的渗透压、pH值和氧化还原电位等因素来影响EPS的生成[22]。培养基中缺乏有关微量元素时会抑制菌体生长速度,但过量时又会产生毒害作用[22],因此有必要控制培养基中金属离子的种类以及比例,确保菌体有效地产生EPS。本实验研究了7种金属离子对EPS产量的影响,实验结果见图5。由图5可以看出,正二价铁离子对EPS产量的影响最明显(p<0.05),添加量为1.0 g/L时,植物乳杆菌EPS产量达218.6 mg/L。

图5 金属盐离子对植物乳杆菌EPS产量的影响Fig.5 Effect of metal ions on yield of EPS from L. plantarum
2.2 响应面试验结果分析
根据碳源、二价金属离子、氮源、发酵时间、发酵温度和培养基初始pH值的单因素实验结果,可以确定能够显著影响植物乳杆菌EPS 产量的因素为:葡萄糖(15 g/L)、发酵温度(30 ℃)、培养基初始pH值(6.5)。以EPS产量作为响应面值,选取葡萄糖浓度、发酵温度和培养基初始pH值3个因素,设计试验因素水平表,见表1。

表1 响应面试验因素水平
根据BBD原理,设计三因素三水平的响应面分析试验。使用Design-Expert 响应面设计软件分析,共有17 个实验点,以葡萄糖糖浓度、发酵温度、初始pH值为自变量,以EPS 产量为响应值。在不同条件下所得的多糖产量见表2。根据表2结果,由Design Expert(Version 8.0.6) 软件获得拟合方程,见式(3)。

(3)
式(3)中,Y是EPS产量,X1是葡萄糖质量浓度,X2是温度,X3是pH。
方差分析和模型以及各参数分析如表3。回归诊断表示模型的F值为7.36,而p值远远小于0.01,

表2 Design-Expert设计方案及响应值结果
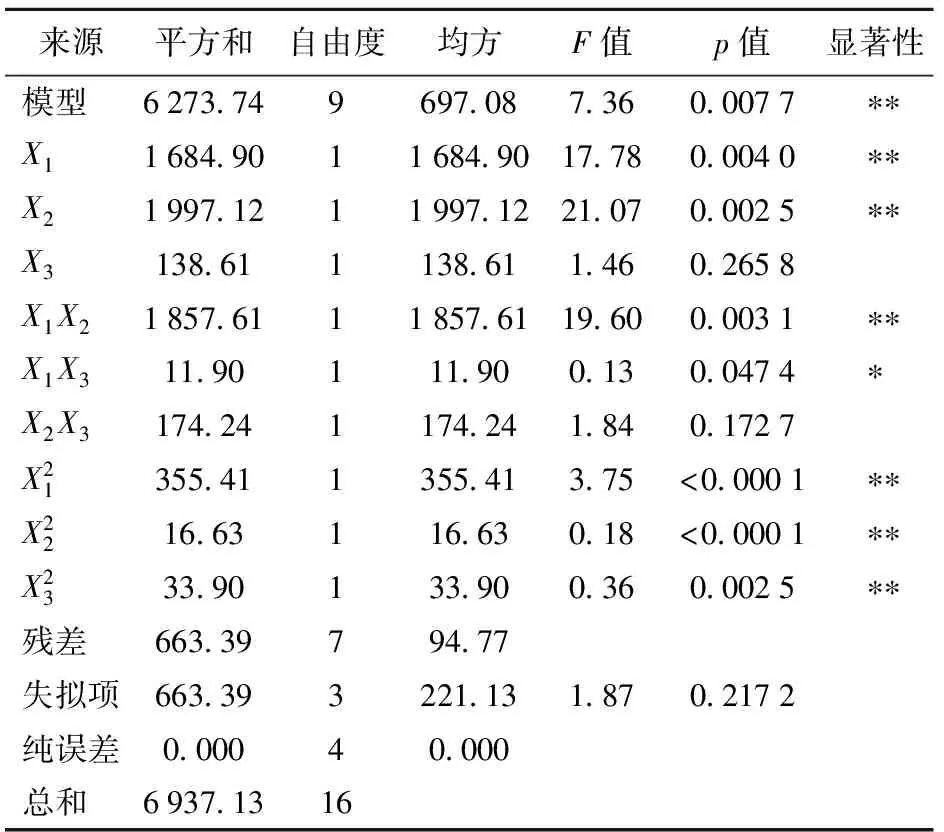
表3 回归模型的方差分析
** 为较显著(p<0.01),*为显著(p<0.05)。

2.3 响应面交互作用分析
3个显著因素(葡萄糖质量浓度、pH值和发酵温度)的交互影响对响应值植物乳杆菌EPS的产量的影响可以从图6至图8的响应面图和等高线图直接看出。图6至图8表示X1、X2、X3中任意的一个影响因素取零水平时,剩下的两个变量影响因素对EPS产量的交互影响。响应面的平面投影和等高线的形状可以表明交互效应的强弱,椭圆形则表示两因素交互影响的作用显著,而圆形则表明交互作用较弱。
由图6可以得出,pH值和葡萄糖浓度的等高线图呈现椭圆形,则说明二者交互作用比较显著。随着葡萄糖浓度的升高,EPS产量也随之提高。培养基初始pH值会对菌体的生长代谢产生较大影响。初始pH值不同时,植物乳杆菌的生长情况不同,从而对葡萄糖的利用程度及EPS产量影响也不同。

图6 葡萄糖质量浓度和初始pH值对EPS产量影响的等高线及响应面图Fig.6 Response surface and contours map of effects of glucose concentration and pH on EPS yield

图7 葡萄糖浓度和发酵温度对EPS产量的影响的等高线及响应面图Fig.7 Response surface and contour map of effects of glucose concentration and fermentation temperature on EPS yield
由图7可以得出,葡萄糖浓度和发酵温度的等高线呈现椭圆形,说明葡萄糖浓度和发酵温度之间的交互作用比较显著。将发酵初始pH值控制为零时,葡萄糖的浓度设定为固定值,随着发酵温度的不断升高,EPS的产量先增大后减小。分析等高线图中葡萄糖浓度和发酵温度变化的密集度可看出发酵温度的等高线比较密集,发酵温度对EPS产量的影响比葡萄糖浓度要大。随着葡萄糖浓度的增加,用于合成EPS的原料也就不断地增加,但是葡萄糖过多,会产生渗透压,进而抑制菌株的生长,导致EPS产量下降;同时如果发酵温度也发生变化,就会影响细胞的生长速度从而影响其对葡萄糖的利用,也许这就是葡萄糖浓度和发酵温度的交互作用比较显著的原因。
由图8可以得出,发酵温度和发酵初始pH值的等高线图接近于圆形,即说明二者之间的交互作用并不显著。固定葡萄糖浓度为零,当发酵温度一定时,随着初始pH值减小,EPS产量逐渐增大。
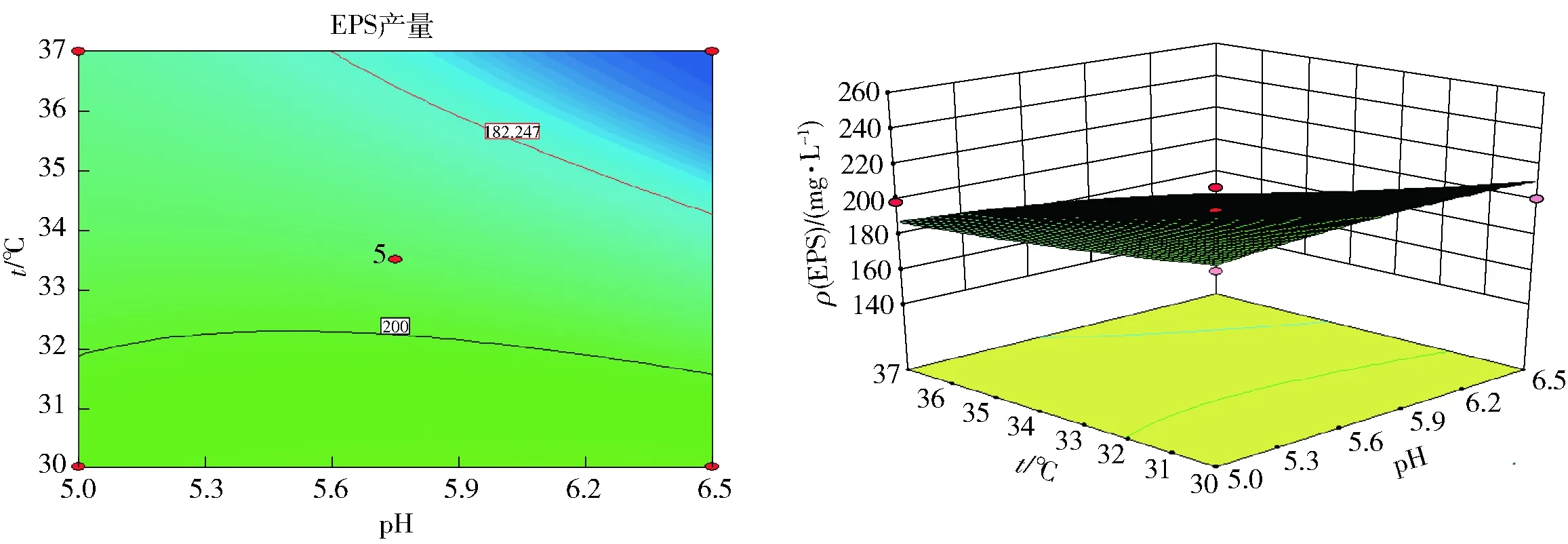
图8 发酵温度和初始pH值对EPS产量影响的等高线及响应面图Fig.8 Response surface and contour map of effects of fermentation temperature and pH on EPS yield
通过软件分析得出植物乳杆菌发酵产EPS 有最大值,其发酵的优化条件为:葡萄糖质量浓度20 g/L、初始pH值6.5、发酵温度30 ℃,在此条件下植物乳杆菌EPS 产量的拟合函数值为245.30 mg/L。利用得到的优化发酵条件进行验证实验,设置3组平行实验,并对实验结果取平均值,得到EPS产量为250.21 mg/L,与预测的结果基本一致。

图9 不同质量浓度的EPS溶液在不同的剪切速率和温度下的黏度变化Fig.9 Viscosity change of EPS solution affected by different shear rate and different temperature
2.4 EPS的流变学特性
乳酸菌EPS作为一种天然的食品添加剂用于发酵乳制品,不仅能够增添良好的口感和风味,还可以改善乳制品的质构[16]。使用乙醇沉淀法得到EPS。分别研究在不同温度和转数条件下EPS水溶液的流变学特性,结果如图9。不同剪切速率下的黏度图(图9a)表明,EPS溶液的黏度随着EPS质量浓度的升高而升高,不同EPS质量浓度的EPS溶液黏度与剪切速率呈正相关,即随着剪切速率的升高而升高,体现为增稠特性[23]。EPS溶液的黏度随着温度的升高而下降(图9b),原因可能是高温使EPS分子原有的结构变得不规则,呈现一种相对稀松的分子构象,降低了EPS分子间的接触面积和频率,在EPS分子内部也会发生分子重排现象,破坏了结构的完整性[23]。
2.5 EPS微观结构分析
扫描电镜是研究EPS微观结构的有效手段,对于EPS微观结构的了解可以为进一步研究EPS对食品质构的影响提供重要依据。植物乳酸菌EPS 的SEM 图像如图10。植物乳杆菌EPS呈现大小不一、外形近似长方体并紧凑叠加的微观结构,表面较为光滑。这种结构较为稳定,赋予了EPS特殊的流变学性质,例如提升产品的黏度、改善质构和保水特性[24]。

图10 植物乳杆菌EPS扫描电镜图Fig.10 SEM image of EPS from L. plantarum
2.6 EPS在酸性乳饮料中应用的稳定性评价
酸性乳饮料中分别加入植物乳杆菌EPS、果胶、羧甲基纤维素(CMC)、羟丙基淀粉酯和大豆多糖,
巴氏杀菌后,通过测定溶液的保水率来评估其稳定性[16],结果如图11a。由图11a可见,果胶的保水作用,随其质量比的升高而增强,较其他稳定剂表现出更好的保水作用。CMC、羟丙基淀粉酯和大豆多糖的保水作用也随其质量比的增加而增强,但是,添加了CMC、羟丙基淀粉酯、大豆多糖或EPS的酸性乳饮料,它们之间的保水率没有明显差异。EPS对酸性乳饮料的稳定保水作用,在其质量比达到0.5% 时最强。
从图11b中可知,乳饮料的黏度随果胶添加量的增加而明显增大,而添加等量的大豆多糖的乳饮料黏度没有明显变化,且随其添加量的增加也变化不大。羟丙基淀粉酯表现出明显的增稠效果,但随其添加量增加,黏度下降。CMC和EPS的稳定效果最为理想,添加了二者的乳饮料黏度总体变化不大,而且随着EPS添加量的增加,黏度先下降后上升, EPS质量比为0.2% 时效果最佳。在酸性乳饮料体系中,EPS与酸和蛋白等物质之间发生较复杂的相互作用,并协同影响发酵乳饮料的理化性质[25]。

图11 EPS和稳定剂添加量对酸性乳饮料的保水性和黏度影响Fig.11 Effect of concentrations of EPS and stabilizers on water retention and viscosity of acid milk beverage
果胶和羟丙基淀粉酯的使用易导致酸性乳饮料过于黏稠。大豆多糖具有良好的保水性,但是对产品的黏度没有明显的改善作用。EPS表现出很大的潜能,具有良好的稳定性,选择适当的浓度添加,酸性乳饮料不易产生过稠现象,EPS 在食品加工中作为稳定剂具有潜在的应用价值。
3 结 论
通过单因素实验和响应面法分析,对一株源自传统藏灵菇的植物乳杆菌K25产EPS的条件进行了优化。得到优化的培养基组成为每升含胰蛋白胨10 g、酵母浸粉5 g、葡萄糖20 g、无水乙酸钠5.0 g、柠檬酸钠5.0 g、硫酸镁 0.2 g、硫酸锰 0.05 g、吐温80 1.0 mL;优化的发酵条件为:发酵温度30 ℃、发酵时长24 h和培养基初pH值6.5。在此条件下植物乳杆菌K25 的EPS产量达250.21 mg/L。对EPS 流变学特性的研究结果表明,该EPS 溶液的黏度随着浓度和剪切速率的增加而增加,随着温度增加而降低,不同于多数乳酸菌EPS具有的剪切变稀现象。采用扫描电镜观察EPS分子形态,表明该EPS 具有近似方块并紧密叠加的立体微观结构。将EPS添加于酸性乳饮料中,该产品的稳定性和黏度与添加CMC 的酸性乳饮料相接近。因此植物乳杆菌K25所产的EPS 具有作为天然食品稳定剂应用的潜力。
[1] ZANNINI E, WATERS D M, COFFEY A, et al. Production, properties, and industrial food application of lactic acid bacteria-derived exopolysaccharides[J]. Applied Microbiology and Biotechnology, 2016,100(3):1121-1135.
[2] TANG W, XING Z, LI C, et al. Molecular mechanisms andinvitroantioxidant effects ofLactobacillusplantarumMA2[J]. Food Chemistry, 2017,221:1642-1649.
[3] ZHANG Z, LIU Z, TAO X, et al. Characterization and sulfated modification of an exopolysaccharide fromLactobacillusplantarumZDY2013 and its biological activities[J]. Carbohydrate Polymers, 2016,153:25-33.
[4] WANG K, LI W, RUI X, et al. Chemical modification, characterization and bioactivity of a released exopolysaccharide (r-EPS1) fromLactobacillusplantarum70810[J]. Glycoconjugate Journal, 2015,32:17-27.
[5] WANG J, ZHAO X, YANG Y W, et al. Characterization and bioactivities of an exopolysaccharide produced byLactobacillusplantarumYW32[J]. International Journal of Biological Macromolecules, 2015,74:119-126.
[6] WANG J, ZHAO X, TIAN Z, et al. Characterization of an exopolysaccharide produced byLactobacillusplantarumYW11 isolated from Tibet Kefir[J]. Carbohydrate Polymers, 2015,125:16-25.
[7] BOELS I C, VAN KRANENBURG R, HUGENHOLTZ J, et al. Sugar catabolism and its impact on the biosynthesis and engineering of exopolysaccharide production in lactic acid bacteria[J]. International Dairy Journal, 2001,11(9):723-732.
[8] 胡盼盼, 宋微, 单毓娟, 等. 影响乳酸菌胞外多糖产量的因素[J]. 食品科技, 2014,39(9): 31-37.
HU P P,SONG W,SHAN Y J, et al.Factors contributing to the yield of exopolysaccharide by lactic acid bacteria[J].Food Science and Technology, 2014,39(9): 31-37.
[9] 李盛钰, 曾宪鹏, 杨贞耐. 提高乳酸菌胞外多糖产量的途径[J]. 食品与生物技术学报, 2009, 28(3): 289-293.
LI S Y, ZENG X P, YANG Z N. Strategies for increasing of exopolysaccharide productionin lactic acid bacteria[J].Journal of Food Science and Biotechnology, 2009, 28(3): 289-293.
[10] MAJUMDER A, SINGH A, GOYAL A. Application of response surface methodology for glucan production fromLeuconostocdextranicumand its structural characterization[J]. Carbohydrate Polymers, 2009,75(1):150-156.
[11] ROMLING U, GALPERIN M Y, GOMELSKY M. Cyclic di-GMP: the first 25 years of a universal bacterial second messenger[J].Microbiology and Molecular Biology Reviews, 2013,77(1):1-52.
[12] ZHANG L, ZHANG X, LIU C, et al. Manufacture of Cheddar cheese using probioticLactobacillusplantarumK25 and its cholesterol-lowering effects in a mice model[J]. World Journal of Microbiology & Biotechnology, 2013,29(1):127-135.
[13] 王辑, 王影, 张雪, 等. 植物乳杆菌K25发酵乳对衰老模型小鼠的抗氧化作用[J]. 吉林农业大学学报, 2013, 35(1):98-101.
WANG J, WANG Y, ZHANG X, et al.Antioxidative effect ofLactobacillusplantarumK25 fermented milk on aged model mice[J]. Journal of Jilin Agricultural University, 2013, 35(1):98-101.
[14] 王辑, 张雪, 李达, 等. 植物乳杆菌K25 的技术特性[J]. 食品与生物技术学报, 2012,31: 518-524.
WANG J, ZHANG X, LI D, et al. Technological properties ofLactobacillusplantarumK25[J]. Journal of Food Science and Biotechnology, 2012, 31:518-524.
[15] 郭夏蕾, 张健, 杨贞耐. 抑制口腔变异链球菌的乳酸菌筛选及其抑菌机理[J]. 食品科学, 2016, 37(19): 117-122.
GUO X L, ZHANG J, YANG Z N. Screening of lactic acid bacteria for inhibiting oralStreptococcusmutansand preliminary study of antibacterial mechanism[J].Food Science, 2016, 37(19): 117-122.
[16] DUBOC P, MOLLET B. Applications of exopolysaccharides in the dairy industry[J].International Dairy Journal, 2001,11(9):759-768.
[17] YEESANG C, CHANTHACHUM S, CHEIRSILP B. Sago starch as a low-cost carbon source for exopolysaccharide production byLactobacilluskefiranofaciens[J]. World Journal of Microbiology & Biotechnology, 2008,24(7):1195-1201.
[18] POLAK-BERECKA M, CHOMA A, WASKO A, et al. Physicochemical characterization of exopolysaccharides produced byLactobacillusrhamnosuson various carbon sources[J]. Carbohydrate Polymers, 2015,117:501-509.
[19] TORINO M I, TARANTO M P, SESMA F, et al. Heterofermentative pattern and exopolysaccharide production byLactobacillushelveticusATCC 15807 in response to environmental pH[J].Journal of Applied Microbiology, 2001,91(5):846-852.
[20] QIN Q L, LI Y, SUN M L, et al. Comparative transcriptome analysis reveals that lactose acts as an inducer and provides proper carbon sources for enhancing exopolysaccharide yield in the deep-sea bacteriumZunongwangiaprofundaSM-A87[J]. Plos One, 2015,10(2): e0115998.
[21] YILMAZ M, CELIK G Y, ASLIM B, et al. Influence of carbon sources on the production and characterization of the exopolysaccharide (EPS) byBacillussphaericus7055 strain[J]. Journal of Polymers and the Environment, 2012,20(1):152-156.
[22] NOCELLI N, BOGINO P C, BANCHIO E, et al. Roles of extracellular polysaccharides and biofilm formation in heavy metal resistance of rhizobia[J]. Materials, 2016,9(6): 418.
[23] HAN Y Z, LIU E Q, LIU L S, et al. Rheological, emulsifying and thermostability properties of two exo-polysaccharides produced byBacillusamyloliquefaciensLPL061[J]. Carbohydrate Polymers, 2015,115:230-237.
[24] AHMED Z, WANG Y P, ANJUM N, et al. Characterization of new exopolysaccharides produced by coculturing ofL.kefiranofacienswith yoghurt strains[J]. International Journal of Biological Macromolecules, 2013,59:377-383.
[25] LAWS A P, MARSHAL V M. The relevance of exo-polysaccharides to the rheological properties in milk fermented with ropy strains of lactic acid bacteria[J]. International Dairy Journal, 2001,11(9): 709-721.
