经MEGJ的cAMP传递介导Ang2调节缺氧大鼠血管平滑肌细胞低反应性*
2018-01-19杨光明刘良明
徐 竞, 杨光明, 李 涛, 刘良明
(第三军医大学大坪医院野战外科研究所二室, 创伤、烧伤与复合伤国家重点实验室, 重庆 400042)
严重创伤/休克是40岁以下人群的重要死亡原因,在严重创伤/休克晚期出现的血管低反应性,是导致患者对血管活性物质的舒缩反应功能降低甚至丧失的重要原因,甚至可导致患者即使接受积极复苏仍然无法维持血压,很大程度上影响着患者的预后和转归[1-2]。
本实验室以往研究发现,失血性休克晚期表达增高的血管生成素2 (angiopoietin-2,Ang2)对血管诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达和血管舒缩功能的调节作用是导致血管低反应性发生的重要机制[3-4]。然而我们又发现,尽管Ang2对血管iNOS表达和血管低反应性的调节作用依赖于血管内皮细胞(vascular endothelial cells,VECs)表面特异表达的Tie2受体,但介导Ang2调节作用的iNOS却大部分由血管平滑肌细胞(vascular smooth muscle cells,VSMCs)产生。本实验室的前期研究发现,VECs与VSMCs间的缝隙连接,即肌内皮缝隙连接(myoendothelial gap junction,MEGJ)介导了缺氧大鼠VSMCs的iNOS的表达增高和低反应性的调节, 其中,缝隙连接蛋白43(connexin 43,Cx43)是参与其中的缝隙连接子亚型调节分子,但具体机制尚不清楚。
基础研究表明,MEGJ主要以低电阻快速传递电信号的电偶联功能以及通透和传递小分子物质的通道功能,在相邻的细胞A和细胞B之间实现跨细胞信号转导和通讯[5]。缝隙连接允许电信号和分子质量低于1 000 Da或直径小于1.0 nm的离子或小分子物质通过,如H2O和第二信使[Ca2+、肌醇三磷酸(inositol triphosphate,IP3)、环磷酸腺苷(cyclic adenosine monophosphate,cAMP)和环磷酸鸟苷(cyclic guanosine monophosphate,cGMP]等[5]。iNOS的表达不依赖于钙离子,与膜电位无关[6],且有文献报道,在大鼠星形胶质细胞中,cAMP高表达可诱导iNOS表达[7]。那么, 失血性休克后Cx43通道开放是否可以通过传递第二信使物质cAMP,介导内皮依赖的Ang2对VSMCs的iNOS表达和血管反应性的调节呢?
本实验在建立大鼠VECs和VSMCs双面共培养模型的基础上,对细胞进行RNA干扰(RNA interfe-rence,RNAi)和缺氧(hypoxia)等处理,后采用Wes-tern blot技术检测VSMCs中iNOS的表达,通过检测FITC标记的牛血清白蛋白(FITC-labeled bovine se-rum albumin,FITC-BSA)的荧光透过率反映VSMCs的收缩反应性,采用Alexa Fluor 488-cAMP观察cAMP跨MEGJ转运情况,研究MEGJ介导缺氧VSMCs的iNOS高表达和低反应性的调节机制。
材 料 和 方 法
1 实验动物和试剂
从第三军医大学第三附属医院实验动物中心购买清洁级SD大鼠, 雌雄各半,体重200~230 g,实验动物使用许可证编号为SCXK(渝)2012-0010。抗大鼠β-actin和iNOS抗体、外源性重组Ang2、FITC-BSA、cAMP ELISA试剂盒和cAMP 抑制剂Rp-8-Br-cAMP购自Sigma;羊抗兔或抗小鼠IgG的 II 抗购自Pierce;Cx43 小干扰RNA(small interfering RNA, siRNA)、Cx40 siRNA及siRNA转染试剂购自Thermo Fisher Scientific;Alexa Fluor 488-cAMP和Influx Pinocytic 细胞加载试剂购自Molecular Probes。
2 实验方法
2.1VECs和VSMCs双面共培养系统的建立、 RNAi处理和缺氧处理 按照文献方法,将SD大鼠麻醉后分离肠系膜上动脉,分别原代培养VECs和VSMCs[8],并建立VECs和VSMCs双面共培养模型[6]:采用Transwell双面培养皿(Corning,膜孔径为0.4 μm),以1×105的密度在膜反面接种VSMCs,CO2培养箱中培养1 d后将培养皿翻转,然后以2×105的密度在膜正面接种VECs,最后将接种好的双面培养皿置于CO2培养箱中培养3 d, 细胞融合>90%即可。
RNAi处理时,采用培养好的VECs和VSMCs双面共培养系统,按照siRNA转染试剂说明书建议的操作步骤,将转染试剂(终浓度0.4 μL/100 μL)分别转染Cx43 siRNA(25 nmol/L)和Cx43 siRNA(50 nmol/L),在无抗生素的20%小牛血清DMEM-F12完全培养基中培养4 d,完成RNAi处理,以阴性对照(negative cintrol)siRNA作对照,明确抑制效果。
作缺氧处理时,将已接种并培养好的双面培养皿置入缺氧罐,充入缺氧气体(5% CO2和95 % N2)15 min,然后夹闭平衡10 min,完成“充气-夹闭”循环5次后,再做1次充气15 min,最后按照各实验组要求夹闭相应时间,即完成缺氧处理。Ang2+缺氧处理组:在缺氧处理前于双面培养基的VECs面加入外源性重组Ang2, 终浓度为200 μg/L, 后进行缺氧处理。
2.2cAMP 转运检测 根据文献,采用荧光标记的Alexa Fluor 488-cAMP观察cAMP的跨MEGJ转运[7]:取按实验分组完成缺氧等处理的双面培养皿,用Influx Pinocytic 细胞加载试剂在VECs中加载Alexa Fluor 488-cAMP,浓度125 μmol/L,稳定10 min后,取双面培养皿膜,Leica TCS-SP激光共聚焦显微镜沿Z轴进行XY平面层扫,扫描间隔0.13 μm。以VECs侧和VSMCs侧XY平面的Alexa Fluor 488-cAMP荧光密度差值定量cAMP的跨MEGJ转运。
2.3VSMCs蛋白提取和iNOS蛋白表达检测 取按实验组完成缺氧等处理的双面培养皿,在细胞裂解液中刮取双面培养皿膜的下表面细胞(接种VSMCs),室温裂解30 min后,4 °C、 12 000×g离心15 min,即得到VSMCs的蛋白成分。iNOS蛋白表达检测采用常规Western blot法,以β-actin为内参照。
2.4VSMCs收缩反应性的测定 取完成缺氧等处理的双面培养皿,每个样本设2个双面培养皿,一个为实验皿加去甲肾上腺素(norepinephrine,NE)处理,另一个为对照皿不加去甲肾上腺素处理。在双面培养皿的上腔液中加入10 g/L的FITC-BSA, 然后在下腔液中加入NE或培养基 (实验皿中加入1×10-9mol/L的NE,对照皿中加入等体积的培养基)。每间隔15 min从下腔液中抽取等体积(100 μL)培养液,根据下腔抽取液的荧光值计算累计荧光通透率,检测VSMCs的收缩反应性。
3 统计学处理
采用SPSS 10.0统计软件处理。以均数±标准差(mean±SD)表示,多组间样本均数的比较采用单因素方差分析(one-way ANOVA),采用SNK-q检验进行多个样本均值的两两比较。以P<0.05为差异有统计学显著性。
结 果
1 缺氧及Ang2处理后单独培养和双面共培养VECs和VSMCs中的cAMP浓度差的变化
在单独培养的VECs和VSMCs中,与正常对照(normal control)组比较, 4 h缺氧及外源性Ang2(200 μg/L)处理30 min后, cAMP浓度均显著增高;但VECs和VSMCs的水平并不相同,VECs中cAMP的水平显著高于VSMCs中的水平(P<0.05),见图1A。但在双面共培养系统中,VECs和VSMCs中cAMP的浓度差明显降低,且VSMCs中增高的cAMP水平可被Cx43 siRNA (50 nmol/L)显著抑制(Cx43 siRNA在双面共培养系统的VECs侧,缺氧前给药)(P<0.05);Cx40 siRNA (25 nmol/L)无明显抑制作用,见图1B。
2 缺氧及Ang2处理后cAMP跨MEGJ转运的变化
根据以往研究,采用Alexa Fluor 488-cAMP 为cAMP转运的示踪剂,观察cAMP从VECs到VSMCs的跨MEGJ转运。结果显示,在4 h缺氧及Ang2(200 μg/L)处理后,荧光标记的cAMP明显地从VECs转运到VSMCs(P<0.05),且这种转运可以被Cx43 siRNA (50 nmol/L;在双面共培养系统的VECs侧,缺氧前给药)显著抑制(P<0.05);而Cx40 siRNA (25 nmol/L)无明显抑制作用,见图2。
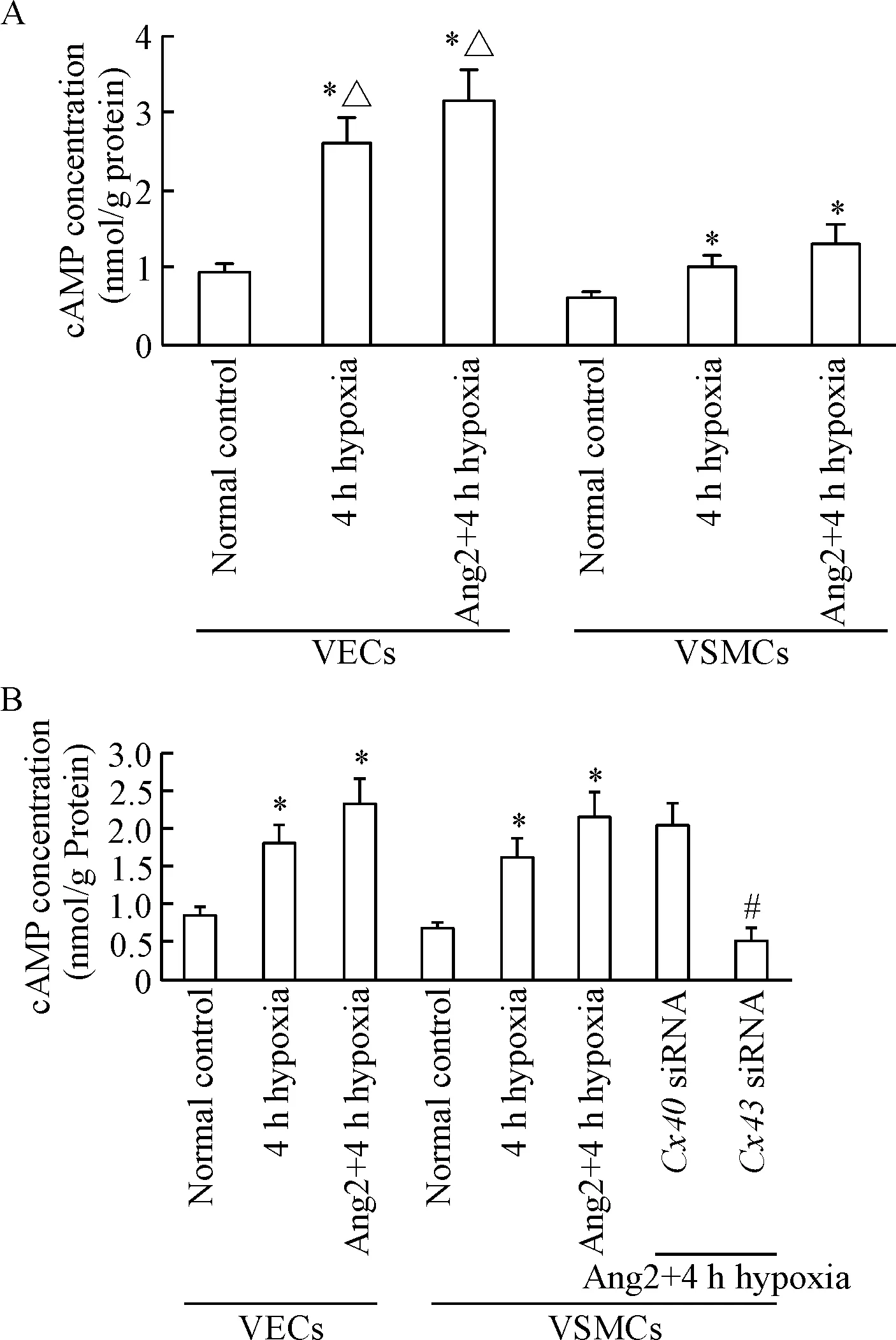
Figure 1. The change of cAMP level in separately cultured and co-cultured VECs and VSMCs after hypoxia and Ang2 treatment. A: the separately cultured VECs and VSMCs. B: the double-sided co-culture model. Mean±SD.n=6.*P<0.05vsnormal control group;#P<0.05vsAng2+4 h hypoxia group;△P<0.05vsVSMCs in the same group.
图1缺氧及Ang2处理后单独培养和双面共培养系统VECs和VSMCs中的cAMP浓度差的变化
3 抑制cAMP对VSMCs的iNOS高表达和收缩反应的影响
缺氧后双面共培养系统的VSMCs中iNOS表达显著增高,收缩反应性显著降低,并在外源性Ang2(200 μg/L)作用下进一步加重; 在双面共培养系统的VECs和VSMCs侧分别给予cAMP抑制剂Rp-8-Br-cAMP (100 μmol/L),均可显著抑制外源性Ang2作用下缺氧后VSMCs的iNOS表达增高(P<0.05),并改善VSMCs的收缩低反应性(P<0.05),见图3。
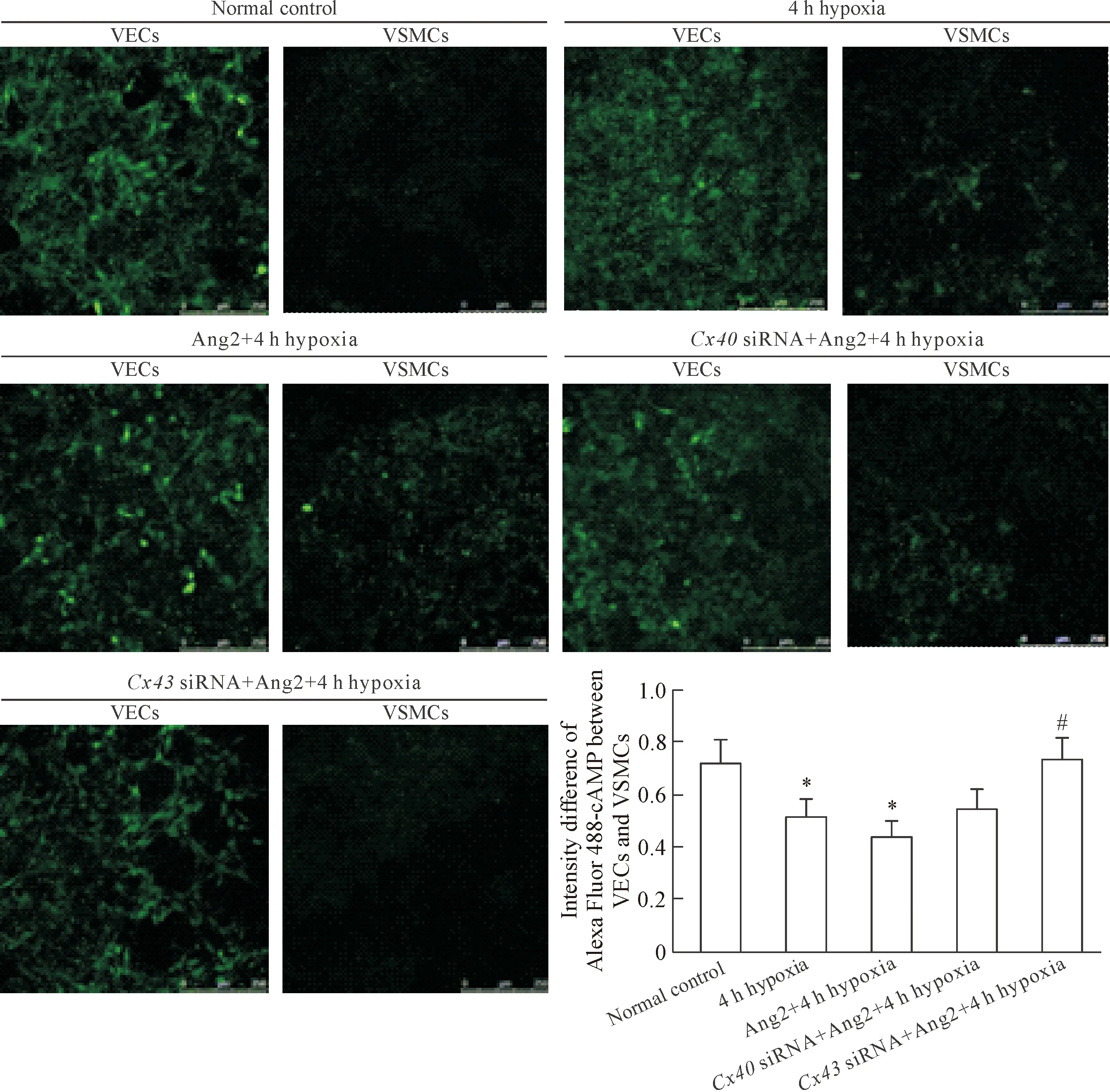
Figure 2. The change of cAMP transfer across MEGJ after hypoxia and Ang2 treatment. The scale bar=250 μm. Mean±SD.n=4.*P<0.05vsnormal control group;#P<0.05vsAng2+4 h hypoxia group.
图2缺氧及Ang2处理后cAMP跨MEGJ转运的变化
讨 论
血管低反应性是严重创伤/休克等临床重症晚期的重要病理生理改变,Ang2对血管iNOS表达和血管舒缩功能的调节是导致休克血管低反应性发生的重要机制,本实验室前期研究发现,MEGJ介导了Ang2对缺氧大鼠VSMCs的iNOS表达增高和低反应性的调节,Cx43是主要的Cx亚型。但Cx43亚型又是通过何种分子的通透进行跨细胞的信息传递?目前仍不清楚。
Cx的亚型很多,在血管系统中表达有Cx37、 Cx40、 Cx43 和Cx45[9-10],但本文中只观察了Cx40和Cx43,主要原因如下:第一,据文献报道, Cx40和Cx43是血管收缩功能相关的亚型[11-13],Cx45在血管系统的发生和成熟中发挥作用[14],Cx37在血管的狭窄闭塞中起作用,如动脉粥样硬化等[15-16];第二,在体内[6]和体外[17-18]实验中均发现,VECs和VSMCs之间的MEGJ中只有Cx40和Cx43存在,而没有发现其他Cx亚型。因此, 本实验重点观察了Cx40和Cx43的作用,发现在单独培养的VECs和VSMCs中,4 h缺氧及Ang2处理后, cAMP浓度均显著增高,但在VECs和VSMCs中的水平并不相同,在VECs中的水平显著高于VSMCs中的水平;但在双面共培养系统中,VECs和VSMCs中的cAMP浓度差明显降低,且VSMCs中增高的cAMP水平可被Cx43 siRNA显著抑制。在Ang2处理的缺氧后,荧光标记的Alexa Fluor 488-cAMP发生明显的从VECs到VSMCs的转运,且可被Cx43 siRNA显著抑制。 在双面共培养系统的VECs或VSMCs侧给予cAMP抑制剂均可显著抑制Ang2处理的缺氧后VSMCs中的iNOS高表达,改善VSMCs的收缩反应性,提示缺氧后MEGJ通道可能通过传递第二信使物质cAMP,调节VSMC中的iNOS表达和血管舒缩功能。
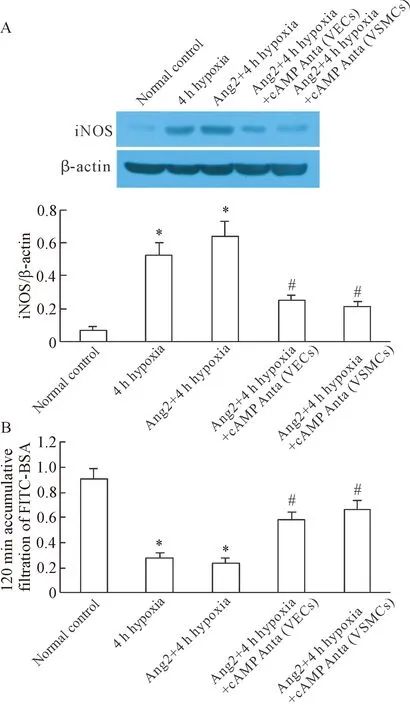
Figure 3. The effects of cAMP antagonist (Anta) on the iNOS protein expression in VSMCs (A) and the vascular hyporeactivity (B). Mean±SD.n=4.*P<0.05vsnormal control group;#P<0.05vsAng2+4 h hypo-xia group.
图3抑制cAMP对VSMCs的iNOS高表达和收缩反应的影响
我们在研究中发现,缺氧后VECs和VSMCs存在cAMP的浓度差异,并通过跨MEGJ的转运介导VSMCs收缩反应调节,实际上在以往的文献里面也有一致的相关报道。例如在家兔髂动脉,乙酰胆碱促使cAMP经MEGJ进入VSMCs富集,从而诱导血管舒张,缝隙连接解偶联剂18β-甘草次酸(glycyrrhetinic acid,GA)以及连接蛋白模拟抑制肽37,43Gap27可抑制其作用[19];在兔动脉血管,乙酰胆碱诱发的EDHF型内皮依赖的血管舒张反应伴随着增高的cAMP水平,尤其是在VSMCs中,抑制cAMP水解可以增强舒张反应,这种舒张反应可以被GJ解偶联剂18α-GA和连接蛋白特异的Gap27抑制肽所抑制[20],提示cAMP可透过MEGJ,参与内皮依赖的血管舒缩功能的调节。这与我们的研究结果一致。
综上所述,我们的研究发现,缺氧后Ang2可能通过MEGJ的Cx43通道蛋白,促进从VECs向偶联的VSMCs传递cAMP,调节VSMCs中的iNOS表达和血管舒缩功能,从而参与血管低反应性的发生。
[1] Levy B, Collin S, Sennoun N, et al. Vascular hyporesponsiveness to vasopressors in septic shock: from bench to bedside[J]. Intensive Care Med, 2010, 36(12):2019-2029.
[2] 周 荣, 陈 凤, 李 强, 等. 血管平滑肌细胞钙库Ca2+动员的变化在休克血管低反应性形成中的作用[J]. 中国病理生理杂志, 2010, 26(10):1873-1878.
[3] Xu J, Lan D, Li T, et al. Angiopoietins regulate vascular reactivity after hemorrhagic shock in rats through the Tie2-nitric oxide pathway[J]. Cardiovasc Res, 2012, 96(2):308-319.
[4] 徐 竞, 李 涛, 杨光明, 等. Ang-1、Ang-2差异表达在大鼠失血性休克血管反应性双相变化中的作用[J]. 中国病理生理杂志, 2010, 26(9):1684-1688.
[5] Maeda S, Tsukihara T. Structure of the gap junction channel and its implications for its biological functions[J]. Cell Mol Life Sci, 2010, 68(7):1115-1129.
[6] Isakson BE, Duling BR. Heterocellular contact at the myoendothelial junction influences gap junction organization[J]. Circ Res, 2005, 97(1):44-51.
[7] Bopp T, Becker C, Klein M, et al. Cyclic adenosine monophosphate is a key component of regulatory T cell-mediated suppression[J]. J Exp Med, 2007, 204(6):1303-1310.
[8] 明 佳, 徐 竞, 李 涛, 等. 连接蛋白40/43调节大鼠血管平滑肌细胞内钙离子浓度与肠系膜上动脉收缩反应性的研究[J]. 中华烧伤杂志, 2009, 25(1):31-35.
[9] Johnstone S, Isakson B, Locke D. Biological and biophy-sical properties of vascular connexin channels[J]. Int Rev Cell Mol Biol, 2009, 278:69-118.
[10] 明 佳,杨光明,李 涛,等. Cx40和Cx43调节大鼠肠系膜上动脉收缩反应性与钙敏感性的机制[J]. 中国病理生理杂志, 2008, 24(11):2081-2086.
[11] Morton SK, Chaston DJ, Howitt L, et al. Loss of functional endothelial connexin40 results in exercise-induced hypertension in mice[J]. Hypertension, 2015, 65(3):662-669.
[12] Zhang J, Yang GM, Zhu Y, et al. Bradykinin induces vascular contraction after hemorrhagic shock in rats[J]. J Surg Res, 2015, 193(1):334-343.
[13] López D, Rodríguez-Sinovas A, Agulló E, et al. Replacement of connexin 43 by connexin 32 in a knock-in mice model attenuates aortic endothelium-derived hyperpola-rizing factor-mediated relaxation[J]. Exp Physiol, 2009, 94(10):1088-1097.
[14] Krüger O, Plum A, Kim JS, et al. Defective vascular development in connexin 45-deficient mice[J]. Development, 2000, 127(19):4179-4193.
[15] Collings A, Islam MS, Juonala M, et al. Associations between connexin37 gene polymorphism and markers of subclinical atherosclerosis: the Cardiovascular Risk in Young Finns study[J]. Atherosclerosis, 2007, 195(2):379-384.
[16] Lanfear DE, Jones PG, Marsh S, et al. Connexin37 (GJA4) genotype predicts survival after an acute coronary syndrome[J]. Am Heart J, 2007, 154(3):561-566.
[17] Isakson BE. Localized expression of an Ins(1,4,5)P3receptor at the myoendothelial junction selectively regulates heterocellular Ca2+communication[J]. J Cell Sci, 2008, 121(Pt 21):3664-3673.
[18] Sandow SL, Garland C. Spatial association of K-Ca and gap junction connexins in rat mesenteric artery[J]. FASEB J, 2006, 20 (4):A275.
[19] Chaytor AT, Taylor HJ, Griffith TM. Gap junction-dependent and -independent EDHF-type relaxations may involve smooth muscle cAMP accumulation[J]. Am J Phy-siol Heart Circ Physiol, 2002, 282(4): H1548-H1555.
[20] Taylor HJ, Chaytor AT, Edwards DH, et al. Gap junction-dependent increases in smooth muscle cAMP underpin the EDHF phenomenon in rabbit arteries[J]. Biochem Biophys Res Commun, 2001, 283(3):583-589.
