bFGF通过促进心脏血管新生改善心肌梗死后小鼠心脏重构*
2018-01-19沈丹萍戈东辉陈显达吴雨晴褚茂平
沈丹萍, 戈东辉, 陈显达, 吴雨晴, 李 磊, 褚茂平
(温州医科大学附属第二医院, 育英儿童医院, 儿童心脏中心, 温州医科大学心脏发育与转化医学研究所, 浙江 温州 325027)
碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是成纤维生长因子家族的一员,在神经系统和心脏中表达丰富,并且具有促进血管生成和细胞增殖迁移等作用[1]。研究表明,外源性bFGF能够减轻脑损伤患者脑水肿,保护血脑屏障的完整性;同样,在脊髓损伤患者中,它能够保证血-脊髓屏障的完整性[2-3]。在心肌缺血再灌注模型中,bFGF能够通过激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/丝氨酸-苏氨酸蛋白激酶(protein kinase B,PKB,即AKT)信号通路抑制内质网应激和过度的自噬反应, 以及清除过多的泛素化蛋白从而来减轻心脏的损伤[4-5]。bFGF也能促进急性心梗时Bcl-2的表达,抑制Bax的表达,减少心肌凋亡[6]。另有研究表明, bFGF能够促进内皮细胞的有丝分裂和血管新生。Nakamichi等[7]研究发现了bFGF能够促进小鼠的皮肤损伤处血管新生。虽然已有几项研究表明bFGF能够促进急性心肌缺血区血管新生,改善左心室功能[8],但其对于慢性心肌梗死的作用及其深入机制尚未见报道。本研究通过复制小鼠心肌梗死模型,观察bFGF能否通过AKT通路激活下游的缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)以及血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白,从而促进心脏梗死区微血管新生,改善心肌重构和心功能。
材 料 和 方 法
1 动物
清洁级C57/B6小鼠,雄性,8~12周龄,18~20 g,由温州医科大学实验动物中心提供,使用许可证号为SYXK(浙)2015-0009。
2 主要试剂
bFGF购自浙江生物技术和制药工程重点实验室;Masson染色试剂盒、BCA蛋白定量试剂盒和Cy3标记山羊抗兔IgG(H+L)购自上海碧云天公司;抗p-AKT、 AKT和HIF-1α抗体及HRP标记山羊抗兔IgG购自CST;抗VEGF抗体购自Santa Cruz;抗CD31抗体购自Abcom;ECL 显色液购自Advansta;异氟烷购自瑞沃德公司;冠状动脉结扎线购自宁波成和公司;其它生化试剂均为进口分装或国产分析纯。
3 主要方法
3.1小鼠心肌梗死模型的建立 用异氟烷吸入麻醉小鼠,直视下气管切开,小动物呼吸机辅助呼吸,左侧第4 肋间入胸,识别前降支走行范围,7/0滑线结扎前降支,当左心室前壁部分颜色转为苍白,确认小鼠心梗模型成功之后一直维持血管结扎,结扎位置基本相同; 假手术(sham)组用7/0滑线穿过前降支下面而不结扎; bFGF治疗组于造模成功7 d后隔天腹腔注射给药,每只5 μg,直至28 d,总共给药10次。
3.2超声心动图检测 心梗后7 d及28 d时,用4%水合氯醛腹腔注射麻醉动物,取仰卧位。使用西门子ACUSON SEQUOIA 512彩色超声诊断仪检查小鼠心功能,探头频率为12~14 Mz。取左心室乳头肌水平二维左室短轴切面,记录左室收缩末期内径(left ventricular end-systolic diameter,LVESD)及左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD),由超声心动图电脑自动计算左室射血分数(left ventricular ejection fraction,LVEF)和左室短轴缩短率(left ventricular fractional shortening,LVFS),取连续3个心动周期的平均值。
3.3心肌组织Masson染色 实验小鼠28 d后脱颈椎处死, 立即开胸取心脏,放入PBS中(冰上预冷),将血液挤干净,将心室组织做石蜡切片,之后常规脱蜡入水,蒸馏水冲洗干净滴入丽春红液染4 min;再次蒸馏水流水冲洗干净,滴入磷钼酸液染2 min;甩干液体后用苯胺蓝液染7 min。梯度乙醇脱水,二甲苯透明,中性树脂封片。
3.4免疫荧光染色观察 将上述各组小鼠心脏组织OCT包埋后做冰冻切片,室温复温30 min后PBS清洗3次,擦干之后加5% BSA室温封闭30 min。然后用抗CD31抗体(1∶200)4 °C孵育过夜。用PBS-Tween洗3遍后,用Cy3标记山羊抗兔IgG(1∶500)在37 ℃孵育1 h,PBS-Tween洗4次后,DAPI染色7 min,PBS-Tween洗4次后擦干加抗荧光淬灭剂后封片。荧光显微镜下拍照。
3.5Western blot 实验 小鼠脱颈椎处死后立即开胸取心脏,放入PBS中(冰上预冷),将血液挤干净,保留冠脉结扎线以下左室心肌组织, 称量后放入有裂解液(含蛋白裂解液及蛋白酶抑制剂)的匀浆管中,匀浆机裂解心肌组织,冰上裂解30 min,离心后超声3次,每次间隔1 min,12 000×g、4 ℃离心30 min后取上清行BCA法蛋白定量,准备蛋白样品。用10% SDS-PAGE 分离蛋白后,转膜,用5%的脱脂牛奶封闭2 h,加 I 抗4 ℃孵育过夜,TBS-Tween 洗3 次,加HRP 偶联 II 抗于室温孵育2 h,TBS-Tween 洗3 次,加ECL 液曝光、显影、定影。用扫描仪扫描曝光胶片,用Image Lab软件分析条带灰度值。
4 统计学处理
用SPSS 21.0统计软件进行分析。数据采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni校正的t检验,以P<0.05 为差异有统计学意义。
结 果
1 bFGF改善心肌梗死后心肌纤维化程度
根据Masson染色结果发现, 28 d后心肌梗死组心肌组织出现明显的心肌纤维化,而bFGF给药组能够有效减少心肌纤维化程度(P<0.05),见图1。
2 bFGF改善心肌梗死后的心功能
超声心动图结果显示,心肌梗死组各项心功能比正常假手术组较差,bFGF组能显著改善心肌梗死28 d后小鼠心功能,与MI组相比, bFGF组能有效减少左室收缩期末内径(P<0.05),LVEF和LVFS值明显升高(P<0.05),见图2。
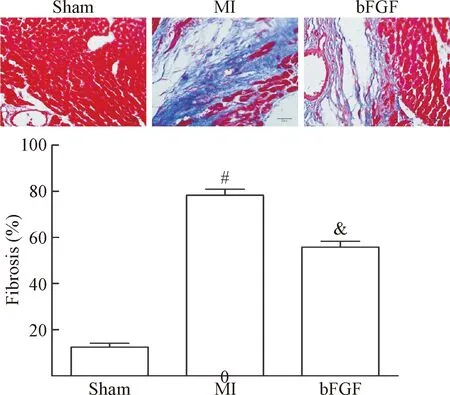
Figure 1. Myocardial tissues with Masson staining at 28 d after MI (×400). Mean±SD.n=3.#P<0.05vssham group;&P<0.05vsMI group.
图1心肌梗死28d后心肌组织的Masson染色结果
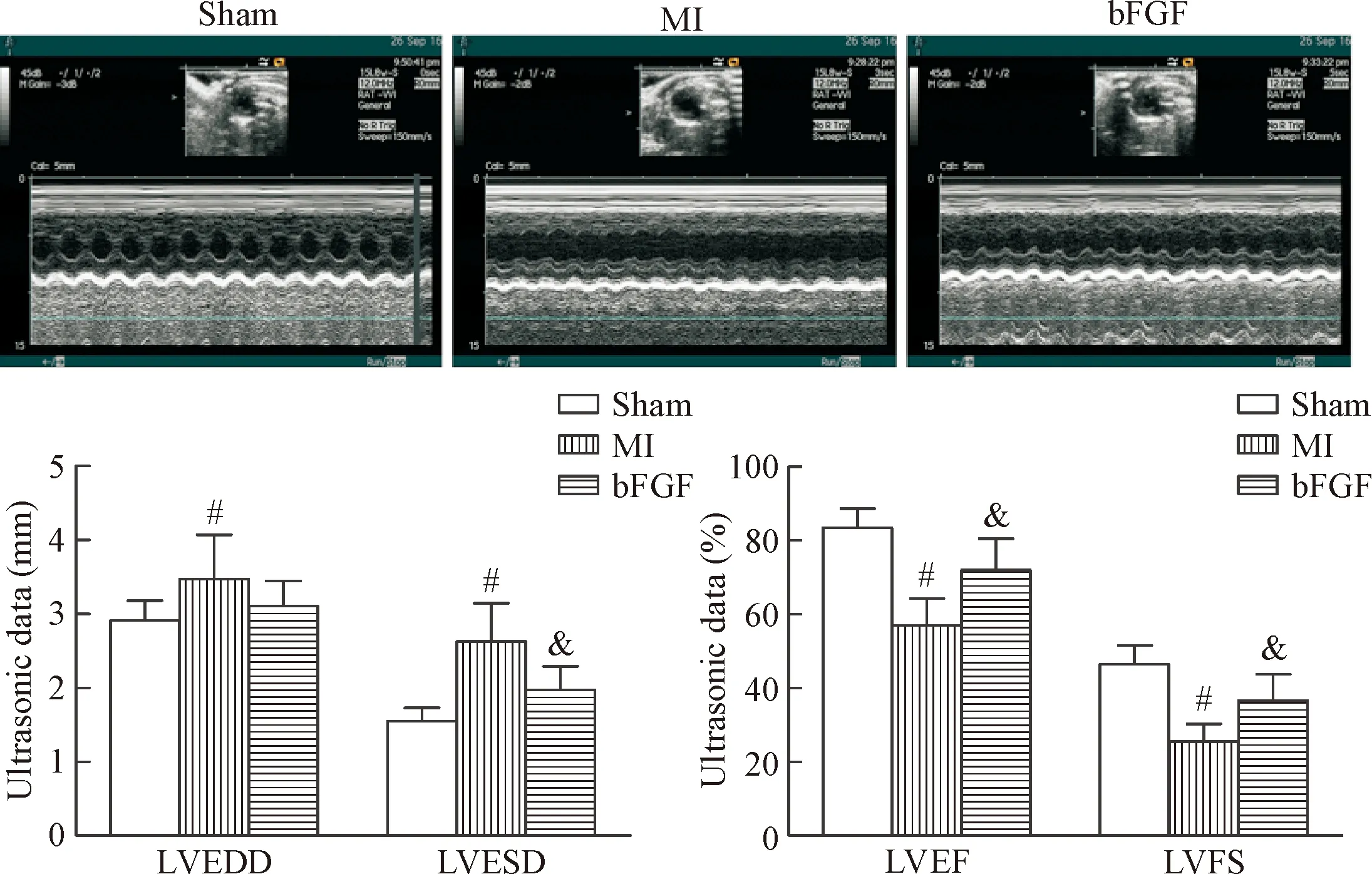
Figure 2. The results of echocardiography at 28 d after MI. Mean±SD.n=10.#P<0.05vssham group;&P<0.05vsMI group.
图2心肌梗死28d后的超声心动图结果
3 bFGF促进梗死区组织血管新生
CD31是内皮细胞的标志物。本实验对梗死区组织中的CD31进行免疫荧光染色来检测梗死区微毛细血管的数量。在高倍镜下,梗死区域可见MI组的血管密度比sham组的低,而bFGF给药组的血管密度比MI组高(P<0.05),见图3。
4 bFGF激活心肌AKT/HIF-1α/VEGF信号通路
已有研究报道在血管内皮缺氧的情况下,能够上调PI3K/AKT/HIF-1α信号通路的活性,从而能够改善血管内皮细胞抗缺氧损伤的作用[9]。因此我们推测bFGF也能够通过该通路促进梗死区血管新生,我们检测了第10天时小鼠心肌中AKT、HIF-1α以及其靶蛋白VEGF的蛋白水平变化。结果发现第10天时心梗组AKT磷酸化水平比假手术组要高(P<0.05),但是HIF-1α及VEGF蛋白水平和假手术组比较差异并没有统计学显著性;而与心梗组比较,bFGF给药组的HIF-1α(P<0.05)及VEGF(P<0.05)的蛋白水平更高,心梗28 d后的蛋白变化趋势跟第10天的蛋白变化趋势一致,说明bFGF通过隔天腹腔给药能够激活AKT/HIF-1α/VEGF通路,见图4。
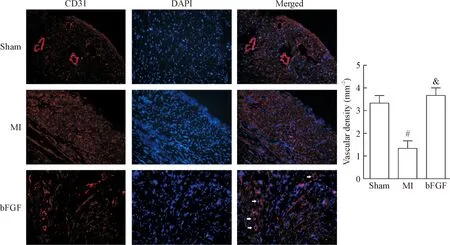
Figure 3. Myocardial tissues with CD31 immunofluorescence staining at 28 d after MI (×200). Mean±SD.n=3.#P<0.05vssham group;&P<0.05vsMI group.
图3心肌梗死28d后小鼠心肌病理切片的CD31免疫荧光染色
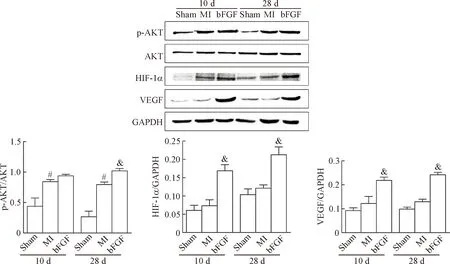
Figure 4. The levels of AKT/HIF-1α/VEGF signaling pathway-related proteins at 10 d and 28 d after MI.Mean±SD.n=3 .#P<0.05vssham group;&P<0.05vsMI group.
图4心肌梗死第10天及第28天后各组AKT/HIF-1α/VEGF通路相关蛋白水平的变化
讨 论
随着心肌梗死发病率和致死率的逐年攀升,已成为严重威胁全球人民的身体健康。急性期心肌梗死主要的死亡原因是急性心衰竭,随着医疗水平的进步,内科药物溶栓、介入支架和外科的搭桥手术使急性期心梗发展成急性心衰进而导致死亡的几率大幅度下降。但随着病情的进一步发展可转为慢性期。慢性期主要以心脏纤维化重塑为主,如果纤维重塑过度会引发慢性心衰导致死亡。然而,到目前为止预防和治疗心脏纤维化重塑过度尚无好的方法[10]。
近年来用外源性蛋白因子促进血管新生可能成为一种有效治疗心肌缺血的办法。bFGF在心脏呈高表达,具有较强的促内皮细胞和平滑肌细胞增殖、迁移和分化的作用。研究表明, 心肌内注射外源性bFGF,能有效减少梗死面积,促血管新生[11]。但该给药途径具有创伤性,因此本研究采用了腹腔隔天注射给药,对该方法进行了探讨。结果发现隔天腹腔注射给药也能有效提高小鼠心功能,并且能够减少心肌纤维化。
持续表达HIF-1α能够减少心脏梗死区域,促进心梗边缘区新生血管形成,从而改善心肌重构[12]。心肌缺血虽然能够促进HIF-1α表达增加,但是这种代偿性适应是暂时性的,HIF-1α在心梗后期表达量将趋于正常[13]。在组织缺氧环境下,作为HIF-1α的靶蛋白, VEGF能特异性作用于血管内皮细胞,促进血管形成,从而部分缓解组织缺血[14]。已有研究表明,bFGF在急性心肌梗死后,能够增加HIF-1α和VEGF的mRNA水平[15]。本研究发现bFGF能够促进梗死边缘区血管新生,并深入研究了血管新生的机制,发现bFGF给药组心肌中AKT磷酸化水平、HIF-1α及VEGF蛋白水平明显比心梗组要高,也说明了bFGF可能通过激活该通路促进梗死边缘区血管新生,从而改善心肌纤维化保护心功能。
本实验的最大局限之处是没有设立bFGF抑制剂组,在血管新生机制研究方面,发现bFGF能够激活AKT/HIF-1α/VEGF通路,但是不能够说明一定是通过该通路促进梗死边缘区的血管新生,或者该通路可能协同其它通路共同参与血管新生的作用。因此对于bFGF促进心肌梗死边缘区血管新生的作用机制还有待进一步研究。
综上所述,本研究采用建立小鼠心肌梗死模型,隔天腹腔注射 bFGF,发现bFGF给药组比心梗组的心功能有好转,心肌纤维化减少,梗死边缘区新生血管增多;并且发现bFGF给药组能够提高AKT/HIF-1α/VEGF的蛋白水平,提示bFGF可能通过该通路促进梗死边缘区血管新生,保护心脏。
[1] Ornitz DM, Itoh N. Fibroblast growth factors[J]. Genome Biol, 2001, 2(3):REVIEWS3005.
[2] Wang ZG, Cheng Y, Yu XC, et al. bFGF protects against blood-brain barrier damage through junction protein regulation via PI3K-Akt-Rac1 pathway following traumatic brain injury[J]. Mol Neurobiol, 2016, 53(10):7298-7311.
[3] Ye LB, Yu XC, Xia QH,et al. Regulation of caveolin-1 and junction proteins by bFGF contributes to the integrity of blood-spinal cord barrier and functional recovery[J]. Neurotherapeutics, 2016, 13(4):844-858.
[4] Wang Z, Zhang H, Xu X, et al. bFGF inhibits ER stress induced by ischemic oxidative injury via activation of the PI3K/Akt and ERK1/2 pathways[J]. Toxicol Lett, 2012, 212(2):137-146.
[5] Wang ZG, Wang Y, Huang Y, et al. bFGF regulates autophagy and ubiquitinated protein accumulation induced by myocardial ischemia/reperfusion via the activation of the PI3K/Akt/mTOR pathway[J]. Sci Rep, 2015, 5:9287.
[6] 陈吉田, 陈昌捷. 碱性成纤维细胞生长因子对急性心肌梗死时心肌细胞内Bcl-2、Bax表达的影响[J]. 中国现代医学杂志, 2008, 18(4):420-422.
[7] Nakamichi M, Akishima-Fukasawa Y, Fujisawa C, et al. Basic fibroblast growth factor induces angiogenic properties of fibrocytes to stimulate vascular formation during wound healing[J]. Am J Pathol, 2016, 186(12):3203-3216.
[8] 姜志胜, 王晓红, 符民桂, 等. 内源性碱性成纤维细胞生长因子是大鼠对抗心脏缺血/再灌注损伤的保护因子[J]. 中国病理生理杂志, 2000, 16 (3):7-11.
[9] 梁俊清, 徐海波, 陈小娟, 等. 通心络通过PI-3K/AKT/HIF信号通路改善血管内皮细胞缺氧损伤[J]. 中国病理生理杂志, 2012, 28(5):846-851.
[10] Struthers AD. Pathophysiology of heart failure following myocardial infarction[J]. Heart, 2005, 91(Suppl 2): ii14-ii16; discussion ii31, ii43-ii48.
[11] Jiang ZS, Padua RR, Ju H, et al. Acute protection of ischemic heart by FGF-2: involvement of FGF-2 receptors and protein kinase C[J]. Am J Physiol Heart Circ Physiol, 2002, 282(3):H1071-H1080.
[12] Kido M, Du L, Sullivan CC, et al. Hypoxia-inducible factor 1-α reduces infarction and attenuates progression of cardiac dysfunction after myocardial infarction in the mouse[J]. J Am Coll Cardiol, 2005, 46(11):2116-2124.
[13] Lee SH, Wolf PL, Escudero R, et al. Early expression of angiogenesis factors in acute myocardial ischemia and infarction[J]. N Engl J Med, 2000, 342(9):626-633.
[14] Giles FJ. The vascular endothelial growth factor (VEGF) signaling pathway: a therapeutic target in patients with hematologic malignancies[J]. Oncologist, 2001, 6(Suppl 5):32-39.
[15] Yao HC, Liu T, Meng XY, et al. Effect of basic fibroblast growth factor on the myocardial expression of hypoxia-inducible factor-1alpha and vascular endothelial growth factor following acute myocardial infarction[J]. Heart Lung Circ, 2013, 22(11):946-951.
