脐带间充质干细胞源外泌小体减轻糖尿病模型小鼠心肌纤维化*
2018-01-19黄然然
黄然然, 辛 毅, 林 筝, 李 娜
(首都医科大学附属北京安贞医院, 北京市心肺血管疾病研究所, 北京 100029)
糖尿病心肌病(diabetic cardiomyopathy)是糖尿病(diabete mellitus,DM)患者死亡的重要原因,最早于1972 年由 Rubler 等[1]提出。它是一种独立的特异性心肌病,主要包括心肌病变和心脏间质纤维化两个方面, 最终导致心脏功能受损。心肌纤维化(cardiac fibrosis)指的是心肌组织成纤维细胞过度增生从而导致细胞外基质(extracellular matrix,ECM)大量沉积而形成的病理演变[2],心肌纤维化在糖尿病心肌病的发生和发展中起着重要的作用。在过去几十年的研究中,研究重点主要在心肌细胞水平,对心肌纤维化的病理生理过程及发病机制成为近年来攻克糖尿病心肌病的一个新的靶点。间充质干细胞不仅具有自我复制能力而且具有多向分化的潜能,目前研究结果显示,间充质干细胞可通过旁分泌和自分泌作用减轻心脏功能受损[3-5]。本课题组前期研究发现,人脐带间充质干细胞(human umbilical mesenchymal stem cells,HUMSCs)源外泌小体(exosome)对缺氧复氧损伤的心肌细胞和高糖诱导损伤的脐静脉内皮细胞具有保护作用[6]。然而外泌小体对糖尿病心肌纤维化的作用并不清楚。本研究通过尾静脉注射外泌小体,观察其对糖尿病小鼠心肌纤维化的影响,为糖尿病心肌纤维化的治疗提供实验依据。
材 料 和 方 法
1 实验动物和材料
6~8周龄SPF级C57BL/6雄性小鼠购于斯贝福(北京)生物技术有限公司,饲养于首都医科大学附属北京安贞医院实验动物中心,许可证号为SCXK(京)2016-0002。脐带标本取自无妊娠期并发症的剖宫产产妇,产妇及家属对脐带用于实验研究均知情同意并签署知情同意书,并经北京安贞医院医学伦理委员会批准。
2 主要试剂和仪器
高脂饲料购于北京华阜康生物科技股份有限公司;链脲佐菌素(streptozocin,STZ)购于Sigma。血糖仪和血糖试纸为北京怡成生物电子技术有限公司系列产品; 游离脂肪酸检测试剂盒和葡萄糖测定试剂盒购于南京建成生物工程研究所。酶标仪为BioTek产品;Vevo 770型超高频小动物彩色多普勒超声诊断仪为Visual Sonics产品;正置显微镜为Nikon产品。
3 主要方法
3.1人脐带间充质干细胞的提取、培养和鉴定以及外泌小体的提取和鉴定 将符合入选条件的脐带于培养皿中用磷酸盐缓冲液冲洗3遍,剖开脐带,分离脐带血管得到脐带周围的血管华通胶组织,将其剪成组织碎块,加入2 g/L的Ⅱ型胶原酶消化液20 mL,当组织块消化至半透明状态时用移液管进行吹打,加入完全培养基终止消化,重复消化3次,细胞悬液均过200目铜网,室温1 000 r/min离心5 min,弃上清,细胞沉淀重悬于25T培养瓶中培养。将第3代人脐带间充质干细胞用流式细胞仪进行鉴定。利用外泌小体提取试剂盒提取后,固定、脱水,并于扫描电镜观察其形态,Western blot法检测外泌小体蛋白水平CD63的表达水平,收集细胞培养上清作为阴性对照[6]。
3.2诱导小鼠糖尿病模型 SPF级6~8周龄的雄性C57BL/6小鼠,饲养于首都医科大学附属北京安贞医院实验动物中心独立换气动物饲养系统,自由饮水,12 h光照12 h黑暗,25 ℃、空气湿度35%适应性喂养1周。随机将小鼠分为3组,对照(control,n=10)组、糖尿病(DM,n=15)组和糖尿病+外泌小体(DM+exosome,n=15)组。Control组小鼠普通饲料喂养。DM组与DM+exosome组小鼠高脂饮食连续5周后,小剂量STZ(45 mg/kg)每周腹腔注射1次,连续注射5周;剪鼠尾采用虹吸式血糖试纸,血糖仪实时监测小鼠血糖水平变化,隔1天测1次,连续2周,监测小鼠空腹血糖,3次不同时间血糖值≥16.7 mmol/L为2型糖尿病小鼠模型诱导成功。对照组相同频率注射等量生理盐水。
3.3外泌小体预处理 糖尿病模型造模成功后开始经尾静脉注射外泌小体,将5×106细胞在10 mL无血清培养基培养3 d后,收集培养基,按照1 mL培养基+0.5 mL 外泌小体提取液的比例混合,提取外泌小体,将其溶于100 μL的生理盐水中,作为1只小鼠1次注射用。注射前将control组、DM组和DM+exosome组3 组小鼠用0.1%的戊巴比妥钠(50 mg/kg)腹腔注射麻醉,用75%乙醇消毒鼠尾并在加热板上预热,预热温度37 ℃左右,使其血管舒张,分别给予control组及DM组经尾静脉注射0.1 mL的生理盐水,DM+exosome组注射0.1 mL的外泌体生理盐水混合液,每周1次,连续注射4周。
3.4彩色超声心动图的检测 4周后,同时将3组小鼠心胸前区和腹前区脱毛备皮,1.2%三溴乙醇(240 mg/kg)腹腔注射麻醉小鼠,将鼠四肢固定并连接电极,用高分辨超声仪固定探头行彩色超声心动图检测小鼠心脏功能。每只小鼠选定连续5个心动周期,软件自动分析并统计左心室舒张末期内径(left ventricular end-diastolic dimension,LVIDd)、左心室收缩末期内径(left ventricular end-systolic dimension,LVIDs)、左心室后壁厚度(left ventricular posterior wall thickness,LVPW)、射血分数(ejection fraction,EF)及室壁缩短率(fractional shortening, FS)等检测指标变化。
3.5生化法检测血糖含量 小鼠经外泌小体处理后继续观察1周,每天检测1次血糖,此后将3组小鼠腹主动脉取血,用0.1%的戊巴比妥钠(50 mg/kg)腹腔注射麻醉小鼠,将麻醉后小鼠置于解剖板上,充分伸展四肢并固定,乙醇消毒皮肤,沿腹中线剪开皮肤及腹膜,充分暴露腹腔,轻轻推移肠管并清理脂肪组织,分离腹主动脉和腹主静脉,用1 mL注射器取腹主动脉血于EDTA抗凝的采血管中,3 000 r/min离心15 min,取上清存于1.5 mL离心管中,用于检测血糖和游离脂肪酸水平。
配制试剂工作液,取工作液1 000 μL和蒸馏水10 μL配制空白管;取工作液1 000 μL和校准品10 μL配制校准管;取工作液1 000 μL和样本10 μL配制样本管;充分混匀,37 ℃水浴15 min。显色后在波长505 nm处,以空白调零,读取校准管和样本管的吸光度(A),将吸光度值带入说明书公式:葡萄糖浓度(mmol/L)=样本管吸光度/校准管吸光度×校准液浓度,计算出各个样本的葡萄糖浓度。
3.6生化法检测游离脂肪酸的含量 取双蒸水4 μL和试剂 I 20 μL配制空白管;取标准品4 μL、试剂 I 20 μL配制校准管;取样品4 μL、试剂 I 20 μL配制样本管;混匀,37 ℃孵育5 min,读取吸光度A1,各个管中分别加入试剂 II 50 μL,混匀37 ℃孵育5 min,读取吸光度A2,将吸光度代入说明书公式:游离脂肪酸浓度(mmol/L)=(ΔA样本-ΔA空白)/(ΔA校准品-ΔA空白)×校准品浓度,计算出样本中游离脂肪酸的浓度。
3.7心脏组织病理学检测 HE染色,经腹主动脉取血完毕后,取小鼠心脏组织固定于4%的多聚甲醛24 h,脱水,石蜡包埋,切片厚度4 μm,染色。HE染色:将切好的片子脱蜡,苏木素染色8 min,伊红染色3 min,自来水冲洗,脱水透明,中性树胶封片观察、采集图像。Masson染色,先将样本切片脱蜡水化,后加入丽春红酸性复染液染色40 min,蒸馏水水洗2遍,磷钼酸溶液1 min,冰醋酸溶液30 s,亮绿溶液10 s,蒸馏水洗两遍,入冰醋酸溶液30 s,最后脱水透明,中性树胶封片后观察。并经NIS-Elements BR软件进行图像采集,NIH图形软件计算胶原染色面积在心脏切片面积的百分比。
4 统计学处理
采用GraphPad Prism统计软件对实验数据进行统计分析。数据以均数±标准差(mean±SD)表示,组间比较采用方差分析。以P<0.05为差异有统计学意义。
结 果
1 人脐带间充质干细胞流式细胞学鉴定结果
用于动物模型的第3代人脐带间充质干细胞进行流式学鉴定,标记CD105-PE、CD73-FITC和CD90-FITC表达量分别为(99.50±1.68)%、(99.00±1.25)%和(99.40±1.04)%,为阳性表达,CD45-PE、CD79a-PE、HLA-DR-Cy5.5、CD34-APC、CD11b-APC和CD19-APC表达量分别为(1.8±0.31)%、(1.00±0.20)%、(0.40±0.08)%、(2.10±0.51)%、(1.90±0.21)%和(1.10±0.48)%,为阴性表达,符合间充质干细胞特异性表型,见图1。
2 超声心动检测结果
与control组比较,DM组出现左心室扩张,表现为LVIDd和LVIDs显著扩大,差异具有统计学意义(分别P<0.05和P<0.01);同时,DM组出现左心室收缩功能减低,表现为FS和EF较control组显著降低(P<0.01)。然而,与DM组比较,DM+exosome组左心室扩张程度减轻,LVIDs减小,差异具有统计学意义(P<0.01);同时左心室收缩功能明显改善,FS和EF值显著升高(P<0.01),见图2、表1。
3 血糖检测结果
与control组比较,DM组血糖明显升高,差异具有统计学意义(P<0.01);与DM组比较,DM+exosome组血糖显著下降,差异具有统计学意义(P<0.01),见图3。
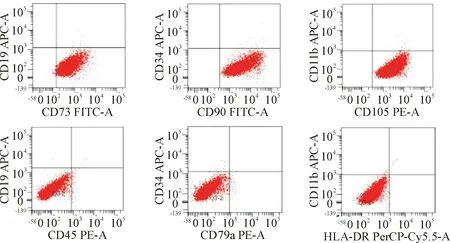
Figure 1. Phenotype of human umbilical mesenchymal stem cells.
图1人脐带间充质干细胞的鉴定
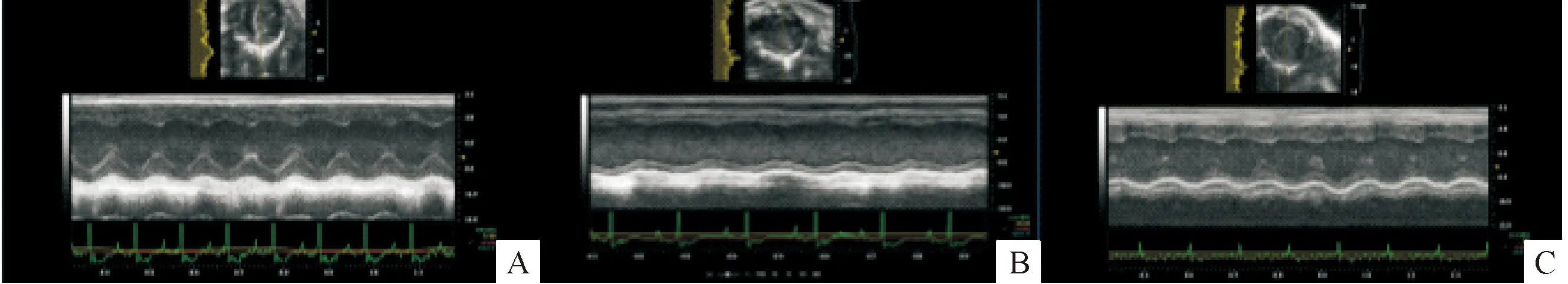
Figure 2. The representative images of echocardiogram changes in different groups. A: control group; B: DM group; C: DM+exosome group.
图2不同组别小鼠超声心动图比较
表1不同组别小鼠超声心动图结果分析
Table 1. Heart function analysis by echocardiography in different groups (Mean±SD.n=5)

IndexControlDMDM+exosomeLVIDd(mm)3.373±0.196 3.800±0.121*3.591±0.208LVIDs(mm)2.135±0.1192.992±0.191**2.471±0.150##LVPW(mm)1.334±0.1570.810±0.089**1.008±0.125##EF(%)67.616±2.97043.900±4.698**59.866±3.236##FS(%)36.672±2.37921.319±2.615**31.183±2.267##
*P<0.05,**P<0.01vscontrol group;##P<0.01vsDM group.
4 游离脂肪酸检测结果
Control组血浆游离脂肪酸水平为(0.46±0.10)mmol/L,DM组的游离脂肪酸水平为(1.25±0.32)mmol/L,较control组显著增高,两组间的差异有统计学意义(P<0.01); DM+exosome组血浆游离脂肪酸水平为(0.48±0.19)mmol/L,较DM组降低,差异有统计学意义(P<0.01),见图4。
5 病理染色观察结果
5.1HE染色 HE染色可见,control组心肌细胞排列整齐;DM组心肌细胞排列紊乱,有心肌细胞的断裂、溶解;DM+exosome组上述心肌损伤程度减轻,见图5。
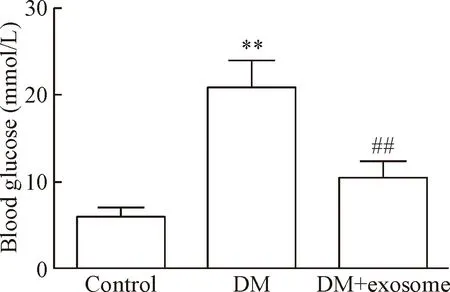
Figure 3. The level of blood glucose in different groups. Mean±SD.n=5.**P<0.01vscontrol group;##P<0.01vsDM group.
图3不同组别小鼠血糖水平的比较
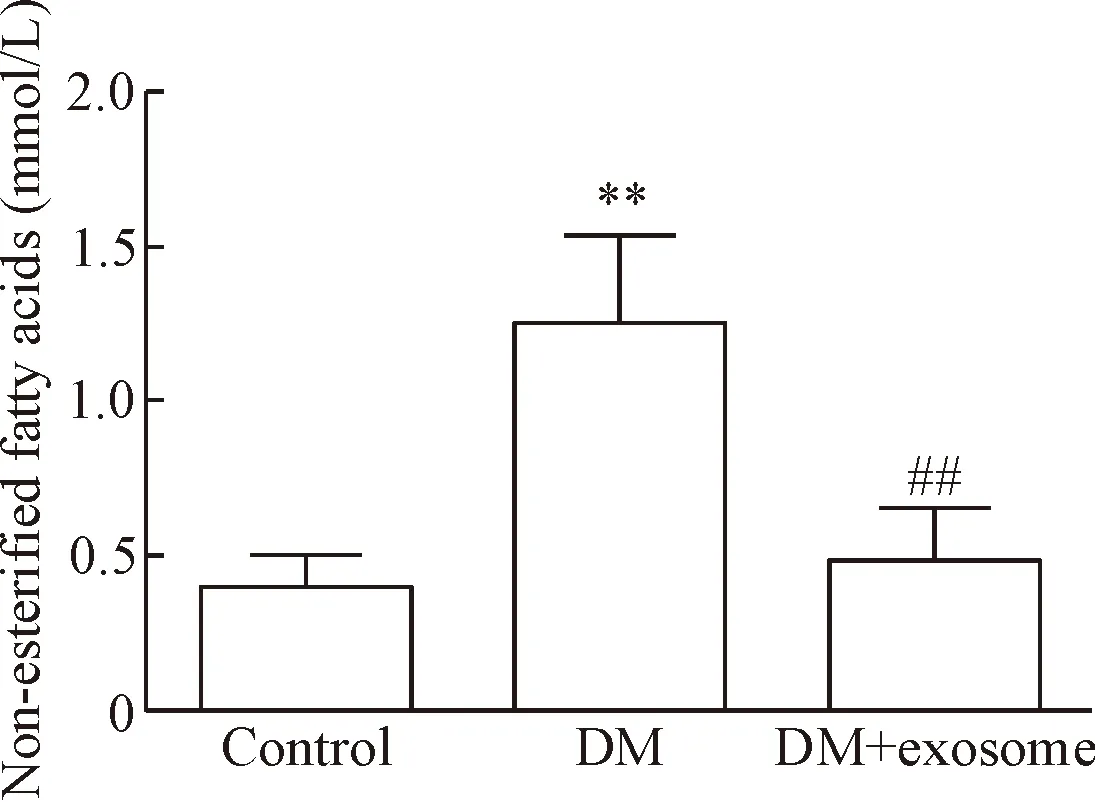
Figure 4. The level of non-esterified fatty acids in blood of different groups. Mean±SD.n=5.**P<0.01vscontrol group;##P<0.01vsDM group.
图4不同组别小鼠游离脂肪酸水平的比较
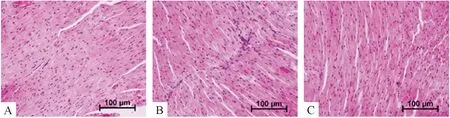
Figure 5. The representative images of myocardial tissue sections with HE staining (×200). A: control group; B: DM group; C: DM+exosome group.
图5HE染色观察不同组别小鼠心脏组织的形态变化
5.2Masson染色 Masson染色结果显示,DM组心肌纤维化程度较control组严重,DM+exosome组纤维化程度较DM组减轻。用NIH图形软件进行胶原面积统计分析结果显示:DM组纤维化面积为(19.0±4.0)%、control组为(7.4±2.5)%、DM+exosome组为(10.1±1.4)%,DM组高于control组(P<0.01),DM+exosome组与DM组比较面积下降(P<0.01),见图6、7。

Figure 6. The representative images of myocardial tissue sections with Masson staining (×200). A: control group; B: DM group; C: DM+exosome group.
图6Masson染色观察不同组别小鼠心肌纤维化程度

Figure 7. The collagen volume fraction in different groups. Mean±SD.n=5.**P<0.01vscontrol group;##P<0.01vsDM group.
图7不同组别小鼠心肌纤维化面积比较
讨 论
目前,糖尿病心肌病的发病机制尚未阐明,药物治疗很难逆转心肌损伤和心肌间质的重塑。研究表明,在2型糖尿病大鼠的动物模型中,经尾静脉注射间充质干细胞不仅能改善糖尿病大鼠的血糖水平,如果在糖尿病的早期注射,还能改善胰岛β细胞功能,提高胰岛素的敏感性,减轻外周组织胰岛素抵抗[7]。移植的间充质干细胞在糖尿病心肌病动物模型中能增加金属蛋白酶2的活性,降低金属蛋白酶9的活性,从而减弱心脏的重塑[8]。过去认为间充质干细胞通过分化为心肌细胞和血管内皮细胞改善心功能,但是近来研究表明,间充质干细胞在心脏损伤修复过程中主要是通过旁分泌或者自分泌一些物质发挥作用[9],尤其是间充质干细胞来源的外泌小体在间充干细胞治疗中发挥的作用备受关注[10]。外泌小体是一种直径在40~100 nm的囊泡结构,内含丰富的蛋白质和RNA等物质,主要参与细胞间的信息传递。间充质干细胞来源的外泌小体无论是在组织器官缺血再灌注损伤还是糖尿病所致的肾脏损伤、肾脏纤维化都发挥了很好的治疗作用[11-12]。有研究者证明,2型糖尿病鼠心肌细胞来源的外泌小体通过转移microRNA-320到血管内皮细胞进而抑制糖尿病心肌病组织中血管的再生,正常心肌细胞来源的外泌小体可促进心脏组织血管的再生,外泌小体作为细胞间信息交流的媒介发挥着重要作用[13-15]。然而间充质干细胞来源的外泌小体对糖尿病心肌纤维化的作用至今报道较少。
本课题组前期实验验证了外泌小体中富含microRNA-22和microRNA-24,在心肌缺氧复氧的条件下能够减少心肌细胞凋亡,保护心肌细胞的作用,而其抗凋亡作用与外泌体富含microRNA-22密切相关。其它研究表明,microRNA-22对缺血再灌注损伤心肌的保护作用是通过下调caveolin 3表达进而恢复eNOS的活性和NO的产生而发挥作用的[16]。MicroRNA-24能调节心肌梗死后心脏的纤维化[17];外泌小体可有效抑制高糖诱导的人脐静脉内皮细胞凋亡,促进细胞增殖、迁移和血管再生作用。本研究结果显示,与对照组比较,糖尿病小鼠的左心室明显扩张,射血分数和室壁缩短率减小,心功能显著降低,经尾静脉注射外泌小体处理后,左心室组织结构有所改善,射血分数等心功能明显改善;与对照组比较,糖尿病小鼠血糖和游离脂肪酸水平升高,经外泌小体处理后血糖和游离脂肪酸水平显著降低,说明外泌小体对于糖尿病小鼠有降糖及降脂的作用;糖尿病小鼠心肌细胞排列紊乱以及心肌纤维化面积增加,经外泌小体处理后心肌细胞排列较整齐,心肌纤维化的面积减少。以上结果说明,间充质干细胞外泌小体对糖尿病心肌纤维化有保护作用。
本研究结果显示,外泌小体具有降低糖尿病鼠的血糖和血脂,改善其心功能以及减轻心肌纤维化程度的作用,为干细胞治疗糖尿病心肌病提供更多有力证据,为糖尿病心血管并发症的治疗提供新的理论依据。为更加深入探讨脐带间充质干细胞源外泌小体中的microRNA-22和microRNA-24在糖尿病心肌纤维化的作用机理,为其治疗机制提供了新的思路。
[1] Rubler S, Dlugash J, Yuceoglu YZ, et al. New type of cardiomyopathy associated with diabetic glomerulosclerosis[J]. Am J Cardiol, 1972, 30(6):595-602.
[2] Isfort M, Stevens SC, Schaffer S, et al. Metabolic dysfunction in diabetic cardiomyopathy[J]. Heart Fail Rev, 2014, 19(1):35-48.
[3] Volarevic V, Arsenijevic N, Lukic ML, et al. Concise review: Mesenchymal stem cell treatment of the complications of diabetes mellitus[J]. Stem Cells, 2011, 29(1):5-10.
[4] Karantalis V, Hare JM. Use of mesenchymal stem cells for therapy of cardiac disease[J]. Circ Res, 2015, 116(8):1413-1430.
[5] Yu B, Zhang X, Li X. Exosomes derived from mesenchymal stem cells[J]. Int J Mol Sci, 2014, 15(3):4142-4157.
[6] 李 佳, 辛 毅, 崔 巍, 等. 人脐带间充质干细胞外泌小体保护缺氧复氧损伤的心肌细胞[J]. 中国病理生理杂志, 2016, 32(4):577-583.
[7] Si Y, Zhao Y, Hao H, et al. Infusion of mesenchymal stem cells ameliorates hyperglycemia in type 2 diabetic rats: identification of a novel role in improving insulin sensitivity[J]. Diabetes, 2012, 61(6):1616-1625.
[8] Cheng Y, Guo S, Liu G, et al. Transplantation of bone marrow-derived endothelial progenitor cells attenuates myocardial interstitial fibrosis and cardiac dysfunction in streptozotocin-induced diabetic rats[J]. Int J Mol Med, 2012, 30(4):870-876.
[9] Lyu L, Wang H, Li B, et al. A critical role of cardiac fibroblast-derived exosomes in activating renin angiotensin system in cardiomyocytes[J]. J Mol Cell Cardiol, 2015, 89(Pt B):268-279.
[10] Ong SG, Wu JC. Exosomes as potential alternatives to stem cell therapy in mediating cardiac regeneration[J]. Circ Res, 2015, 117(1):7-9.
[11] Zhou Y, Xu H, Xu W, et al. Exosomes released by human umbilical cord mesenchymal stem cells protect against cisplatin-induced renal oxidative stress and apoptosisinvivoandinvitro[J]. Stem Cell Res Ther, 2013, 4(2):34.
[12] Jiang ZZ, Liu YM, Niu X, et al. Exosomes secreted by human urine-derived stem cells could prevent kidney complications from type I diabetes in rats[J]. Stem Cell Res Ther, 2016, 7:24.
[13] Vlassov AV, Magdaleno S, Setterquist R, et al. Exosomes: current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials[J]. Biochim Biophys Acta, 2012, 1820(7):940-948.
[14] Wang X, Huang W, Liu G, et al. Cardiomyocytes me-diate anti-angiogenesis in type 2 diabetic rats through the exosomal transfer of miR-320 into endothelial cells[J]. J Mol Cell Cardiol, 2014, 74:139-150.
[15] Kishore R, Khan M. More than tiny sacks: stem cell exosomes as cell-free modality for cardiac repair[J]. Circ Res, 2016, 118(2):330-343.
[16] Chen Z, Qi Y, Gao C. Cardiac myocyte-protective effect of microRNA-22 during ischemia and reperfusion through disrupting the caveolin-3/eNOS signaling[J]. Int J Clin Exp Pathol, 2015, 8(5):4614-4626.
[17] Wang J, Huang W, Xu R, et al. MicroRNA-24 regulates cardiac fibrosis after myocardial infarction[J]. J Cell Mol Med, 2012, 16(9):2150-2160.
