维生素D通过抑制Pin1介导线粒体氧化应激拮抗高糖诱导的人脐静脉内皮细胞凋亡*
2018-01-19林丽明张美金许昌声林金秀
林丽明, 张美金, 许昌声, 林金秀
(1莆田学院附属医院心内科, 福建 莆田 351100; 2福建医科大学第一临床医学院, 3福建省高血压研究所,4福建医科大学附属第一医院心内科, 福建 福州 350000)
以动脉粥样硬化为病理基础的糖尿病(diabetes mellitus,DM)大血管并发症是糖尿病患者的首位死亡原因,而长期高糖(high glucose,HG)暴露导致的血管内皮氧化损伤被认为是其促进动脉粥样硬化发生的起始事件[1]。目前研究认为,高糖状态下血管内皮的活性氧簇(reactive oxygen species,ROS)生成增多主要来源于线粒体和NADPH氧化酶2个途径[2]。前期研究发现,维生素D(vitamin D,VitD)的活性代谢产物骨化三醇能够延缓糖尿病ApoE基因敲除小鼠动脉粥样硬化的进展,并且这一作用与其抑制PKC/NADPH氧化应激途径ROS的生成,进而减轻高糖诱导的血管内皮氧化凋亡有关[3-4]。近期研究发现,高糖能够通过上调脯氨酰异构酶1(prolyl isomerase 1,Pin1)的蛋白表达和活性,催化胞浆内Ser36位点磷酸化的促氧化衔接蛋白p66Shc发生顺反异构,异构化的p66Shc在蛋白磷酸酶2A(protein phosphatase 2A,PP2A)的作用下去磷酸化,进入线粒体(Pin1介导p66Shc线粒体转位),进而氧化细胞色素C,诱导线粒体途径ROS的生成,促进炎症反应,减少NO生成,共同损害血管内皮功能[5]。相反,Pin1抑制剂胡桃醌(juglone)被证实能够改善糖尿病小鼠的血管内皮功能障碍。因此,本研究拟以胡桃醌为阳性对照药物,在细胞水平观察维生素D能否通过激动维生素D受体(vitamin D receptor,VDR),抑制高糖环境下Pin1的表达和活性增加,减少p66Shc线粒体转位和线粒体途径ROS的生成,从而减轻高糖诱导的内皮氧化损伤。
材 料 和 方 法
1 材料
骨化三醇(上海瓦兰生物科技有限公司);M199 培养基,胎牛血清(fetal bovine serum,FBS)、胰蛋白酶、磷酸盐缓冲液和Trizol (Invitrogen);OPTI-MEM(Gibco);RT-PCR试剂盒(TaKaRa);2’,7’-二氯二氢荧光素二乙酸酯(H2-DCFDA)、二氢乙啶(dihydroethidium,DHE)和I 型胶原酶(Sigma);鼠抗人Pin1、p-p66Shc、p66Shc、caspase-3、β-actin及细胞色素C氧化酶亚基4(cytochrome C oxidase subunit 4,COX4)单克隆抗体(TCS);线粒体蛋白提取试剂盒(贝博生物)。
2 方法
2.1人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs) 的培养 参照文献[6]的方法,取新生健康婴儿脐带,采用胶原酶消化法原代培养HUVECs,依据细胞典型的铺路石样生长形态及免疫荧光法检测细胞Ⅷ因子相关抗原鉴定HUVECs,取传3~6代的HUVECs进行实验。
2.2HUVECs分组和干预 用HG(33 mmol/L葡萄糖)刺激内皮细胞,体外模拟糖尿病患者的体内高糖环境,等浓度甘露醇作为阴性对照以排除HG的渗透压效应。将细胞分为对照(control)组(33 mmol/L 甘露醇)、HG组(33 mmol/L葡萄糖)、HG+VitD组(33 mmol/L葡萄糖+10-8~10-6mol/L维生素D)和HG+胡桃醌组(33 mmol/L葡萄糖+10-7mol /L胡桃醌),干预72 h。
2.3TUNEL法测HUVECs的凋亡 按试剂盒说明进行操作。着色棕黄色表示凋亡的细胞核, 镜下随机记数5 个高倍视野(×400)中的凋亡细胞数, 求其均值。
2.4流式细胞术分析细胞凋亡率 去除细胞培养液,PBS 洗1次,0.25%胰酶消化后用含10% FBS的RPMI-1640培养液重悬,1 200 r/min离心6 min后弃上清,PBS 洗1次,用预冷的80%乙醇固定,-20 ℃可放置1月,待标本集齐后离心去除固定液,加PBS 洗2次,100 μL PBS重悬细胞,加RNase 10 μL(5 g/L),37 ℃作用30 min后, 加入20 μL PI染色液(500 mg/L,5 mg PI+0.1 mL Triton X-100+3.7 mg EDTA+10 mL PBS),4 ℃避光染色30 min, 上机前加400 μL PBS,每份样品记数10 000个细胞,计算凋亡细胞的百分比。
2.5流式细胞术检测细胞内ROS的水平 各组细胞干预结束后,于培养液内加入10 μmol /L H2-DCFDA,37 ℃、5% CO2培养箱内培养60 min,吸去培养液,用预温的PBS洗细胞1次,再用0.25% 胰酶-EDTA消化细胞制成细胞悬液。采用525 nm滤光片进行流式细胞术检测各标本的阳性细胞比例和荧光强度。
2.6荧光显微镜观察细胞内ROS的荧光强度 于干预结束后的细胞培养液中加入10 μmol/L DHE,37 ℃、5% CO2培养箱内培养30 min。用预温的PBS 冲洗2~3 次,去除残余的荧光物质,在荧光显微镜下观察细胞内ROS 的荧光强度。
2.7Western blot法检测蛋白表达水平 提取细胞总蛋白、胞浆蛋白和线粒体蛋白(根据线粒体蛋白提取试剂盒说明书操作),煮沸10 min变性,采用12% SDS-PAGE分离50 μg 蛋白样品,转至PVDF膜后用特异的抗Pin1、p-p66Shc、p66Shc、caspase-3、β-actin和COX4单克隆抗体进行Western blot检测,β-actin作为总蛋白内参照,COX4作为线粒体蛋白内参照。
2.8多肽酶解法测定HUVECs内Pin1的活性 细胞生长至60%~70%融合时,弃上清,加1 mL细胞裂解缓冲液(50 mmol/L HEPES,100 mmol/L NaCl,0.25% CHAPS,5 mmol/L NaF,1 mmol/L β-甘油磷酸钠,1 mmol/L EDTA),4 ℃超声仪振荡裂解;配制含93 μL HEPES缓冲液[50 mmol/L HEPES (pH 7.8),100 mmol/L NaCl,2 mmol/L DTT,0.04 g/L BSA]、5 μL细胞裂解液(1×105细胞数或0.25 nmol的Pin1标准品)和 2 μL(20 g/L)胰蛋白酶的混合液;加50 μL H-Trp-Phe-Tyr-Ser (PO3H2)-ProArg-pNA(720 μmol/L,NeoMPS)起始反应,390 nm分光光度仪检测4 min,记录吸光度(A),Pin1活性以各组细胞与空白对照组A值的相对比值表示。
2.9siRNA的设计和转染VDRsiRNA序列:正义链为5’-CAAUCUGGAUCUGAGUGAAdTdT-3’,反义链为5’-UUCACUCAGAUCCAGAUUGdTdT-3’;对照siRNA(scrambled)序列:正义链为5’-UUGUCCGAACGUGUCACGUTT-3’,反义链为5’-ACGUGACACGUUCGGAGAATT-3’。所有siRNA序列均由Sigma公司合成,按转染试剂盒说明书进行转染。
3 统计学处理
所有数据均采用SPSS 13.0统计软件进行分析。计量资料以均数±标准差(mean±SD)表示,多组间的均数比较采用单因素方差分析,组间的两两均数比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 VitD抑制高糖诱导的 HUVECs凋亡
VitD(10-8~10-6mol/L)可抑制高糖条件下HUVECs凋亡;与高糖组相比,当VitD浓度为10-7mol/L, HUVECs凋亡率显著降低(P<0.05);VitD浓度为10-6mol/L与10-7mol/L之间HUVECs凋亡率有显著差异(P<0.05),故选取10-6mol/L为VitD的工作浓度进行后续实验,见图1。
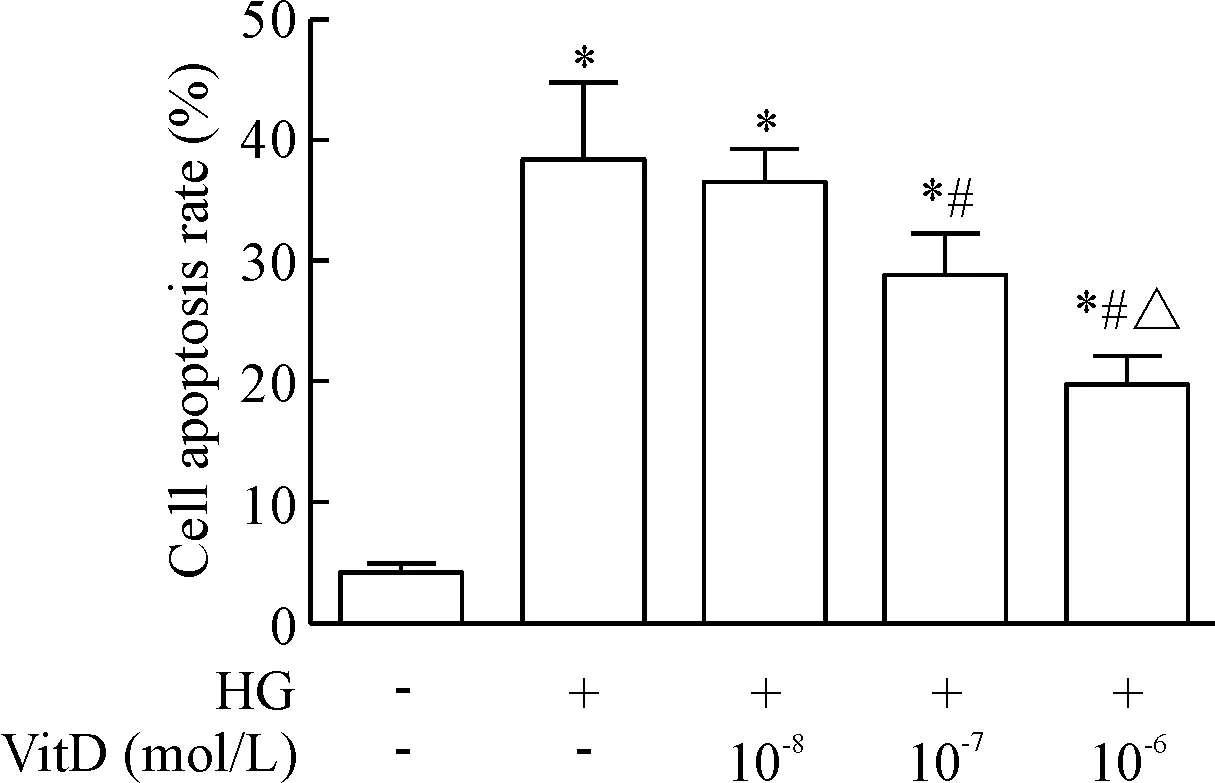
Figure 1. VitD treatment attenuated the apoptosis of HUVECs induced by high glucose. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsHG group;△P<0.05vsHG+VitD (10-7mol/L) group.
图1VitD抑制高糖诱导的HUVECs凋亡
2 VitD对高糖诱导的HUVECs凋亡的影响
TUNEL染色结果显示:control组细胞排列紧密,仅见少量细胞胞核内呈棕黄色;高糖(33 mmol/L)干预72 h后,细胞排列松散,有大量细胞胞核呈棕黄色;VitD(10-6mol/L)和胡桃醌(10-7mol/L)处理组细胞排列均较为紧密,只有少量细胞胞核呈棕黄色,见图2A。流式细胞仪凋亡分析显示,与高糖组比较,VitD(10-6mol/L)和胡桃醌(10-7mol/L)均可显著抑制高糖诱导HUVECs凋亡(P<0.05),见图2B。
3 VitD对高糖培养HUVECs内Pin1蛋白水平及活性的影响
以VitD (10-8~10-6mol/L)预处理45 min加高糖(33 mmol/L)条件下共孵育HUVECs 72 h,结果显示,VitD可抑制高糖(33 mmol/L)条件下HUVECs内Pin1蛋白表达及活性水平增加;与高糖组相比,当VitD浓度达到10-7mol/L时,HUVECs内Pin1蛋白表达及活性水平均显著降低(P<0.05),VitD浓度为10-6mol/L时,Pin1蛋白表达及活性水平进一步降低(P<0.05),见图3。
4 VitD对高糖培养HUVECs促氧化衔接蛋白p66Shc磷酸化水平及其线粒体转位的影响
高糖能诱导HUVECs内促氧化衔接蛋白p66Shc磷酸化,与control组相比,高糖组HUVECs内p66Shc磷酸化水平显著增加(P<0.05);VitD能抑制高糖诱导HUVECs胞内p66Shc磷酸化,与高糖组相比,VitD(10-6mol/L)组HUVECs内p66Shc磷酸化水平显著降低(P<0.05); VitD(10-6mol/L)组HUVECs内p66Shc的磷酸化水平与胡桃醌(10-7mol/L)组相比差异无统计学显著性;各组p66Shc总蛋白水平之间的差异也无统计学显著性,见图4A。此外,高糖还能诱导HUVECs内p66Shc发生线粒体转位,与control组相比,高糖组HUVECs线粒体内p66Shc水平显著增加,胞浆的p66Shc水平显著减少(P<0.05);VitD能抑制高糖诱导HUVECs内p66Shc发生线粒体转位,与高糖组相比,VitD组(10-6mol/L)HUVECs线粒体内p66Shc水平显著降低(P<0.05),胞浆p66Shc水平显著增加(P<0.05);VitD(10-6mol/L)组与胡桃醌(10-7mol/L)组HUVECs中p66Shc线粒体转位水平的差异无统计学显著性,见图4B。
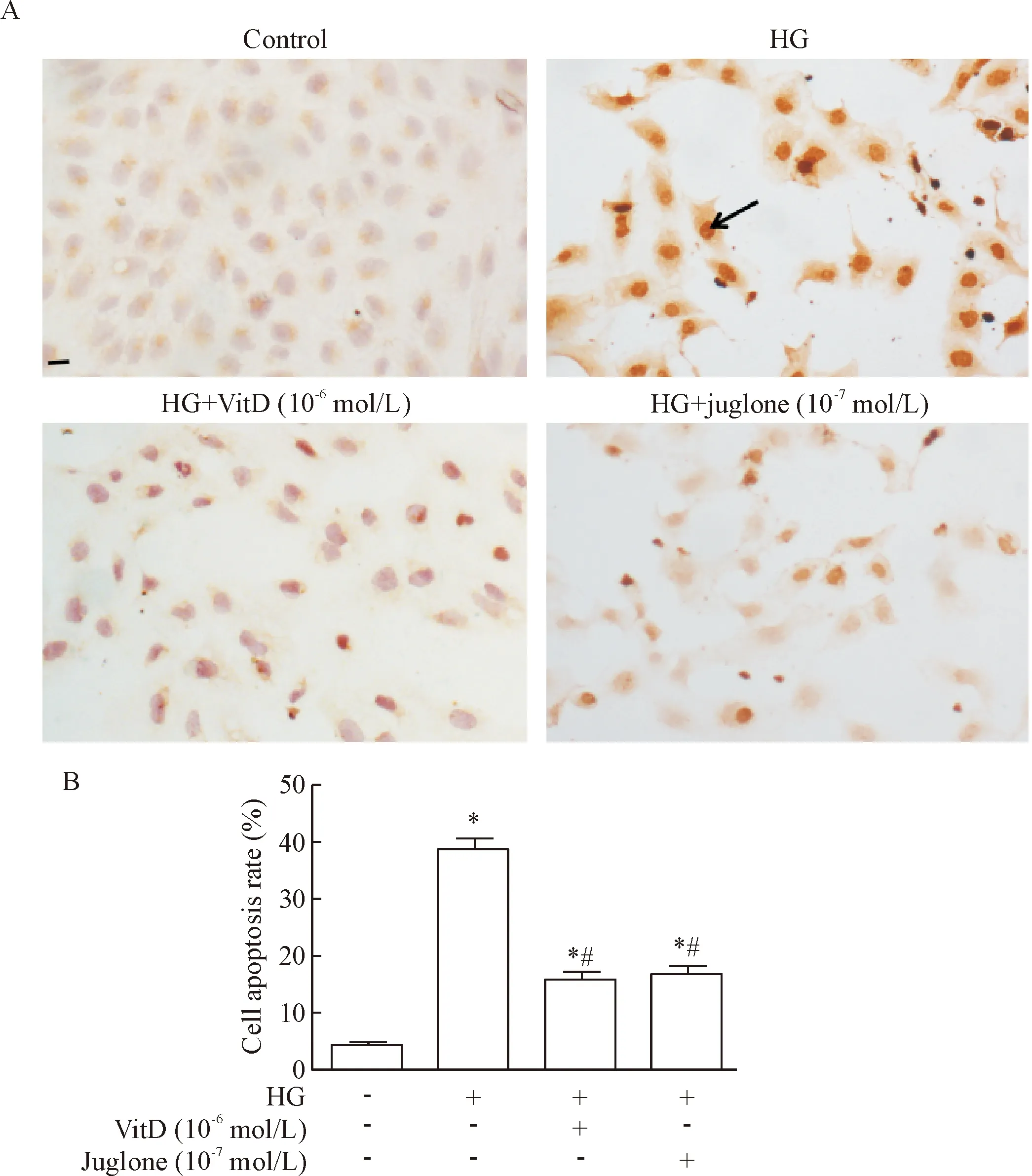
Figure 2. Effect of VitD (10-6mol/L) treatment on the apoptosis of HUVECs induced by high glucose. A: TUNEL staining of HUVECs (×400; arrow indicates TUNEL-positive nucleus); B: the apoptosis of HUVECs measured by flow cytometry. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsHG group.
图2VitD(10-6mol/L)对高糖培养HUVECs凋亡的影响
5 VitD对高糖培养HUVECs中ROS生成的影响
荧光显微镜观察细胞内ROS的荧光强度:高糖条件下HUVECs中ROS产生的红色荧光强度增强,VitD(10-6mol/L)和胡桃醌(10-7mol/L)均可抑制高糖条件下HUVECs中ROS产生的红色荧光强度,见图5A。流式细胞术结果显示:高糖能诱导HUVECs中ROS生成,与control组相比,高糖组HUVECs中ROS生成明显增加(P<0.05);VitD能抑制高糖诱导HUVECs中ROS生成,与高糖组相比,VitD组ROS生成水平显著降低(P<0.05);VitD和胡桃醌组之间ROS生成水平的差异有统计学显著性(P<0.05),见图5B。
6 VitD对高糖培养HUVECs中caspase-3蛋白水平的影响
与control组相比,高糖组HUVECs内caspase-3蛋白水平显著增加(P<0.05);与高糖组相比,VitD组HUVECs内caspase-3蛋白水平显著降低(P<0.05);VitD组和胡桃醌组HUVECs内caspase-3蛋白水平的差异无统计学显著性,见图6。
7 VDR介导VitD对高糖培养HUVECs中Pin1蛋白表达及活性增加的抑制作用
用特异性的VDRsiRNA转染HUVECs之后,发现VitD对高糖诱导HUVECs中Pin1蛋白及活性水平的抑制作用显著减弱(P<0.05),与VitD(10-6mol/L)组相比,VDRsiRNA+HG+VitD(10-6mol/L)组的Pin1蛋白及活性水平均显著升高(P<0.05),而scrambled siRNA+HG+VitD(10-6mol/L)组与HG+VitD(10-6mol/L)组之间Pin1蛋白及活性水平无显著变化,见图7。
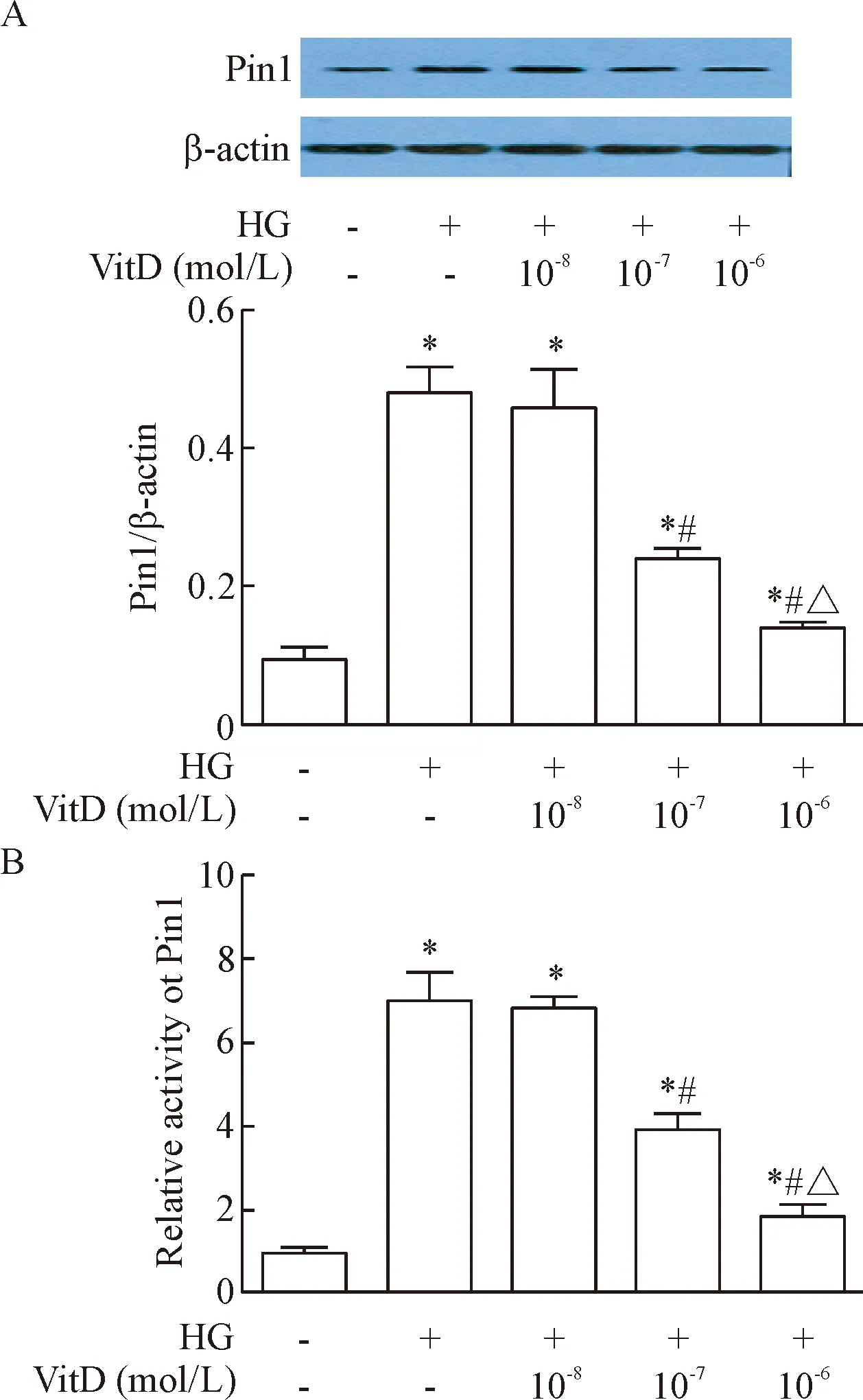
Figure 3. VitD treatment abrogated upregulation of Pin1 expression (A) and activity (B) in HUVECs induced by high glucose. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsHG group;△P<0.05vsHG+VitD (10-7mol/L) group.
图3VitD对高糖培养HUVECs内Pin1蛋白水平和活性的影响
讨 论
内皮功能障碍是动脉粥样硬化形成的起始事件。高糖通过诱导内皮氧化损伤,促进糖尿病大血管并发症发生。高糖环境下内皮ROS生成增多主要有线粒体和NADPH氧化酶2个途径,且以线粒体途径为主。我们前期研究发现,VitD能够部分通过抑制高糖诱导的NADPH氧化酶途径ROS生成,延缓糖尿病性血管病变进展[3-4]。然而,VitD能否抑制线粒体途径ROS生成,目前未见研究报道。本研究在细胞水平证实了VitD可以通过抑制高糖诱导的Pin1表达和活性增加,减少p66Shc介导的线粒体途径ROS生成,减轻内皮细胞氧化损伤,并且这一过程依赖于VDR的激活。

Figure 4. Effects of VitD treatment on phosphorylation (A) and mitochondrial translocation (B) of p66Shc in high glucose-cultured HUVECs. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsHG group.
图4VitD对高糖培养HUVECs中促氧化衔接蛋白p66Shc磷酸化及线粒体转位的影响
前期研究发现,高糖环境下PKCβ被激活,后者使胞浆内p66Shc在Ser36位点磷酸化,进而被Pin1识别并异构化,异构化的p66Shc在PP2A的作用下去磷酸化,进入线粒体(Pin1介导p66Shc线粒体转位),活化的p66Shc转移到线粒体呼吸链酶复合体Ⅲ,氧化细胞色素C产生更多的ROS并诱导细胞经线粒体途径凋亡[7]。后续研究发现,糖尿病小鼠敲除Pin1基因或接受Pin1抑制剂胡桃醌治疗,可以减轻线粒体氧化应激和血管炎症,改善血管内皮功能,提示抑制Pin1蛋白和活性可能是糖尿病血管病变防治新靶点[5, 8]。本研究发现,与胡桃醌相似,VitD能够抑制高糖环境Pin1高表达和活性增加,减少线粒体途径ROS生成和凋亡蛋白caspase-3表达。既往有关VitD与线粒体氧化应激之间的关系研究较少。Sinha等[9]首次提出,VitD可以提高线粒体活性,改善肌肉功能。近期Uberti等[10]研究发现,维生素D预处理能够稳定线粒体膜电位,减少超氧阴离子生成,抑制细胞色素C释放和caspase激活,减轻过氧化氢诱导的HUVECs死亡,然而该研究仍未能阐明VitD保护线粒体功能的机制。因此,本研究在既往研究的基础上,进一步阐明了VitD防治糖尿病血管病变的新机制,并揭示了Pin1蛋白在这一过程的重要作用。
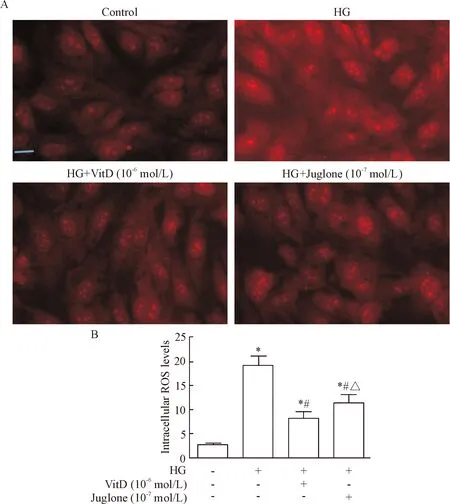
Figure 5. Effect of VitD treatment on intracellular ROS levels in high glucose-cultured HUVECs. A: intracellular ROS levels in HUVECs observed by fluorescence microscopy (×400); B: intracellular ROS levels in HUVECs measured by flow cytometry. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsHG group;△P<0.05vsHG+VitD (10-6mol/L) group.
图5VitD对高糖培养HUVECs内ROS生成的影响
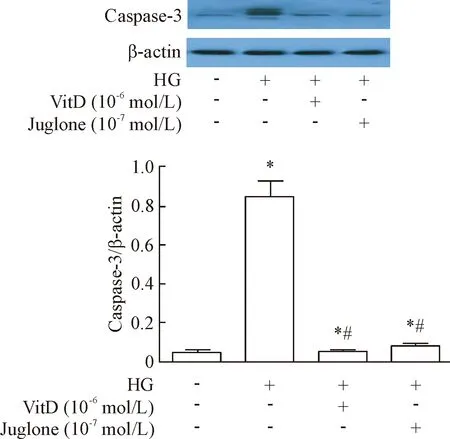
Figure 6. Effect of VitD treatment on caspase-3 protein expression in high glucose-cultured HUVECs. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsHG group.
图6VitD对高糖培养HUVECs中caspase-3蛋白表达的影响
本研究主要存在以下不足之处,首先,本研究未能进一步检测线粒体超氧阴离子、线粒体膜电位以及线粒体DNA损伤等指标,以进一步细化阐明VitD的抗线粒体氧化应激作用;其次,本研究未进一步深入探讨VitD通过何种途径抑制高糖诱导的Pin1蛋白表达和活性增加,进而发挥抗线粒体氧化应激作用;再次,因时间关系,本研究未能进一步验证VitD对糖尿病患者血管功能的影响。因此,未来仍亟待大量的研究工作以进一步阐明VitD与Pin1/p66Shc介导的线粒体氧化应激之间的相互关系以及是否能够改善糖尿病患者的血管功能。
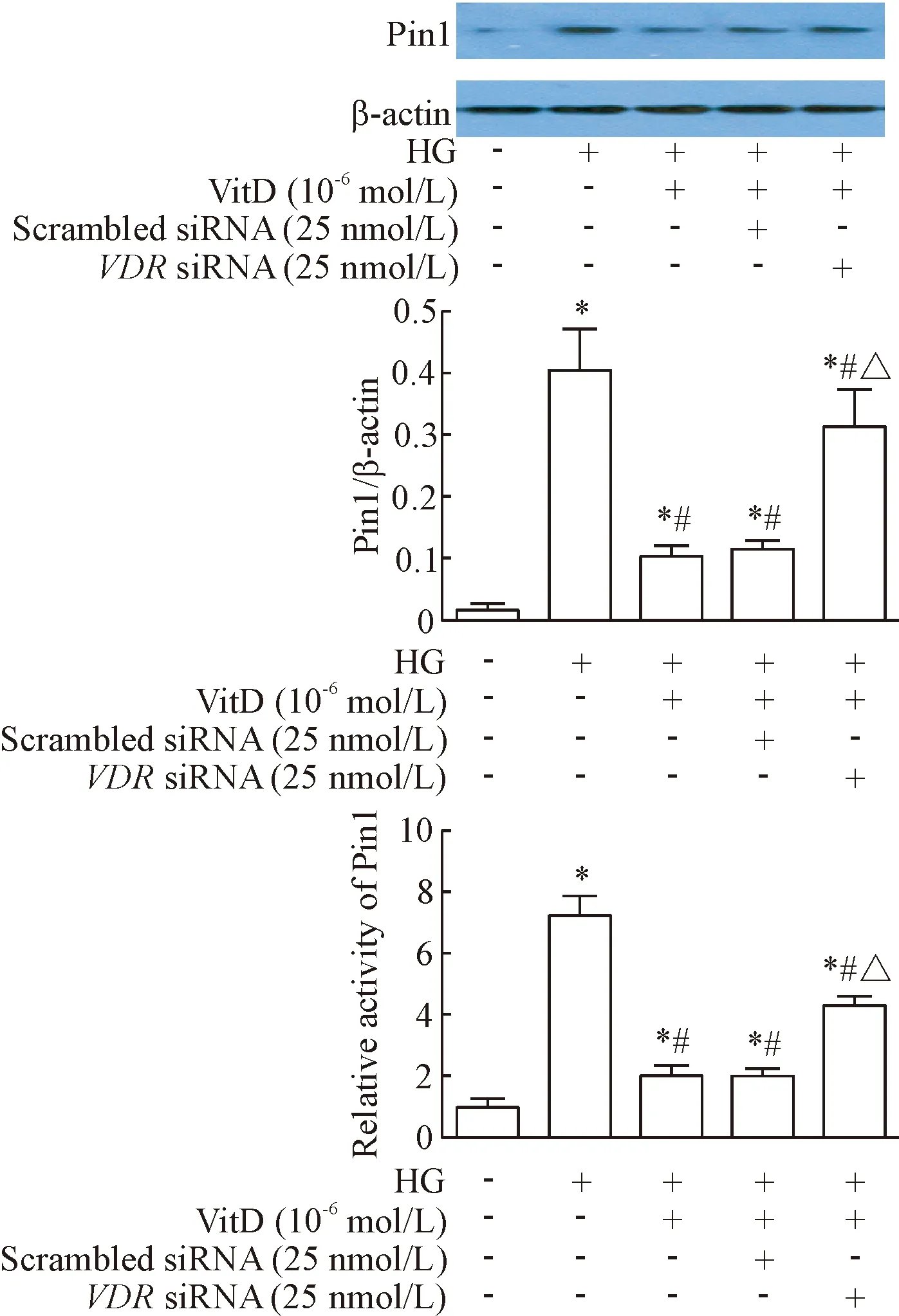
Figure 7. Role of VDR in the inhibitory effects of VitD on high glucose-induced upregulation of Pin1 expression and activity. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsHG group;△P<0.05vsHG+VitD (10-6mol/L)+scrambled siRNA group.
图7VDR对VitD抑制高糖诱导的HUVECs中Pin1蛋白表达及活性增加的影响
综上所述,VitD通过激动VDR受体,抑制高糖环境下Pin1蛋白表达和活性增加,抑制p66Shc线粒体转位,减少ROS生成,从而减轻血管内皮细胞氧化凋亡。我们的研究进一步阐明了维生素D抗氧化效应的机制,为维生素D用于防治糖尿病血管病变提供新的理论依据。
[1] Shen GX. Oxidative stress and diabetic cardiovascular disorders: roles of mitochondria and NADPH oxidase[J]. Can J Physiol Pharmacol, 2010, 88(3):241-248.
[2] Afanas’ev I. Signaling of reactive oxygen and nitrogen species in diabetes mellitus[J]. Oxid Med Cell Longev, 2010, 3(6):361-373.
[3] Lin LM, Peng F, Liu YP, et al. Coadministration of VDR and RXR agonists synergistically alleviates atherosclerosis through inhibition of oxidative stress: aninvivoandinvitrostudy[J]. Atherosclerosis, 2016, 251:273-281.
[4] 刘永萍, 彭 峰, 许昌声, 等. RXR/VDR激动剂对糖尿病ApoE-/-小鼠胸主动脉硬化及NF-κB表达的调控[J]. 中国病理生理杂志, 2014, 30(8):1472-1477.
[5] Francesco P, Sarah C, Lorenzo C, et al. Targeting prolyl-isomerase Pin1 prevents mitochondrial oxidative stress and vascular dysfunction: insights in patients with diabetes[J]. Eur Heart J, 2015, 36(13):817-828.
[6] 柴大军, 宁若冰, 祝 江, 等. 阿托伐他汀通过抑制PKC的激活对抗高糖诱导的人脐静脉内皮细胞氧化应激反应[J]. 中国病理生理杂志, 2012, 28(9):1537-1542.
[7] Magenta A, Greco S, Capogrossi MC, et al. Nitric oxide, oxidative stress, and p66Shc interplay in diabetic endothelial dysfunction[J]. Biomed Res Int, 2014, 2014:193095.
[8] Costantino S, Paneni F, Lüscher TF, et al. Pin1 inhibitor Juglone prevents diabetic vascular dysfunction[J]. Int J Cardiol, 2015, 203:702-707.
[9] Sinha A, Hollingsworth KG, Ball S, et al. Improving the vitamin D status of vitamin D deficient adults is associated with improved mitochondrial oxidative function in skeletal muscle[J]. J Clin Endocrinol Metab, 2013, 98(3):E509-E513.
[10] Uberti F, Lattuada D, Morsanuto V, et al. Vitamin D protects human endothelial cells from oxidative stress through the autophagic and survival pathways[J]. J Clin Endocrinol Metab, 2014, 99(4):1367-1374.
