椒江口海域沉积物微生物群落及其对环境因子的响应
2018-01-12邵君波孟伟杰罗韩燕
黄 备,邵君波,周 斌,孟伟杰,罗韩燕
1.浙江省舟山海洋生态环境监测站,浙江 舟山 316021 2.杭州师范大学,浙江 杭州 311121
在土壤中生活着数量庞大的微生物种群,几乎参与土壤中一切生物和生物化学反应,担负着地球碳、氮、磷、硫等物质循环的调节器、土壤养分的转化器和污染环境的净化器等多方面生态功能,在有机污染物生物地球化学循环中起着十分关键的作用。微生物作为土壤生态环境的重要组成部分容易受到外源污染物影响,土壤微生物群落结构和多样性及其变化在一定程度上反映了土壤的质量[1]。土壤微生物不仅是有机污染修复的重要资源,也具有指示土壤污染的潜力,对土壤微生物的研究十分必要。传统的对土壤微生物的研究,往往受限于微生物的实验室培养方法,据估算,每克土壤最多可能含有10亿个微生物个体,100万种不同的微生物[2]。但是由于现有的技术条件的限制,在众多的微生物中只有不到1%的微生物能够通过培养的方法分离出来。因此,传统的平板培养方法只能作为一种辅助工具,所得结果有很大的局限性,需要结合现代生物技术方法才能更客观而全面地反映微生物群落结构的真实信息。
宏基因组学作为分子生态学发展的典型技术策略,能够从环境样本中直接获得总DNA进行文库构建、测序,在整体水平解析微生物群落结构,尽可能真实地揭示原位环境中微生物群落的复杂性和多样性,在土壤微生物多样性研究中显示出强大的功能[3]。
椒江位于台州地区东部,为浙江省第3条大河,拥有浙江省第三大港——海门港,椒江口两岸是中国经济发展最为迅速的地区之一,医药化工行业、港口海运、船舶修造及水产品加工等多种临海临港工业及滨海旅游业成为椒江口经济发展的重要支撑[4]。河口地区有数个滨海化工园区,现有33家医化企业,占地总面积为1.77 km2,固定资产为34亿元,有1.23万职工,年上缴税收约5亿元。目前,椒江的医化行业作为生产特色原料药及中间体的产业集聚群在全球医化产业链中具有明显的竞争优势,已形成了8大类在国际市场上有影响力和控制力的优势产品,有40多个品种在国际市场上有较高占有率[5]。
研究采用基于Illumina成熟的TruSeq边合成边测序技术的MiSeq高通量测序平台对各点位环境微生物多样性进行了全面深入的调查。并应用SPSS、CANOCO和R语言Vegan程序包等常用群落分析工具,对椒江河口微生物群落与环境因子(特别是典型污染物)之间的潜在联系进行了深入研究。分析椒江口微生物群落的结构和空间差异,发掘其与环境的潜在联系,以期为滨海化工园区的环境评价与环境管理提供技术支撑。
1 实验部分
1.1 样品采集
在椒江化工园区污水入海口附近海域设置了8个海域生态监测点位(C0~C7),如图1所示。2015年4月利用专业海洋调查船“浙海环监”号,用静力式采泥器采集各点位沉积物。取表层(5 cm)泥样于灭菌的10 mL冻存管中,-20 ℃冷冻保存并带回实验室。
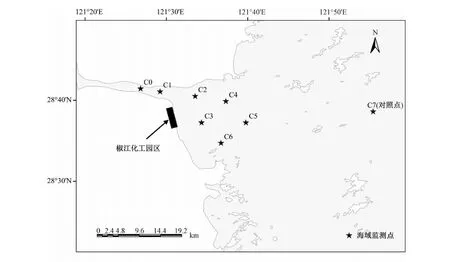
图1 椒江口附近海域采样点位示意图Fig.1 Sampling sites of offshore marine area in Jiaojiang Estuary
1.2 总DNA提取
各点位采用TIANGEN TIANamp Soil DNA Kit试剂盒提取样品总DNA,按标准流程操作,具体步骤为①取750 μL SA缓冲液和0.25 g玻璃珠至2 mL离心管;②在离心管中加入0.5 g沉积物样品,涡旋混匀15 s;③再加入60 μL SC缓冲液,涡旋振荡10 min至样本混匀;④12 000 r/min离心1 min,转移上清液至新的2 mL离心管;⑤加入5 μL Proteinase K溶液,混匀离心,56 ℃孵育10 min;⑥加入250 μL HA缓冲液,涡旋5 s,4 ℃放置5 min;⑦12 000 r/min离心1 min,转移上清液至新的2 mL离心管,加入200 μL HB缓冲液,混匀,4 ℃放置5 min;⑧12 000 r/min离心1 min,转移上清液至新的2 mL离心管,加入1 200 μL GF缓冲液,颠倒混匀;⑨取上述溶液于CB3吸附柱中(吸附柱放入收集管),12 000 r/min离心30 s,弃废液,将吸附柱放回收集管;⑩向吸附柱中加入500 μL PWS漂洗液,12 000 r/min离心30 s,弃废液,将吸附柱放回收集管;向吸附柱中加入500 μL 70%乙醇,12 000 r/min离心30 s,弃废液,将吸附柱放回收集管;12 000 r/min离心2 min,弃废液;将吸附柱置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液,放入新的1.5 mL离心管中,向吸附膜的中央悬空滴加100 μL TE洗脱缓冲液,室温放置5 min;12 000 r/min离心2 min,收集DNA溶液于离心管中,-20 ℃储存待用。
1.3 测序文库构建与测序
测序样品交由某生物科技公司按照16S宏基因组测序标准流程构建环境微生物16S rRNA基因V3-V4可变区(引物序列:341F-CCTACGGGNGGCWGCAG;805R-GACTACH VGGGTATCTAATCC)测序文库并进行相应的质量控制,应用Illumina MiSeq双末端(250 bp×2)测序平台完成序列测定。
1.4 测序数据分析
1.4.1 质量控制
原始测序数据首先应用FASTQC检查测序质量;然后用PRINSEQ及Fastx toolkit进行质量过滤,除去低质量的reads,修剪接头序列,并除去修剪后非常短的读取;然后在FLASH中进行序列融合;最后导入mothur筛查并去除嵌合体序列。
1.4.2 生物信息学分析
通过预处理获得的高质量序列应用mothur按97%序列相似度划分可操作分类单位(OTU),计算α、β多样性指数并绘制稀释曲线,同时比对Silva v123数据库进行分类学分析。
1.4.3 统计分析
对获取的OTU及种类组成数据,结合环境因子,应用SPSS、R语言vegan程序包等软件,分析椒江口微生物群落的结构和空间差异,发掘其与环境的潜在联系。
1.5 海域生态环境监测
椒江化工园区排污口附近海域生态环境监测内容包括水质、底泥微生物和海洋生物。水质调查项目:pH,化学需氧量,无机氮(硝酸盐氮、亚硝酸盐氮、氨氮),活性磷酸盐,石油类,汞,砷,铜,镉,铅,锌,挥发性有机物和半挥发性有机污染物等;海域沉积物调查项目:粒度、石油类、汞、砷、铜、镉、铅、锌、铬、有机碳、总氮、总磷、硫化物、有机氯农药、多氯联苯、多环芳烃。监测采样和分析方法按《海洋监测规范》(GB 17378—2007)和《海洋调查规范》(GB 12763—2007)进行,并全程实施了质量控制。
2 结果与讨论
2.1 海域沉积物微生物群落
2.1.1 序列统计
共获得椒江口海域8个点位沉积物微生物原始序列861 685对(pair-end reads),点位间序列数介于67 653~194 386条之间,序列平均长度为462 bp。所有原始序列均提交至NCBI SRA数据库,收录号为SRP067730。经质量控制和序列优化,筛选出156 367条高质量序列。考虑到各点位测序数据差异较大,进一步随机抽样将数据标准化,以平衡采样误差对后续分析的影响。原始序列通过预处理,按97%序列相似度进行划分,共得到564个OTU,其详细分布见表1。
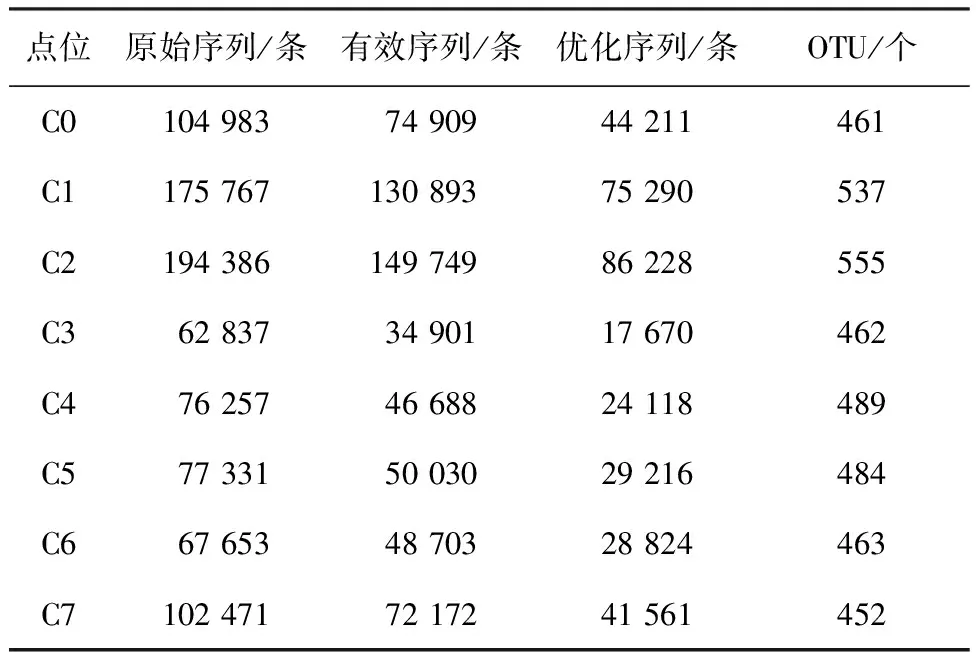
表1 海域沉积物微生物序列信息统计
应用mothur软件对优化序列进行随机抽样,以抽到的序列数与它们所能代表OTU的数目构建稀释曲线,见图2。结果显示,C0、C1、C2 3个河口点位曲线趋向平坦,而剩余点位也接近于拐点,这与原始序列数的分布情况一致,同时也说明各点位取样数量合理,尤其在C1、C2点位,OTU取样已达到饱和。
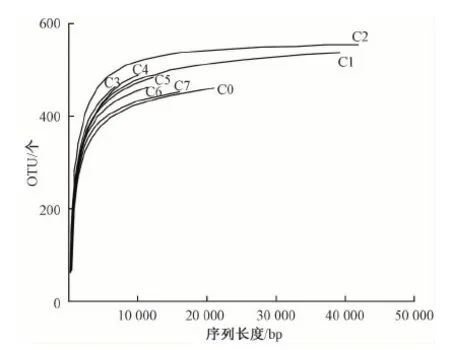
图2 海域沉积物微生物稀释曲线Fig.2 Rarefaction of marine sediment microbes
2.1.2 微生物种类组成
在椒江海域沉积物中鉴定得到古菌和细菌共33门275科396属478种。变形菌门在各点位均表现出明显优势,其序列数占总数的62.1%。其他较为丰富的门类包括绿弯菌门,占6.2%;放线菌门,占5.9%;拟杆菌门,占5.9%。各点位门类组成详见图3。
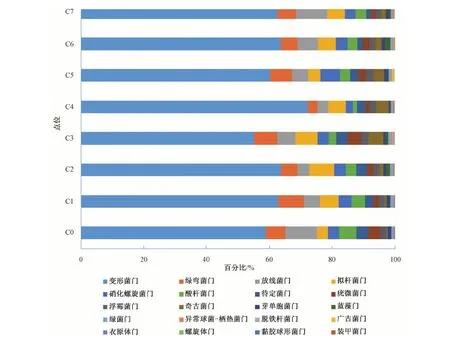
图3 海域沉积物微生物种类组成Fig.3 Species composition of marine sediment microbes
2.1.3 微生物多样性
采用mothur软件,按97%序列相似水平计算菌群丰度指数(Ace、Chao)、菌群多样性指数(Shannon、Simpson),并根据探测深度指数(Coverage)计算结果评估测序深度。结果发现,各点位总体Ace、Chao的均值分别为511、518,点位间差异较小。而反映菌群多样性的Shannon均为5.0左右,Simpson接近于0.02,显示出C0~C7各点位微生物多样性较高,且差异较小。各点位Coverage均超过0.99,说明各样品文库的覆盖率较高,样本中序列没有被测出的概率极低,进一步证实了稀释曲线的结论。
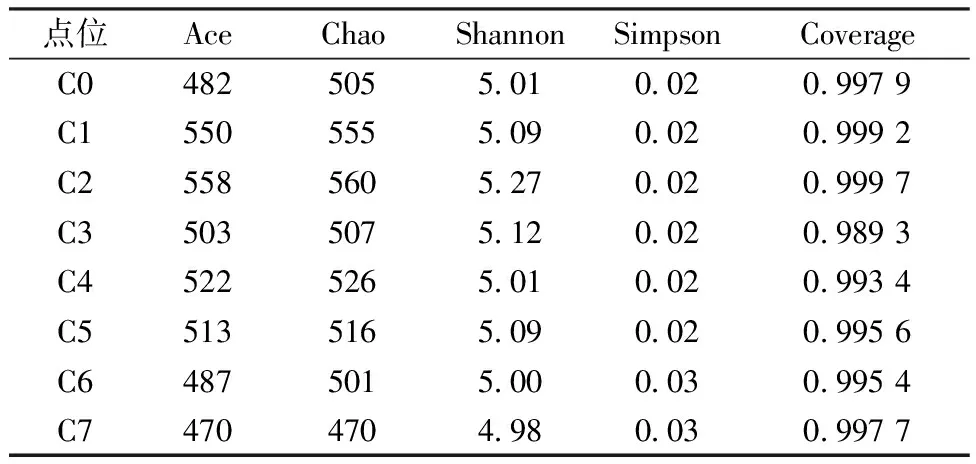
表2 海域沉积物微生物多样性指数
2.2 海域环境因子
按1.5节描述的方法开展研究海域环境调查,其中几项主要因子监测结果如表3所示。
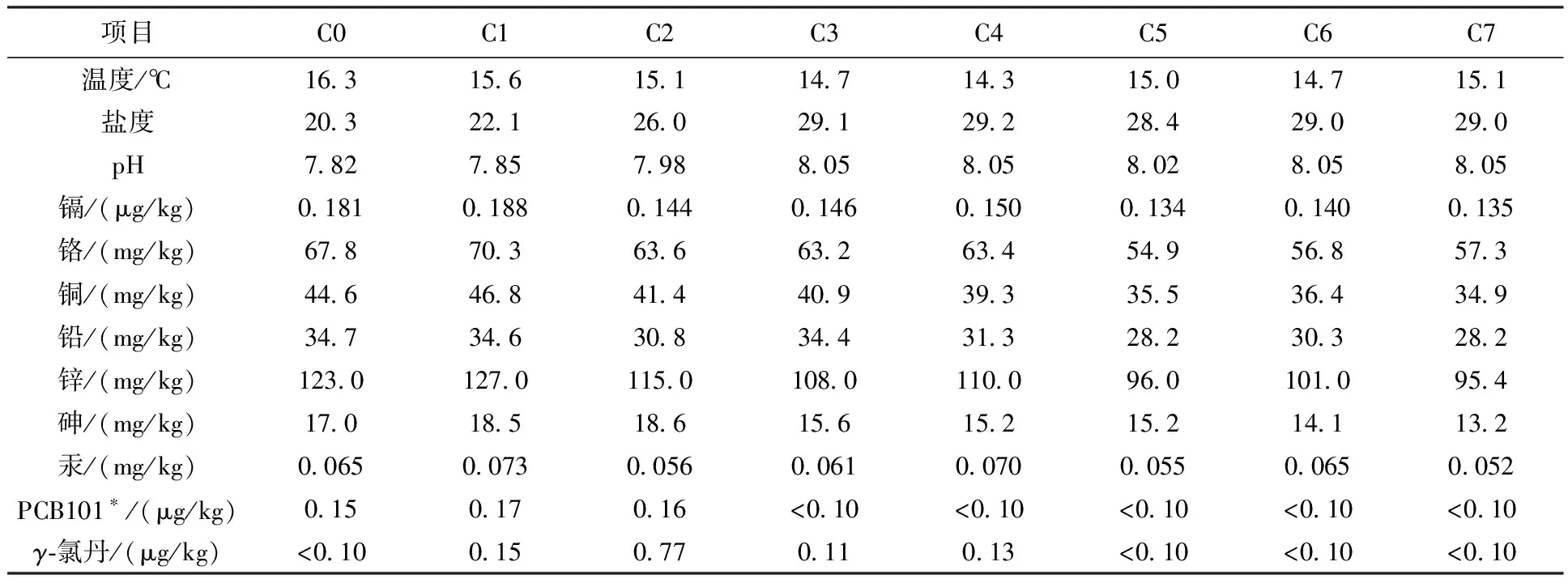
表3 主要环境因子监测结果
注:“*”为五氯联苯(PCB101),是一种常见的多氯联苯(PCBs)。
2.3 对环境因子的响应
应用Canoco软件,首先对微生物群落组成进行降趋对应分析(DCA),计算得海域沉积物微生物群落中最大梯度长度值分别为0.408,因此选择冗余性分析(RDA)进一步开展环境因子与微生物群落的多元统计分析,并采用蒙特卡洛置换检验(9 999次)对排序结果进行统计学检验。
通过微生物门类多样性与环境因子的相关性分析发现,在RDA排序图中,第1轴和第2轴分别解释了总变异的58.1%和18.9%(图4)。蒙特卡洛排序检验表明,PCB101(F=7.36,P=0.01)、盐度(F=3.32,P=0.021)、γ-氯丹(F=2.93,P=0.006)对微生物门水平的群落分布具有显著性影响。
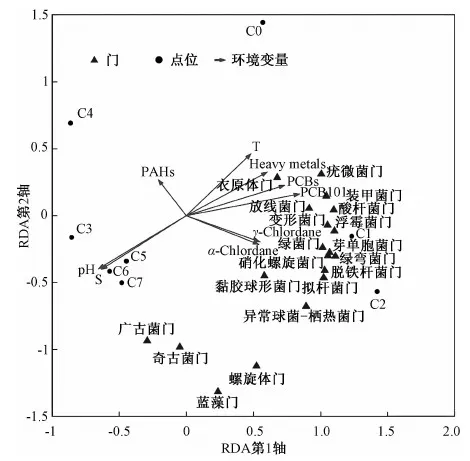
图4 沉积物微生物组成与环境因子RDA排序Fig.4 RDA ordination of marine sediment microbes composition and environmental factors
变形菌门、放线菌门等多个类群在C0、C1、C2 3个近河口点位显示出明显的数量优势,古菌、螺旋体门和蓝藻门则在远离河口(如C5、C6、C7)点位聚集。重金属、多氯联苯、有机氯化合物由河口向外海表现出浓度减少的趋势,证实了陆源污染对该海域生态环境影响的重要性。
通过计算微生物门类组成与环境因子间Spearman相关系数并绘图(图5)可见,温度、盐度、pH与多个微生物门类的组成和分布呈现明显的相关关系,证实河口区域环境特征的独特性及由淡水向海水环境过渡区域沉积物微生物群落与所栖息环境的紧密联系。结果显示,多个待定菌群(如OD1、OP11、TM7、WS6)均与重金属、多环芳烃化合物及滴滴涕浓度呈显著正相关,反映出这些稀有类群微生物对特征污染物的指示意义,也反映了其对典型污染物的潜在降解或吸附能力。
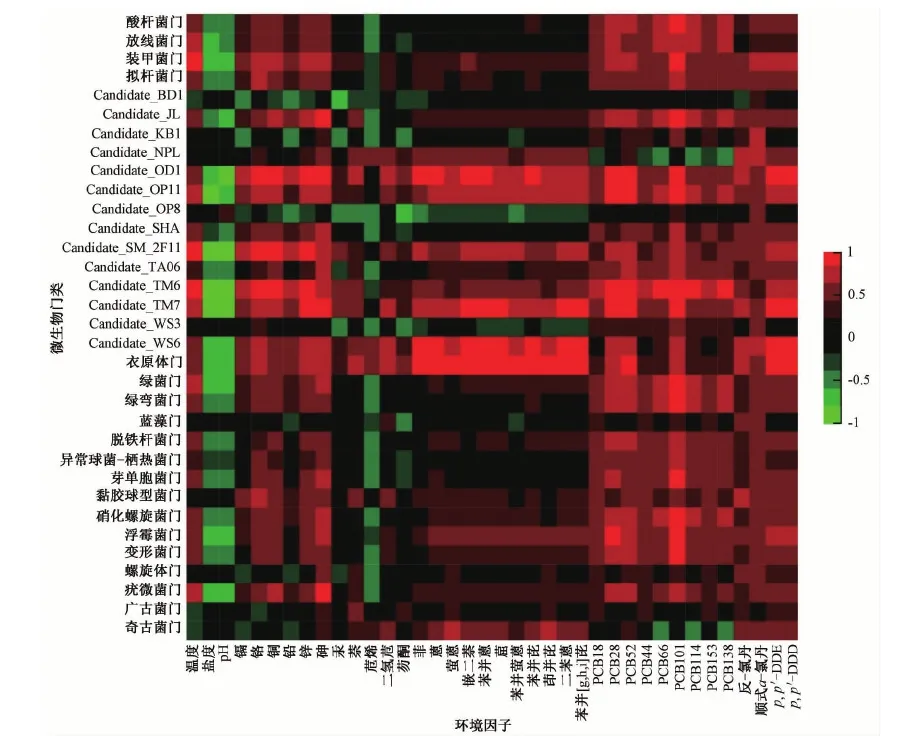
图5 沉积物微生物组成与环境因子Spearman相关系数示意图Fig.5 Spearman correlation of marine sediment microbes′ composition and environmental factors
3 讨论
海洋沉积物是地球上最复杂的微生物栖息地,它是集化学物质和微生物于一体的特殊生态环境,海洋沉积物中蕴藏着丰富的微生物种质和基因资源[6]。作为高压、高盐的特殊生境,沉积物中更可能富集功能特异的微生物类群,有研究表明,海洋微生物种类可能高达1 000万[7]。海洋沉积物细菌群落是海洋生态系统的重要组成部分,在海洋碳、氮、磷、硫等生源要素的矿化和循环中具有关键作用[8]。
众多学者对中国近海沉积物微生物群落进行了研究。孙静等同样利用Illumina MiSeq高通量测序技术对中国黄东海近岸海域沉积物样品原核微生物群落结构及多样性进行研究,共获得74个门类,其中变形菌门、浮霉菌门和泉生古菌门所占比例相对较高,分别占总数的44%、11.2%和9%,变形菌门在37个沉积物样品中均是优势类群[9]。昝帅君应用Illumina MiSeq高通量测序技术在辽河口沉积环境细菌群落的研究中,共发现30个群落类群,其中最大的优势群落为变形菌门,占总群落的60%左右;其次为蓝藻门,占总群落20%左右;放线菌门占比为10%左右,其他群落占比约为10%[10]。同样,方蕾等[11]在辽宁盘锦双台口滨海湿地沉积物的细菌多样性研究中,鉴定出24门,其中最大的优势群落为变形菌门,占总群落的43%。宋志刚等、刘欣等、张健等[12-14]分别利用PRC-DGGE等技术对中国近岸海域进行了表层沉积物多样性研究,结果表明变形菌门在黄海、东海及胶州湾海域沉积物样品中均是最大的优势类群。本研究结果与上述研究有相似之处,变形菌门在各点位均表现出明显优势,其序列数占总数的62.1%。但本研究发现的微生物门类数为33个,小于黄东海的调查结果,门类数及变形菌门所占比例与辽河口的调查结果非常接近,这是由于2个海域自然环境比较接近。但除了变形菌门这个最大的优势群落外,其他主要类群在各研究中均不尽相同,显现出中国沿海沉积物微生物群落丰富的多样性。
PCB101是一种常见的PCBs组分,在环境中检出率高、含量高且较难降解,是公认的一类最复杂的内分泌干扰物[15]。椒江工业园区是浙江省经济建设的重要区域,研究证实PCBs各组分含量长期居高不下,有机污染问题不容忽视[16-17]。该次监测结果显示,PCB101在C0、C1、C2 3个河口点位均有检出,平均浓度占总PCBs含量的13.7%。γ-氯丹是一种有机氯杀虫剂,为深琥珀色黏性液体,常用于杀灭地下害虫(如蝼蛄、地老虎、稻草害虫等),对防治白蚁效果显著。由于河流的迁移运输,椒江河口海域常出现有机氯农药的高值区[18]。该次监测结果显示,γ-氯丹在C1~C4点位均有检出,平均浓度占总有机氯含量的20.2%,仅次于p,p’-DDE(39.6%)和p,p’-DDD(38.2%),且各点位间差异显著,C2点位达到最高值0.77 mg/kg,其余3个点位均在0.10 mg/kg左右。持续性的陆源有机氯输入对河口生态环境造成直接影响,虽然中国已陆续禁用部分有机氯农药,但在沿海海域有机氯农药经常性地被检测出,因此开展沉积物环境残留有机氯化合物的微生物降解及其生态影响研究仍具有重要意义。国内很多学者对持久性有机污染物的海洋微生物降解进行了深入研究[19],但有关海洋微生物群落对污染物浓度的响应还未见报道,本研究揭示了PCB101、γ-氯丹等对微生物门类分布有显著影响。
河口的环境特征异常复杂,那些在淡水与海水中具有显著差别的环境因子很有可能使其他一些因素对微生物群落变化的影响变得更为模糊。研究在海域沉积物各点位观察到明显的自河口内侧向外海的盐度梯度。盐度是近岸海域解释生物群落变化最重要的环境因子。有研究证实,椒江河口变形菌门和放线菌门的不同类群受盐度支配分别占据淡水和海水区域,氨氧化菌的分布也受到盐度的显著影响[20]。昝帅君的研究揭示,辽河口沉积环境细菌群落多样性随盐度递减。本研究表明,盐度和pH与多个微生物门类的组成和分布呈现明显的负相关,但由于河口环境复杂多变,要厘清自然环境因子与典型有机污染物对微生物组成和分布的各自影响和特征,需要继续开展分析研究。
4 结论
1)应用Illumina MiSeq宏基因组高通量测序技术,在椒江口海域沉积物中鉴定得到古菌和细菌共33门类,变形菌门为明显的优势门类,其序列数占总数的62.1%。其他较为丰富的门类包括绿弯菌门、放线菌门、拟杆菌门。
2)椒江口海域菌群丰度指数Ace和Chao的均值分别为511、518,点位间差异较小。Shannon菌群多样性指数均在5.0左右,Simpson指数接近于0.02,显示出8个点位微生物多样性较高,且差异较小。
3)通过微生物门类多样性与环境因子的相关性分析发现,PCB101、盐度、γ-氯丹对微生物门水平的群落分布具有显著性影响。计算微生物门类组成与环境因子间Spearman相关系数并绘图分析,温度、盐度、pH与多个微生物门类的组成和分布呈现明显的相关关系。
[1] 陈承利,廖敏,曾路生.污染土壤微生物群落结构多样性及功能多样性测定方法[J].生态学报,2006,26(10):3 404-3 412.
CHEN Chengli,LIAO Min,ZENG Lusheng.Methods to measure the microbial community structure and functional diversity in polluted soils[J].Acta Ecologica Sinica,2006,26(10):3 404-3 412.
[2] GANS J,WOLINSKY M,DUNBAR J.Computational improvements reveal great bacterial diversity and high metal toxicity in soil[J].Science,2005,309(5 739):1 378-1 390.
[3] 隋心,张荣涛,钟海秀,等.利用高通量测序对三江原小叶章湿地土壤细菌多样性的研究[J].土壤,2015,47(5):919-925.
SUI Xin,ZHANG Rongtao,ZHONG Haixiu,et al.Study on bacterial diversity of deyeuxia angustifolia wetland by application of high-throughput sequencing technology in Sanjiang Plain[J].Soils,2015,47(5):919-925.
[4] 黄备,邵君波,周斌,等.椒江口围填海工程对浮游动物的影响[J].生态科学,2015,34(4):86-92.
HUANG Bei,SHAO Junbo,ZHOU Bin,et al.The effect of reclamation on zooplankton in Jiaojiang Estuary[J].Ecological Science,2015,34(4):86-92.
[5] 徐颖.台州沿海县市区产业及空间发展研究[D].杭州:浙江大学,2006.
[6] 秦松,丁宁.专家论海洋生物基因资源的研究与利用[J].生物学杂志,2006,23(1):1-4.
QIN Song,DING Ning.Strategies for study and utilization of gene resources of marine organisms[J].Journal of Biology,2006,23(1):1-4.
[7] SOGIN M L,MORRISON H G,HUBER J A.Microbial diversity in the deep sea and the underexplored rare biosphere[J].Proceedings of the National Academy of Sciences,2006,103(32):12 115-12 120.
[8] KINGHORN A D,CHIN Y W,SWANSON S M.Discovery of natural product anticancer agents from biodiverse organisms[J].Current Opinion in Drug Discovery & Development,2009,12(2):189-196.
[9] 孙静.黄东海细菌多样性分析及其抗菌活性的初步评价[D].天津:天津商业大学,2014.
[10] 昝帅君.辽河口海水及沉积环境细菌丰度时空变化与群落结构浅析[D].大连:大连海洋大学,2015.
[11] 方蕾,陶韦,石振家,等.用宏基因组学手段研究滨海湿地沉积物的细菌多样性[C]∥全球变化下的海洋与湖沼生态安全学术交流会论文摘要集.南京:2014.
[12] 宋志刚,许强芝,鲁心安,等.中国东海海洋微生物种群多样性初步研究[J].微生物通报,2006,33(1):63-67.
SONG Zhigang,XU Qiangzhi,LU Xinan,et al.A primary study on population biodiversity of marine microorganisms from East China Sea[J].Microbiology,2006,33(1):63-67.
[13] 刘欣,肖天,张文燕,等.胶州湾海域表层沉积物细菌多样性[J].海洋科学,2010,34(10):1-6.
LIU Xin,XIAO Tian,ZHANG Wenyan,et al.Diversity of bacterial community in sediments of Jiao-zhou Bay[J].Marine Sciences,2010,34(10):1-6.
[14] 张健,赵阳国,李海艳,等.黄海西北近岸沉积物中细菌群落空间分布特征[J].海洋学报,2010,32(2):118-127.
ZHANG Jian,ZHAO Yangguo,LI Haiyan,et al.Temporal and spatial distribution characterization of bacterial community in sediments from the inshore of the northwest Huanghai Sea[J].Acta Oceanologica Sinica,2010,32(2):118-127.
[15] 江萍,赵平,万洪富,等.珠江三角洲典型地区表层农田土壤中多氯联苯残留状况[J].土壤,2011,43(6):948-953.
JIANG Ping,ZHAO Ping,WAN Hongfu,et al.Concentrations of PCBs in agricultural soils of typical regions in Pearl River Delta[J].Soils,2011,43(6):948-953.
[16] 江锦花,朱利中,张明.椒江口水体和生物体中典型有机污染物的浓度水平及来源初探[J].环境化学,2006,25(5):546-549.
JIANG Jinhua,ZHU Lizhong,ZHANG Ming.Concentration and sources of typical organic contaminants in seawater,sediment and organismsin in Jiao Jiang Bay[J].Environmental Chemistry,2006,25(5):546-549.
[17] 邹伟明,张庆红,王晓华,等.椒江口表层沉积物中重金属及多氯联苯研究[J].环境科学与技术,2014,37(增刊2):157-160.
ZOU Weiming,ZHANG Qinghong,WANG Xiaohua,et al.Research of heavy metals and polychlorinated biphenyls in the surface sediments of Jiaojiang estuary[J].Environmental Science & Technology,2014,37(S2):157-160.
[18] 蒋然,王健鑫,黄备,等.椒江口沉积物中细菌多样性初步研究[J].海洋与湖沼,2015,46(4):887-900.
JIANG Ran,WANG Jianxin,HUANG Bei,et al.Bacterial diversity insediments in JiaoJiang River estuary[J].Oceanologiaet Limnologia Sinica,2015,46(4):887-900.
[19] 张荣秋,董纯明,盛华芳,等.白令海和楚科奇海表层沉积物中多环芳烃降解微生物多样性[J].海洋学报,2014,36(4):52-61.
ZHANG Rongqiu,DONG Chungming,SHENG Huafang,et al.Biodiversity of polycyclic aromatic hydro-carbondegrading bacteria from surficial sediments of the Bering Sea and Chukchi Sea in the Arctic[J].Acta Oceanologica Sinica,2014,36(4):52-61.
[20] ATREYEE S,SHASHIKANTH G,HU Z Q.Seasonal population changes of ammonia-oxidizing organisms and their relationship to water quality in a constructed wetland[J].Ecological Engineering,2012,40(3):100-107.
