萼脊兰AGAMOUS(AG)基因的克隆与表达分析
2018-01-10蒋素华邓祖丽颖郝平安王默霏袁秀云
蒋素华, 邓祖丽颖, 郝平安, 王默霏, 袁秀云, 崔 波
(1.郑州师范学院生物工程研究所, 河南 郑州 450044; 2.郑州幼儿师范高等专科学校,河南 郑州 450000; 3.河南农业大学生命科学学院, 河南 郑州 450000)
萼脊兰AGAMOUS(AG)基因的克隆与表达分析
蒋素华1, 邓祖丽颖2, 郝平安3, 王默霏1, 袁秀云1, 崔 波1
(1.郑州师范学院生物工程研究所, 河南 郑州 450044; 2.郑州幼儿师范高等专科学校,河南 郑州 450000; 3.河南农业大学生命科学学院, 河南 郑州 450000)
通过对萼脊兰AGAMOUS(AG)基因进行结构、功能分析、克隆和AG基因的表达调控等方面的探究,发现,萼脊兰AG的氨基酸序列属于植物特有的MIKC型MADS-box的C类基因,该基因cDNA全长1 002 bp,包含一个702 bp的开放阅读框,该基因命名为AG(登录号KY744276),共编码233个氨基酸。蛋白序列比对和进化树分析表明,AG蛋白与蝴蝶兰蛋白一致性最高,进化距离最近。二级结构分析表明,该蛋白分子属于亲水性蛋白,其中α螺旋占48.93%,延伸链占11.59%,不规则卷曲占39.48%。实时荧光定量PCR(qRT-PCR)分析表明,AG基因在花蕾和蕊柱中表达量很高,说明AG基因的表达具有组织特异性,在ABCDE模型中属于C类基因的特征非常明显,控制着雄蕊和雌蕊的发育。
萼脊兰;AG基因克隆;RACE技术;实时荧光定量PCR;表达分析
花器官是植物营养生长到生殖生长转变过程中的重要功能器官,花器官发育遗传机制的研究可以促进人们对被子植物花结构的了解[1-2]。近年来,随着分子生物学和细胞生物学等学科的发展,对花卉的基因以及育种的研究更加深入[3-5]。兰科植物高度特化的花器官结构,也使其成为研究花器官发育调控机制的理想材料[6-8]。兰科植物相关基因特别是开花相关基因及其表达也成为当今研究的热点,但对萼脊兰开花相关基因的研究却是刚刚起步[9]。在经典的植物花发育的模型中最著名的是“ABCD”模型,1990年,YANOFSKY等[10]在拟南芥中首次克隆了花同源异型基因AGAMOUS(AG),使AG基因成为最早被克隆的花的发育调控基因,针对拟南芥花发育调控基因的正向遗传学研究,初步建立了简单的花发育调控网络模型。高志红等[11]以拟南芥为试验材料对AG基因的结构、功能以及同源基因的分离和AG基因的表达调控等方面进行了系统阐述。AG基因作为重要的MADS基因之一,近年来对该基因的研究也更加深入。到目前为止,已从多种植物中分离克隆了AG同源基因全长cDNA[12]。AG基因是植物花发育模型中的C类基因,在调控植物花器官分化和发育中具有重要功能[13],由于AG基因与植物的花器官特别是心皮、胚珠以及果实的发育密切相关,因此对于种子植物的育种有着潜在的应用前景。在其他物种上AG基因同源基因研究多数是简单的验证拟南芥AG基因的功能,新的发现很少,要深入地了解AG基因的功能和物种之间的进化关系,需要更多的AG同源基因的数据。尽管在国际上开花调节基因AG是开花分子生物学的研究热点,但中国这方面的研究报道较少[11]。因此,从萼脊兰中克隆AG基因,阐明其在分子水平对萼脊兰雌、雄蕊发育的调控机制,并从基因结构和蛋白的理化特性探讨基因功能,为进一步研究萼脊兰的生殖生长提供重要的理论依据。本研究以萼脊兰为试验材料,通过RT-PCR及RACE技术获得AG基因的全长序列,对其进行生物信息学分析,并对萼脊兰AG基因的时空表达进行分析,为进一步研究AG基因在花分化与发育过程中的重要作用打下坚实基础。
1 材料与方法
1.1 试验材料
材料为萼脊兰,采自郑州师范学院兰花工程研究中心,分别选取萼脊兰苗期的根、叶;花蕾期的根、叶、花葶、花蕾;盛花期的根、叶、花葶、花瓣、萼片、蕊柱。
1.2 试剂和仪器
试剂:RNAprep pure植物总RNA提取试剂盒(宝生物工程有限公司),SYBR®Premix ExTaqTMII(宝生物工程有限公司),M-MLV反转录试剂盒(宝生物工程有限公司);仪器:琼脂糖凝胶电泳仪(P25T, 德国Biometra),实时荧光定量PCR仪(realplex2, 德国Eppendorf),微量紫外分光光度计(Q5000,美国Quawell)。
1.3 萼脊兰总RNA的提取及cDNA第一链的合成
利用RNAprep pure试剂盒提取萼脊兰不同时期不同组织总RNA,各取1.0 μL RNA样品,通过1.0%的琼脂糖凝胶上电泳检测其完整性,利用Quawell Q5000微量紫外分光光度计检测RNA浓度和质量,以萼脊兰花瓣总RNA为模板,用M-MLV反转录酶合成第一链。
1.4 萼脊兰AG基因克隆及生物信息学分析
根据GenBank中已登陆兰科植物建兰 (JN613149.1) 、文心兰(KJ819939.1)、球花石斛(DQ017702.1)、姬蝴蝶兰(AF234617.1)等的AG基因保守序列设计一对引物用于萼脊兰AG基因保守序列的扩增,上游引物AG-F:CACAACAAAYAGRCAAGTCAC和下游引物AG-R: CTGGAATCAAAYGGAGGCATM,然后以萼脊兰花瓣总RNA反转录的cDNA为模板进行PCR扩增,切胶回收,再进行TA克隆,测序分析。以AG基因保守序列为模板,设计3’RACE和5’RACE引物,进行AG基因的RACE全长克隆。3’RACE引物序列:AG-F88: GGTTGCCCTAATCATCTTCTCTAC,AG-F220:TTCGCAGTATTACCAACAAGAG;5’RACE引物序列AGR114: CGGGTTGAGAAGATGATAAGGGCA,AGR158: TGGTTCCCTTCACGCTGTTGTTTG ,将克隆到的AG基因的核苷酸序列进行拼接,然后根据拼接的AG全长基因进行ORF的扩增,来验证AG基因的正确性。AG基因的ORF克隆引物序列:AGORF-F2:ATGATGGAGAGCAAGGAAAAGA,AGORF-R2: ACCCAAGTTGCAGAGCTGTC,最后将正确的萼脊兰AG基因与其他AG同源基因在NCBI(http://blast.ncbi.nlm.nih.gov/)上进行blast搜索,并进行同源性比对分析;在NCBI的蛋白保守区数据库中搜索保守结构域及功能域;用ProtScale软件预测亲疏水性;运用ExPASy网站上的GOR进行蛋白质二级结构预测;利用MEGA4.0软件对其进行进化系统分析。
1.5 AG基因时空表达分析
根据AG基因序列设计出特异性较强的qRT-PCR引物,参照SYBR®Premix ExTaqTMII使用说明,用qRT-PCR的方法检测AG基因在萼脊兰不同发育阶段不同部位的表达量,EF1a作为内参基因,计算该基因的相对表达量。目的基因AG和内参基因EF1a的退火温度均为60 ℃,每个样品3重复,蒸馏水为阴性对照,反应体系20 μL,反应程序:95℃预变性30 s,95℃变性15 s,60℃退火15 s,72℃延伸30 s,共40个循环,PCR结果按照相对表达量Rel. Exp=2-ΔΔCt计算,式中:ΔCt=Ct(AG)-Ct(EF1aRNA),ΔΔCt=(各植物组织ΔCt)-(花萼ΔCt)。qRT-PCR引物及参数见表1。

表1 qRT-PCR反应的引物参数Table 1 Primers Parameters for real time PCR
2 结果分析
2.1 AG基因全长cDNA克隆
以萼脊兰花瓣cDNA为模板,利用设计的简并引物AG-F和AG-R进行AG保守区基因片段的PCR扩增,扩增出一条长度约为600 bp的片段,该片段大小与预期目的条带一致,测序结果得到567 bp的特异保守片段。采用RACE技术,利用3’端引物AG-F88和AG-F220扩增出3’端目的片段661 bp,用5’端引物AGR114和AGR158扩增出5’端目的片段303 bp。将保守域片段、3’端目的片段和5’端目的片段序列拼接,最终获得大小为1 002 bp的AG全长cDNA序列,在开放阅读框(ORF)区域设计引物,进行目的片段的扩增,得到了预期的片段702 bp,经过与AG全长基因进行对比,结果显示AG基因克隆正确(图1)。将其核苷酸序列在NCBI上Blast分析,发现与蝴蝶兰(DQ534013)的AG基因有较高一致性,为96%,将该基因命名为AG,提交GenBank,登录号为KY744276。经NCBI在线工具ORF Finder软件查找,该基因具有 702 bp的完整开放阅读框,5’端非编码区为66 bp,3’端非编码区为234 bp,编码233个氨基酸(图2)。
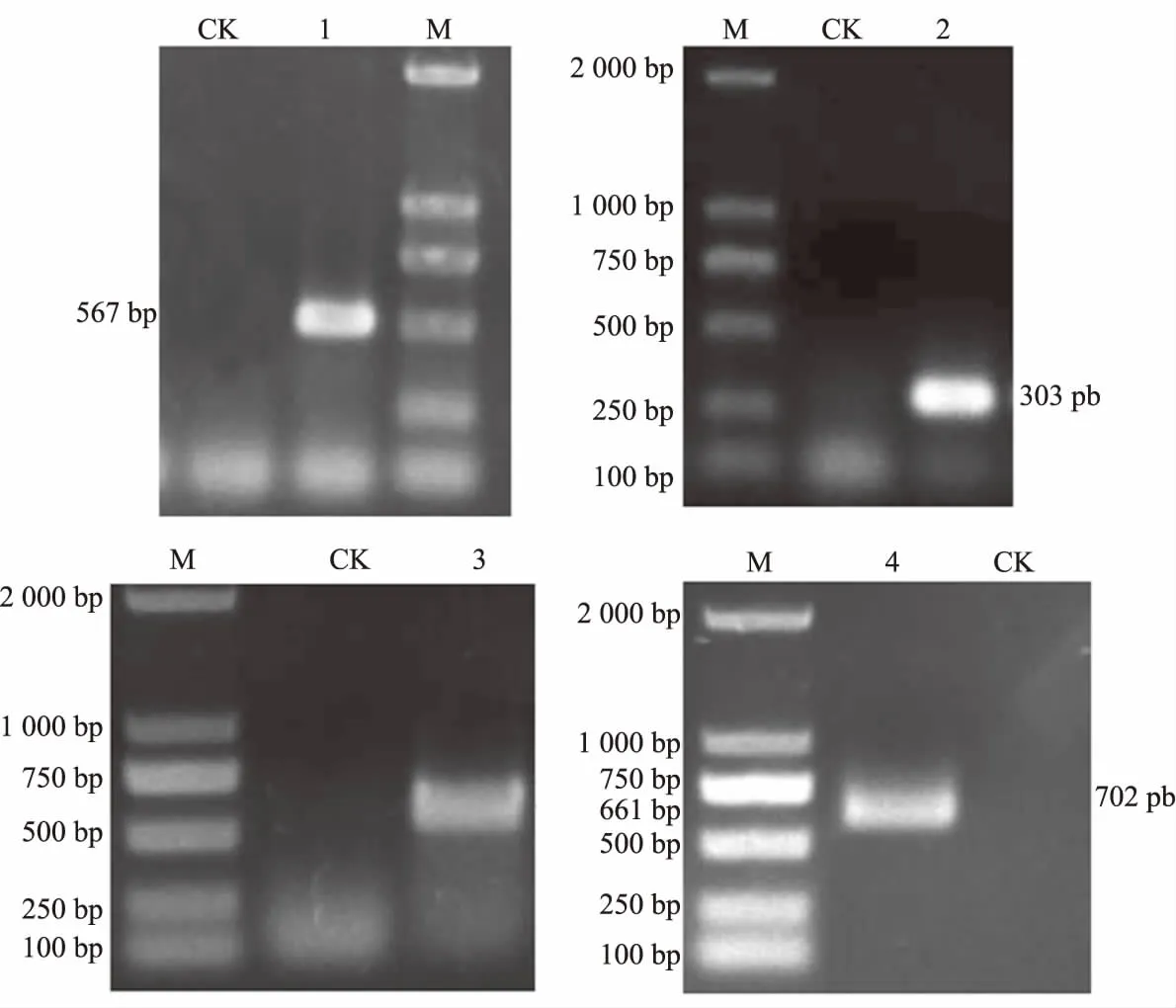
1:保守片段扩增;2:5′UTR扩增;3:3′UTR扩增;4:ORF扩增;M:Marker 2000。
1: Conserved region amplification; 2: Amplification products of 5′UTR;3: Amplification products of 3′UTR; 4: Amplification products of ORF; M: Marker 2000.
图1AG基因扩增产物
Fig.1AmplificationproductsofAGgene

ATG:起始密码子;TGA:终止密码子。
ATG: Start codon; TGA: Stop codon.
图2AG基因核苷酸序列和推测的氨基酸序列
Fig.2NucleotideacidsequenceanddeducedaminosequenceofAGgene
2.2 AG基因编码的蛋白序列分析
AG氨基酸序列属于植物特有的MIKC型C类MADS-box 基因,包含保守的MADS盒和中度保守的K盒(图3),其中MADS盒包含61个氨基酸组成的高度保守的结构域,其编码的 MADS 蛋白结构域可以结合靶DNA;中度保守的K盒包含91个氨基酸,主要调节蛋白质与蛋白质间的相互作用,是转录因子的结构特征序列。
采用ProtScale分析蛋白的亲疏水性, 结果显示,AG蛋白质序列属于亲水性蛋白,其中第183位的Ala亲水性最强(-2.989),第51位Leu的疏水性最强(2.122)。采用ExPASy网站上的GOR进行蛋白质二级结构预测,结果表明,α螺旋占48.93%,延伸链占11.59%,不规则卷曲占39.48%。将萼脊兰AG基因编码的氨基酸进行同源性分析,结果显示,与蝴蝶兰AG(AAL76415)同源性为99%,与建兰AG(ADP00515)的同源性为94%,与石斛AG(AAY86364)的同源性为87%,反映出该基因在进化上较为保守(图4)。
为了进一步研究萼脊兰AG基因与其他植物MADS-box基因的进化关系,选取15种植物的MADS-box基因编码的蛋白,利用MEGA4.0软件,构建系统进化树 (图5)。结果表明,萼脊兰AG与兰科植物小兰屿蝴蝶兰(AAL76415)MADS-box亲缘关系最近,其次是球花石斛(AAY86364)AGAMOUS,建兰(ADP00515)MADS1和文心兰杂交栽培种(AIJ29176)AG-like。

图3 萼脊兰AG蛋白保守结构域Fig.3 Sedirea japonica AG conservative protein domain structure

图4 AG编码的氨基酸序列比对Fig.4 Alignment of the predicted amino acid sequence of AG
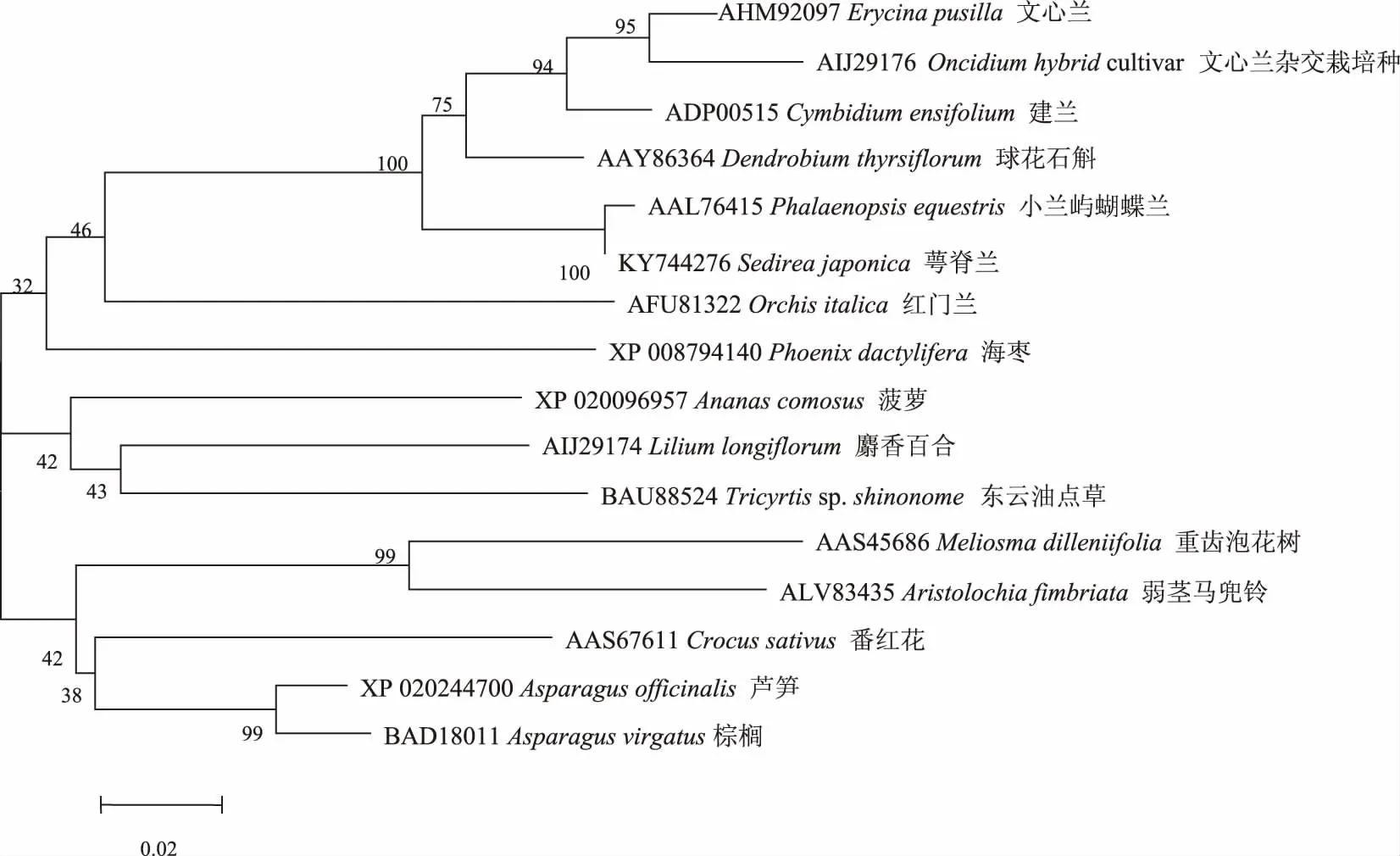
注:接点部位的值代表1 000 次重复的靴带值。
Note: Values at nodes indicate bootstrap percentages.
图5AG系统进化树
Fig.5PhylogenetictreeforAG
2.3 萼脊兰AG基因的时空表达分析
qRT-PCR分析结果显示,AG基因的表达具有组织特异性:苗期,在叶和根中AG基因表达几乎为零;花蕾期,叶和根中AG基因的表达量也几乎为零,在花葶中少有表达,在花蕾中表达量很高;盛花期,AG基因的表达有明显组织特异性,叶和根中不表达,花葶、萼片、花瓣中表达量很少,在蕊柱中却大量表达(图6),说明AG基因在ABCDE模型中属于C类基因的特征非常明显,控制着雄蕊和雌蕊的发育。
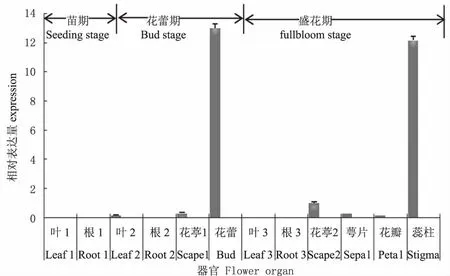
图6 AG 基因的时空表达分析Fig.6 AG expression Analysis at different period and tissue
3 结论与讨论
AG基因参与花分生组织形成并控制第 3,4 轮花器官的发育, 在生殖生长过程中对于维持花原基特征是必需的。本研究采用RT-PCR和RACE相结合的手段克隆了兰科植物萼脊兰AG基因的全长序列,并对其进行了生物信息学分析,发现AG基因全长1 002 bp,AG氨基酸序列属于植物特有的MIKC型MADS-box基因,包含典型的MADS盒、K盒,AG的氨基酸序列与蝴蝶兰(AAL76415)同源性为99%,属于亲水性蛋白, 与兰科植物蝴蝶兰MADS-box亲缘关系最近。
AG基因的时空表达分析的结果显示,AG基因的表达具有组织特异性,在花蕾和蕊柱中表达量最高,说明AG具有C类基因功能的同源异形基因,是转录调控因子, 调控雄蕊和心皮原基的发育。
陈新等[14]从平榛花芽中分离克隆获得平榛AG的同源基因ChAG,经生物信息学软件分析,AG基因编码区保守性较强,不同科植物间氨基酸水平上的同源较高,说明AG基因在榛属植物进化过程中是比较保守的。本研究发现,萼脊兰AG所编码的氨基酸序列与蝴蝶兰的同源性为99%,与建兰同源性为94%,与石斛的同源性为87%,说明萼脊兰AG基因编码区保守性较强,在兰科植物进化过程中比较保守,研究结果与陈新等[14]的研究比较一致。刘锴栋等[15]从番荔枝中分离花器官特征决定基因AGAMOUS,并研究AG基因在花发育不同时期、不同器官及不同激素信号分子处理下的表达特性,推测番荔枝AsAG可能参与雌蕊和雄蕊的发育及激素信号的响应。本研究发现AG基因的表达量主要在花蕾和蕊柱,也推测AG可能参与雌蕊和雄蕊的发育,这与刘锴栋等[15]的研究较为一致。徐雷等[16]利用病毒诱导的基因沉默技术研究了豌豆AGAMOUS同源基因(PsAG)的功能,验证了花发育早期PsAG的表达特异性,本研究利用实时荧光定量PCR技术,从另一个角度验证了AG基因的表达组织特异性,与徐雷等[16]的研究吻合。尽管如此,由于一些未知基因的存在和研究手段的限制,AG基因的功能和与其上下游基因的相互关系还不是很清楚,有些结论还仅仅是推测,没有直接的证据证明,AG基因的调控体系还没有完全阐明[17-18]。目前大多数结论建立在双子叶植物和草本植物的研究基础之上,在其他物种上AG基因同源基因的研究多数是简单地验证拟南芥AG基因的功能,新的发现很少,要更深入地了解AG基因的功能和物种之间的进化关系,需要更多的AG同源基因的数据。
[1] BECKER A, THEISSEN G. The major clades of MADS-box genes and their role in the development and evolution of flowering plants[J]. Molecular Phylogenetics & Evolution, 2003, 29(3): 464-489.
[2] ALVAREZ-BUYLLA E R, LILJEGREN S J. PELAZ S, et al. MADS-box gene evolution beyond flowers: expression in pollen, endosperm, guard cells, roots and trichomes[J].Plant Journal,2000,24(4):457-466.
[3] TSAFTARIS A S, PASENTSIS K, POLIDORO A N. Isolation of a differentially spliced C-type flower specific AG-like MADS-box gene from crocus sativus and characterization of its expression[J]. Biologia Plantarum, 2005, 49(4):499-504.
[4] KRAMER E M, JARAMILLO M A, DI S V. Patterns of gene duplication and functional evolution during the diversification of theAGAMOUSsubfamily of MADS-box genes in angiosperms[J]. Genetics, 2004, 166(2): 1011-1023.
[5] CHANG S, PURYEAR J, CAIRNEY J. A simple and efficient method for isolating RNA from pine trees[J]. Plant Molecular Biology Reporter, 1993, 11(2): 1-13.
[6] FAVARO R, PINYOPICH A, BAT TAGLIA R, et al. MADS-box protein complexes control carpel and ovule development inArabidopsis[J]. Plant Cell, 2003, 15(11) :2603-2 611.
[7] 胡月苗, 向林, 章秋爽, 等. 兰科植物花器官发育MADS-box调控基因研究进展[J]. 分子植物育种, 2016, 14(4): 886-895.
[8] 胡立霞, 徐京, 庞基良, 等. 春兰×大花蕙兰杂种AGL6同源基因的克隆及其功能研究[J]. 园艺学报, 2011 , 38(2): 317-326.
[9] MEUNIER J, KHELIFI A, NAVRATIL V, et al. Homology dependent methylation in primate repetitive DNA[J]. Proceeding of the Nation Academy of Sciences, 2005, 102(15): 5471-5476.
[10] YANFSKY M F, MA H, BOWMAN J H, et al. The protein encoded by theArabidopsishomeotic gene agamous resembles transcription factors[J]. Nature, 1990, 346(6279): 35-39.
[11] 高志红, 张玉明, 王珊, 等. 植物花发育调控基因AGAMOUS的研究进展[J]. 西北植物学报, 2008, 28( 3): 0638-0644.
[12] SHARMA B, KRAMER E M. The MADS-Box gene family of the basal eudicot and hybrid aquilegia coerulea ‘Origami’ (Ranunculaceae)1[J]. Annals of the Missouri Botanical Garden, 2008, 99(3):313-322.
[13] VEKEMANS D, PROOST S, VANNESTE K, et al. Gamma paleohexaploidy in the stem lineage of core eudicots: significance for MADS-Box gene and species diversification[J]. Molecular Biology & Evolution, 2012, 29(12):3793.
[14] 陈新, 王贵禧, 梁丽松, 等. 平榛AGAMOUS基因的克隆与生物信息学分析[J]. 生物技术通报, 2011,11(5):207-211.
[15] 刘锴栋, 黎海利, 钟舒婷, 等.番荔枝花器官发育基因AsAG的克隆亚细胞定位及表达分析[J].中国农业科学,2016,49(1):142-154.
[16] 徐雷,宋伟杰,王利琳. 豌豆AGAMOUS同源基因功能的初步研究[J]. 科学通报,2009,54(20):3207-3212.
[17] LENHARD M, BOHNERT A, JüRGENS G, et al. Termination of stem cell maintenance in floral meristems by interactions betweenWSCHELandAGAMOUS[J]. Cell, 2001,105: 805-814.
[18] PYLATUIK J D, CROSS R H, DAVIS A R, et al. Elements regulatingAGAMOUSexpression are conserved betweenArabidopsisthaliana, Brassica napus, andLinumusitatissimum[J]. Canadian Journal of Botany , 2011, 81(6): 523-530.
AnalysisofcloningandexpressionanalysisofAGAMOUSgenefromSedireajaponica
JIANG Suhua1, DENGZU Liying2, HAO Pingan3,WANG Mofei1, YUAN Xiuyun1, CUI Bo1
(1.Institute of Bioengineering, Zhengzhou Normal University, Zhengzhou 450044, China; 2.Zhengzhou Preschool Education College, Zhengzhou 450000, China; 3.College of Life Sciences, Henan Agricultural University, Zhengzhou 450000, China)
The structure, function, clone ofAGAMOUS(AG) gene as well as its expression regulation were studied in this paper.It's found that the amino acid sequence ofAGbelonged to plant type peculiar MIKC, C gene of MADS-box class. The full length cDNA ofAGwas 1 002 bp with an ORF of 702 bp encoding 233 putative amino acid residues (GenBank:KY744276). Multiple sequence alignments and phylogenetic tree analyses showed thatAGwas close to thephalaenopsisamabiliswith an overall sequence similarity. The encoded protein was hydrophilic and contained 48.93% of α-helical domains, 11.59% of extended strand, 39.48% of random coil. The highest expression of the gene analyzed by real-time fluorescent quantitative PCR was in bud and stigma. It indicated thatAGgene expression was tissue specificity, belonged to the class C gene characteristics in ABCDE model, and controlled the development of stamen and pistil.
Sedireajaponica;AGgene cloning; RACE; real-time fluorescentquantitative PCR; gene expression
2017-04-18
河南省高等学校重点科研项目(14B180036);郑州市科技发展计划项目(20150448);郑州市普通科技攻关项目(141PPTGG420)
蒋素华(1983-),女,河南漯河人,讲师,硕士,主要从事花卉分子生物学研究。
崔 波(1962-),男,河南泌阳人,教授,博士。
1000-2340(2017)06-0801-07
Q786
A
朱秀英)
