农杆菌介导小麦遗传转化方法的优化与应用
2018-01-10李国领张建周张德奇
张 磊, 李国领, 张建周, 张德奇
(1.河南省农业科学院科研管理处,河南 郑州 450002;2.河南省农业科学院小麦研究所,河南 郑州 450002)
农杆菌介导小麦遗传转化方法的优化与应用
张 磊1, 李国领2, 张建周2, 张德奇2
(1.河南省农业科学院科研管理处,河南 郑州 450002;2.河南省农业科学院小麦研究所,河南 郑州 450002)
为了优化农杆菌介导小麦遗传转化方法,以郑麦9023幼胚愈伤组织为材料,研究了60Co γ射线辐照对农杆菌介导法遗传转化的影响。结果表明,在辐照剂量为4 Gy,辐照处理后以继代培养24 h时β-葡萄糖苷酸酶(gus)基因瞬时表达率最高。负压抽拉处理结果表明,抽拉10次可明显提高农杆菌介导的遗传转化效率。转基因抗性再生植株bar基因分子标记检测结果表明,利用改良的遗传转化处理方法(4 Gy辐照+辐照后培养24 h+负压抽拉处理10次),可将遗传转化效率由2.2%提高至3.5%,优化后的小麦农杆菌转化方法可应用于小麦遗传转化。
小麦;再生体系;农杆菌;遗传转化;辐照;负压处理;GUS瞬时表达
小麦是世界范围内的主要粮食作物,建立高效、成熟的小麦遗传转化体系对于诠释小麦重要性状相关基因的功能和定向遗传改良具有重要意义。基因枪转化法和农杆菌介导法是遗传转化小麦最主要的两种方法。1992 年,VASIL等[1]将β-葡萄糖苷酸酶基因(gus)和除草剂抗性基因(bar)通过基因枪法导入小麦品种“Paron”,获得对除草剂 Basta 有抗性的再生植株,是首例基因枪转化小麦成功事件。与基因枪法相比,农杆菌介导法以可转移较大的 DNA 片段、成本低、无需复杂的原生质体培养、导入外源基因以单拷贝数居多、再生植株无育性问题等诸多优点逐渐成为植物遗传转化的有效方法[2]。1997 年CHENG等[3]首次通过根癌农杆菌介导小麦转化体系得到了世界上第一例转化成功的小麦。2003年WU等[4]又对农杆菌介导小麦遗传转化的相关因素进行了优化研究,进一步提升了小麦的遗传转化效率。此后,国内外许多学者就如何提高农杆菌介导的遗传转化效率开展了大量研究,包括强感染力菌株的选择、农杆菌活性、菌液浓度、浸染时间、共培养条件、激素与表面活性剂的选择等均不同程度地影响转化效率[5-13]。此外,在农杆菌介导其他作物遗传转化的过程中,采取辐照、负压、外植体致伤等辅助处理可提高转化频率[14-15 ],但上述手段在小麦的遗传转化中尚未见报道。作者在开展农杆菌介导结缕草遗传转化的研究中发现,辐照和负压处理可显著提升遗传转化效率[15]。因此,本文研究了辐照和负压处理对农杆菌介导的小麦遗传转化体系的影响,以期为提高小麦的遗传转化效率提供参考。
1 材料与方法
1.1 试验材料
本试验所利用的小麦品种为郑麦9023,农杆菌菌株为LBA4404, 植物表达载体T-DNA 区带有由CaMV35S启动子驱动的gus、卡那霉素抗性基因nptⅡ、草丁膦抗性基因bar。以上试验材料均由河南省农业科学院小麦研究所保存。
1.2 愈伤组织的诱导
小麦材料幼胚愈伤组织的诱导参见李艳[16]的方法,幼胚取自开花后12~14 d的穗中部籽粒,用体积分数为 70%的无水乙醇消毒30 s,无菌水冲洗3次,用质量分数为0.1%的HgCl2消毒10 min,无菌水冲洗3~4次。在超净工作台上用解剖镊剥出幼胚(约1 mm),幼胚盾片朝上接种于诱导培养基上。
愈伤诱导与分化培养基参照彭亚博等[13]和张磊等[15]的方法。
愈伤诱导培养基:MS+2 mg·L-1Picloram;根癌农杆菌YEP液体培养基:10 g·L-1牛肉浸膏+10 g·L-1酵母浸出物+5 g·L-1NaCl;农杆菌侵染培养液:1/10 MS+0.75 g·L-1MgCl2+0.02% Silwet-77+200 μmol·L-1AS+0.1 g·L-1肌醇;预培养和共培养基:1/10 MS+2 mg·L-1Picloram+0.75 g·L-1MgCl2+0.02% Silwet-77+200 μmol·L-1AS+0.1 g·L-1肌醇;恢复培养基:MS+2 mg·L-1Picloram+250 mg·L-1羧苄青霉素+0.1 g·L-1肌醇;常规再生培养基(非遗传转化试验):MS+1 mg·L-16-BA+0.5 mg·L-1IBA+0.1 g·L-1肌醇。筛选再生培养基(转基因试验):MS+1 mg·L-16-BA+0.5 mg·L-1IBA+250 mg·L-1羧苄青霉素+6 mg·L-1PPT+0.1 g·L-1肌醇。
1.3 农杆菌培养与转化
农杆菌培养与转化参见张磊等[15]的方法,将农杆菌培养至OD600值约为0.6,将诱导的愈伤组织浸泡10 min,用无菌滤纸吸去多余菌液,接种于愈伤诱导培养基上,置于25 ℃、16 h光照/ 8 h黑暗下共培养2 d。用含500 mg·L-1羧苄青霉素的无菌水洗净,转入筛选培养基,每2周继代培养1次。GUS组织化学染色参照彭亚博等[13]的方法,并利用GUS染色反应计算转化率。
1.4 辐照处理
取继代2周、大小较为一致的胚愈伤组织,于河南省科学院同位素研究所有限责任公司辐照中心按剂量率1 Gy·min-1进行如下2种方式辐照:以1、2、4、8、16 和32 Gy剂量的60Co γ射线辐照,以未辐照材料为对照,辐照后直接用于农杆菌感染转化;以4 Gy剂量的60Co γ射线处理,辐照后转移至继代培养基,分别培养0、12、24、36、48和60 h,然后进行农杆菌的感染转化。
1.5 负压处理
将愈伤组织放入含有农杆菌菌液的医用注射器,将注射器一端封闭,参照张磊等[15]的方法,分别抽拉5、10、20和40次,抽拉距离每次为5 cm,每次间隔5 s,浸泡10 min,以未抽拉材料为对照。
1.6 转基因植株分子标记检测
选择bar基因作为转基因植株的目标基因进行分子标记检测。bar基因PCR检测参照李艳[16]的方法,BP1: 5′-CCATCGTCAACCACTACATC-3′和BP2:5′-ATGCCAGTTCCCGTGCTTGA-3′,扩增程序为94 ℃, 5 min;94 ℃, 30 s;53 ℃ ,30 s;72 ℃, 30 s;35个循环;72 ℃, 10 min。目的片段长度为408 bp。
1.7 数据统计和分析
GUS表达率=(GUS表达愈伤组织块数/感染总愈伤组织块数)×100%;抗性愈伤率=(抗性愈伤组织块数/供试愈伤组织块数)×100%;再生植株bar基因阳性率=bar基因PCR分子标记检测的阳性植株数/农杆菌介导的愈伤组织数。
试验结果用SPSS16.0进行统计分析,Microsoft Excel 2003绘图。
2 结果与分析
2.1 辐照对小麦愈伤组织及其转化的影响
2.1.1 辐照对GUS瞬时表达率的影响 由图1可知,不同辐照剂量显著影响GUS瞬时表达率。在1~8 Gy的辐照量区间内,随剂量的递增GUS瞬时表达率均显著高于对照的65.3%,其中4 Gy和8 Gy辐照剂量瞬时表达率分别达到95.0%和96.5%;在16~32 Gy的辐照量区间内,GUS瞬时表达率逐渐降低。GUS组织化学染色观察也表明,在1~8 Gy范围内,GUS染色逐渐加深,高于8 Gy辐照染色逐渐变浅。
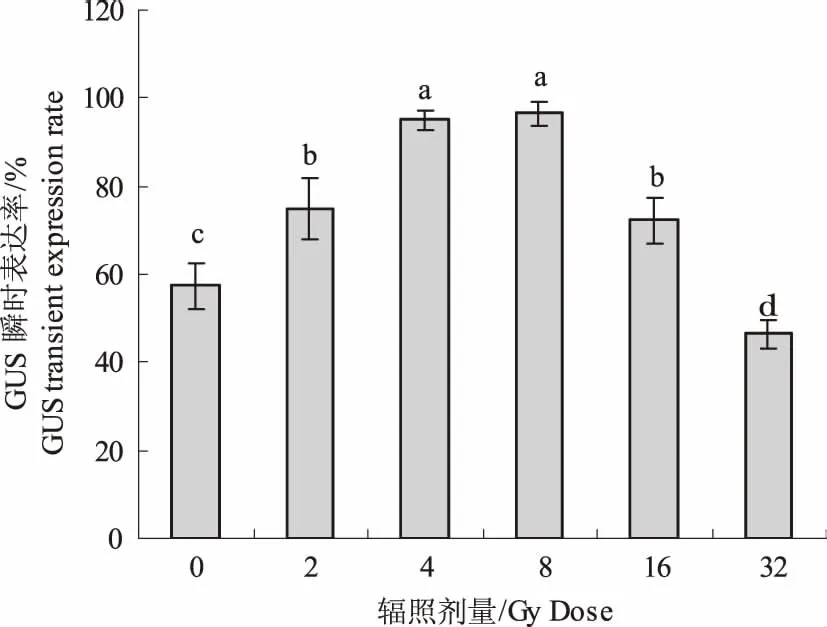
图1 不同辐照剂量对GUS瞬时表达率的影响Fig.1 The effects of gamma irradiation on GUS transient expression rate of calli
2.1.2 辐照对小麦继代2周愈伤组织存活率的影响 虽然GUS瞬时表达率和染色情况以8 Gy最为理想,但该处理的愈伤组织存活率却低于4 Gy的处理(图2)。1~4 Gy低剂量辐照,可显著促进愈伤组织的生长,高于8 Gy辐照则明显抑制愈伤组织的生长,并且褐化现象比较严重。因此,考虑到辐射可能对愈伤组织的诱变作用,选用4 Gy作为最佳的辐照剂量。
2.1.3 辐照后继代培养时间对愈伤组织转化的影响 愈伤组织进行辐照后不同继代培养时间对小麦遗传转化也有较大影响(图3)。辐照后培养24 h时,GUS瞬时表达率最高,达到96.8%,随后瞬时表达率迅速下降。因此,综合上述辐照剂量的结果,选择辐照4 Gy,辐照后继代培养24 h作为最佳的辐照及继代培养条件,可显著提高愈伤组织的转化效率。
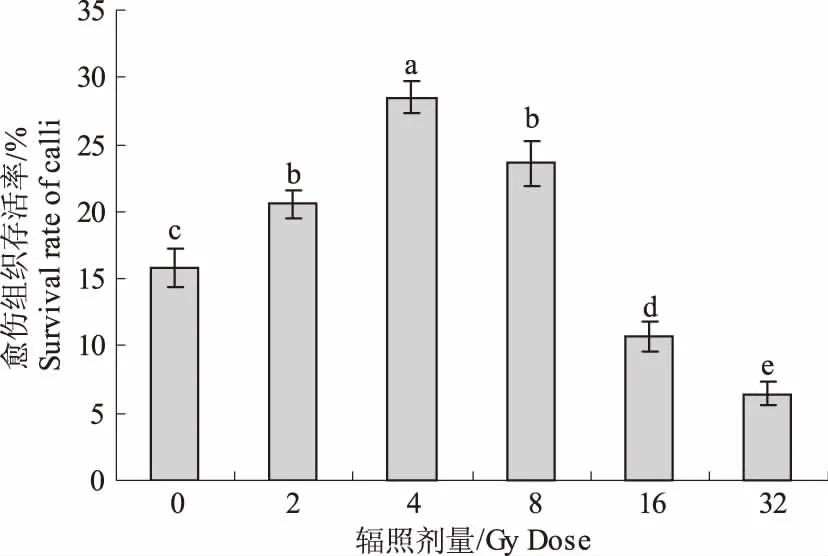
图2 不同辐照剂量对愈伤组织存活率的影响Fig.2 The effects of different gamma irradiation on survival rate of calli
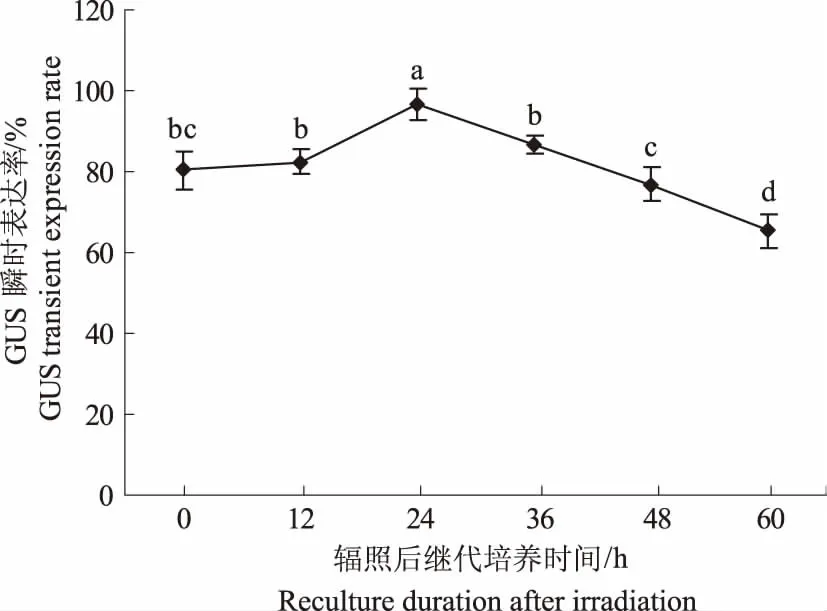
图3 辐照后继代培养时间对GUS瞬时表达率的影响
2.2 负压处理对小麦继代2周愈伤组织转化率的影响
农杆菌菌液浸泡愈伤组织过程中利用密闭的注射器分别进行了5、10、20和40次的负压抽拉处理(图4),未负压处理愈伤组织作为对照。负压抽拉次数显著影响GUS瞬时表达率。其中,抽拉10次时,GUS瞬时表达率达到86.9%,显著高于对照的67.3%。当负压抽拉处理超过20次时,GUS瞬时表达率明显降低。在农杆菌菌液侵染后的继代培养过程中也发现,负压抽拉处理为10次时,农杆菌的污染控制与常规未负压处理相当,但抽拉次数超过20次后,农杆菌的污染则较难控制,这可能是由于抽拉次数过多后农杆菌菌液深入渗透至愈伤组织内部间隙中,导致残存在愈伤组织内部的农杆菌菌液难以清理干净。因此,选择抽拉10次作为最佳的负压处理方式。

图4 负压抽拉次数对GUS瞬时表达率的影响Fig.4 The effects of pulling times on GUS transient expression rate of calli
2.3 转基因植株的获得与分子鉴定
以郑麦9023幼胚愈伤组织为试验材料,以常规遗传转化方法为对照,利用优化的转化方法(4 Gy辐照+辐照后培养24 h+负压抽拉处理10次)对愈伤组织进行了遗传转化。2种方法各侵染了1 500块幼胚愈伤组织(每次500块愈伤组织,重复3次)。抗性再生植株的bar基因PCR检测结果表明(图5),利用改良方法共获得52株阳性植株,bar基因阳性率比例达到3.5%,显著高于常规处理的33株阳性植株和2.2%的阳性率(图6)。
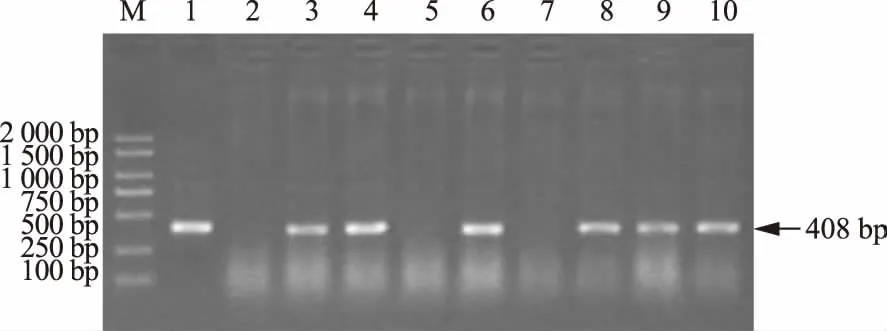
M:Marker;1:质粒对照;2:未转化对照;3~10:T0代转基因植株M: Marker; 1: Plasmid; 2: Non-transgenic plant; 3~10: Regeneration basta resistant plants图5 T0代转基因植株的bar基因PCR检测Fig.5 PCR analysis of T0 transgenic wheat plants by bar gene primers
3 结论与讨论
遗传转化的过程是农杆菌菌株与植物细胞之间互相作用的结果,凡是能够影响植物细胞转化应答能力和农杆菌侵染能力以及转化体再生能力的各种因素都会对其转化效果产生影响,而且对于不同的物种甚至同一物种不同转化材料而言都有非常大的差异。因此,优化农杆菌转化频率的主要影响因子对于获得高效的转化频率尤为重要[17]。
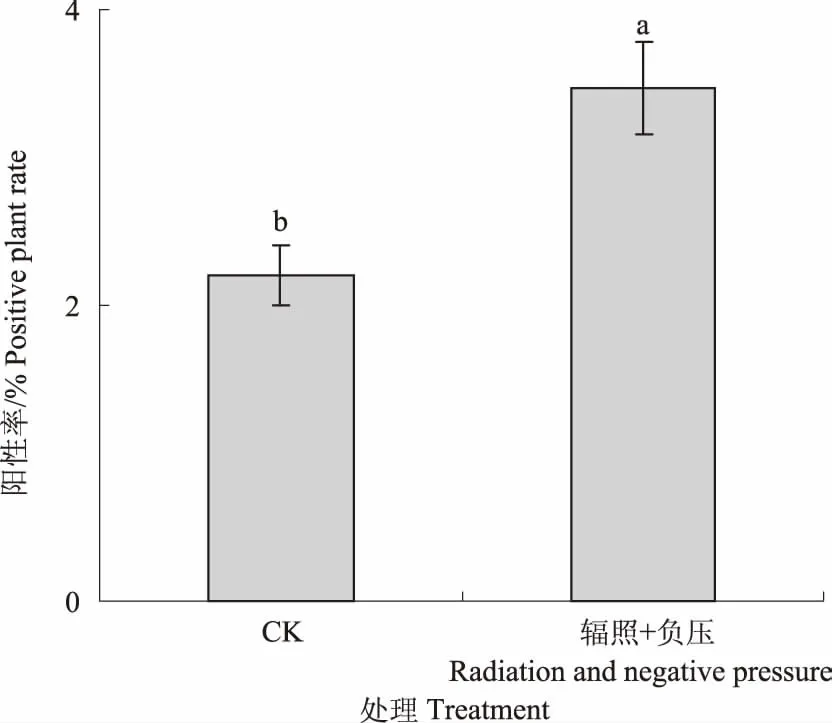
图6 改良方法与常规方法的转基因植株PCR检测阳性率Fig.6 Positive transgenic plant rate of improved and normal method
农杆菌介导的遗传转化依赖于高效的再生体系和高频转化体系。遗传转化理想的基因型应是组织培养再生性能好、综合性状优良并具有推广价值或潜在推广价值的优良品种品系。基因型是影响小麦再生体系的重要因素,不同基因型其愈伤诱导率和再生频率差异很大。前人关于小麦不同主栽品种开展过大量的组培特性研究,筛选出了一批农艺性状优良、再生体系高效的品种[18]。而农杆菌介导的遗传转化成功与否的关键性因素在于转化受体与农杆菌的互作状态[15]。以往农杆菌介导小麦遗传转化的研究中,开展了大量对农杆菌菌株、菌液活性、浓度、感染时间等方面的研究[4-13],其他物种通过机械、超声和酶解等物理和化学辅助手段导致受体细胞的损伤以提高转化频率也有一些研究[14-15]。γ射线辐射可以引起植物DNA、细胞、组织等不同水平的损伤,但低剂量的电离辐射对植物也具有正向的刺激效应,例如可以提高种子的发芽力、破除种子休眠、加强对逆境胁迫的抵御能力、刺激发育等[19-21]。在以前的研究中,低剂量辐照可以明显提高农杆菌介导的结缕草愈伤组织转化效率[15]。但与结缕草最佳剂量 2 Gy不同的是,农杆菌介导小麦的最佳剂量为4 Gy,表明不同物种之间的最佳剂量存在差异。
在农杆菌介导的遗传转化中,外植体与农杆菌共培养后,尽管经过清洗,但外植体表面及细胞间隙中仍附着部分残余农杆菌,如何在选择过程中杀死残余农杆菌对转化过程至关重要。在预备试验中,通过优化条件获得了一系列的方法来尽量消除残余农杆菌的过度繁殖问题:共培养基上铺放2~3层无菌滤纸可以有效降低农杆菌的残存,而且对转化频率基本没有影响;共培养结束后清洗农杆菌时,改手摇方式为放置于摇床上(200 r·min-1)振荡 2 h,重复2次。该方法只适用于愈伤组织结构较为致密的材料,不适于结构松散的愈伤组织。
gus基因瞬时表达系统常常被用于优化转化体系及考察启动子的表达强度,但gus基因的表达是否代表遗传转化的最终转化效率尚无定论。作者在优化小麦转化体系中观察到,GUS瞬时表达强度大的条件下往往获得抗性愈伤的比例也较高。因此,在试验过程中仍用该指标对转化条件进行评价。
综上所述,辐照和负压处理可显著提高GUS瞬时表达率和愈伤组织存活率,其中4 Gy辐照+辐照后培养24 h+负压抽拉处理10次为最佳处理方式;利用改良的遗传转化处理方法可将遗传转化效率由2.2%提高至3.5%。
[1] VASIL V, CASTILLO A M, FROMM M E, et al. Herbicide resistant fertile transgenic wheat plants obtained by microprojectile bombardment of regenerable embryogenic callus[J]. Nature Biotechnology, 1992, 10(6): 667-674.
[2] 崔波, 蒋素华, 牛苏燕, 等. 农杆菌介导蝴蝶兰的遗传转化研究[J]. 河南农业大学学报, 2012, 46(6): 642-645.
[3] CHENG M, FRY J E, PANG S, et al. Genetic transformation of wheat mediated by Agrobacterium tumefaciens[J]. Plant Physiology, 2002, 115(3): 971-980.
[4] WU H, SPARKSC, AMOAH B, et al. Factors influencing successful agrobacterium-mediated genetic transformation of wheat[J]. Plant Cell Reports, 2003, 21(7): 659-668.
[5] 刘庆法,康克轩,叶建明,等. 农杆菌介导的小麦遗传转化条件的研究[J]. 复旦学报(自然科学版), 1998, 37(4): 569-572.
[6] 叶兴国, 王艳丽, 康乐, 等. 农杆菌敏感小麦基因型的筛选及其转化[J]. 作物学报, 2005, 31(12): 1552-1556.
[7] 叶兴国, 徐惠君, 杜丽璞, 等.小麦遗传转化几个因素的研究[J]. 中国农业科学, 2001, 34(2): 128-132.
[8] VARSHNEY A, ALTPETER F. Stable transformation and tissue culture response in current European winter wheats (TriticumaestivumL.)[J]. Molecular Breeding, 2002, 8(4): 295-309.
[9] IOSET J R, URBANIAK B, NDJOKO-IOSET K, et al. Flavonoid profiling among wild type and related GM wheat varieties[J]. Plant Molecular Biology, 2007, 65(5): 645-654.
[10] 张彬, 丁在松, 张桂芳, 等. 根癌农杆菌介导获得稗草 Ecppc 转基因小麦的研究[J]. 作物学报, 2007, 33(3): 356-362.
[11] 付永彩, 吴茂森, 成卓敏, 等. 小麦不同品种外植体的农杆菌转化方法的研究[J]. 农业生物技术学报, 2002, 10 (1): 25-28.
[12] 李朝炜, 刘颖, 王丹娜, 等. 农杆菌介导小麦成熟胚遗传转化的几个影响因素研究[J].江苏农业科学, 2017, 45(12) : 45-47.
[13] 彭亚博, 田保明, 崔明珠, 等. 农杆菌介导的小麦成熟胚遗传转化影响因素分析[J].麦类作物学报, 2017, 37(4): 458-464.
[14] 刘志学, 马向前, 何艺园,等. 农杆菌介导遗传转化中辅助处理方法的改良[J]. 复旦学报(自然科学版), 1999, 38(5): 601-604.
[15] 张磊, 胡繁荣, 张琳琳, 等. 辐照对结缕草农杆菌介导法遗传转化的影响[J]. 核农学报, 2004, 18(6): 435-437.
[16] 李艳. 玉米C4途径关键酶(PEPC、PPDK)基因的克隆及PEPC基因对小麦的遗传转化[D]. 郑州:河南农业大学, 2009.
[17] 王永勤, 肖兴国, 张爱民. 农杆菌介导的小麦遗传转化几个影响因素的研究[J]. 遗传学报, 2002, 29(3): 260-265.
[18] 李鹏, 张磊, 胡琳, 等. 小麦遗传转化中优良受体基因型及 L2 PPT 适宜浓度的筛选[J]. 麦类作物学报, 2008, 28(2): 193-196.
[19] 高晓原, 曹有龙, 陈梅红.60Co γ射线辐照对麻黄离体细胞生长的影响[J]. 核农学报, 2001, 15(6): 365-367.
[20] 温之雨, 张艳敏. 冬小麦幼胚愈伤组织的辐照效果研究[J]. 河北农业科学, 1997, 1(3): 19-22.
[21] ZAPATA F J, ALDEMITA R R, TORRIZO L B, et al. Anther culture of Basmati 370 at IRRI: a gamma ray-induced green plant regeneration[J]. International Rice Research Newsletter, 1986, 4: 22-23.
Improvementandapplicationofagrobacteriummediatedgenetictransformationofwheat
ZHANG Lei1, LI Guoling2, ZHANG Jianzhou2, ZHANG Deqi2
(1.Department of Scientific Research Management, Henan Academy of Agricultural Sciences, Zhengzhou 450002, China; 2.Wheat Research Institute, Henan Academy of Agricultural Sciences, Zhengzhou 450002, China)
In order to optimize the method of wheat agrobacterium mediated genetic transformation, the embryonic calli derived from the immature embryos of a wheat cultivar “Zhengmai 9023” were used as materials, to study the effects of gamma irradiation on agrobacterium-mediated genetic transformation. The results indicated that 4 Gy is the optimal dose for agrobacterium-mediated genetic transformation of Zhengmai 9023, using GUS transient expression rates as the indicator. Based on the survival rate and GUS transient expression rate, further observation found that 24 hours reculture after gamma irradiation is the most appropriate for agrobacterium infection. Another negative pressure treatment results showed that pulling 10 times in enclosed injector was the optimal manner for transformation. Bar gene PCR assay results of positive regeneration plantlets showed that transformation efficiency was enhanced from 2.2% to 3.5% by using the improved method (4 Gy irradiation+24 h reculture+10 times negative pressure treatment) described above. The optimied agrobacterium-mediated transformation method can be used in the genetic transformation of wheat.
wheat; regeneration system; agrobacterium; genetic transformation; gamma irradiation; negative pressure treatment; GUS transient expression
2017-07-20
国家自然科学基金面上项目(31371707)
张 磊(1979-),男,安徽蒙城人,副研究员,博士,主要从事小麦遗传育种方面的研究。
1000-2340(2017)06-0781-05
S 512.1
A
李 莹)
