心房颤动患者华法林药物敏感度与CYP2C9和VKORC1基因多态性的相关性
2018-01-09李志强胡春燕
李志强 胡春燕
药物与临床
心房颤动患者华法林药物敏感度与CYP2C9和VKORC1基因多态性的相关性
李志强 胡春燕
目的 对接受华法林抗凝治疗的心房颤动(房颤)患者进行CYP2C9和VKORC1基因多态性检测,分析CYP2C9和VKORC1基因多态性与华法林起效剂量和起效时间的相关性。方法 随机选取222例持续性非瓣膜性房颤患者,根据抗凝治疗的结果进行分组。患者华法林药物敏感度根据国际标准化比值(INR)达到目标值1.8~3.0时,华法林给药累计剂量<12.5 mg为低起效剂量,≥12.5 mg为高起效剂量,据此将患者分为低起效剂量组和高起效时间组;INR达到目标值1.8~3.0时,达标时间<10 d为短起效时间,≥10 d为长起效时间,据此将患者分为短起效时间组和长起效时间组。分析CYP2C9和VKORC1基因多态性与华法林起效剂量和起效时间的相关性。结果 ①低起效剂量组患者年龄、血清肌酐(SCr)、服用β受体阻滞剂者显著高于高起效剂量组(P<0.05或0.01),体重指数(BMI)、白细胞(WBC)计数低于高起效剂量组(P<0.05);两组间CYP2C9 rs1057910基因构成差异有统计学意义(P<0.05)。②短起效时间组患者年龄、SCr、脑钠肽(BNP)显著高于长起效时间组(P<0.05或 0.01),BMI、WBC、左室射血分数(LVEF)低于长起效时间组(P<0.05或0.01);两组间VKORC1 rs9923231和rs10871454基因构成差异有统计学意义(P<0.05或0.01)。③CYP2C9 rs1057910 CA基因型华法林起效剂量显著低于AA基因型(P<0.01),VKORC1 rs9923231和rs10871454 CT基因型华法林起效时间显著短于TT基因型(P<0.05或0.01)。④根据CYP2C9和VKORC1不同基因型对华法林起效剂量和起效时间的不同影响,将华法林药物敏感度分为高度敏感、低度敏感和常规敏感预测模型。结论 CYP2C9和VKORC1基因多态性结合患者临床情况为指导临床合理使用华法林抗凝治疗提供了新的方法,也为指导调节华法林剂量提供了依据。
华法林; 药物敏感度; 基因多态性; CYP2C9; VKORC1
华法林是最常用的口服抗凝药之一[1],但华法林的治疗窗相当窄,达到抗凝治疗的剂量在不同种族和个体间差异较大,甚至可相差20倍[2,3]。随着近年来华法林药物基因组学研究的深入,发现华法林药代动力学和药效动力学通路上某些基因的变异可能是造成华法林个体间剂量差异的主要原因。代谢华法林的细胞色素氧化酶P450 2C9(CYP2C9)和作用靶点维生素K环氧化酶复合物亚单位1(VKORC1)基因多态性成为近年来研究的重点。与华法林个体反应差异相关的候选基因分为两类:一类决定药代动力学,包括编码药物代谢酶CYP2C9,另一类影响药效动力学,包括编码药物作用位点的基因VKORC1,共同可解释华法林剂量全部个体差异的10%~45%[4,5]。本研究对接受华法林抗凝治疗的房颤患者进行CYP2C9和VKORC1基因多态性检测,分析CYP2C9和VKORC1基因多态性与华法林起效剂量和起效时间的相关性。
1 对象与方法
1.1 研究对象 随机选取2015年10月至2016年12月于上海市浦东医院心内科住院的222例持续性非瓣膜性房颤患者,其中男性116例(52.3%)、女性 106 例(47.7%),年龄 44~88(74.7±8.68)岁。
1.2 纳入标准 符合中国《心房颤动:目前的认识和治疗建议-2012》持续性房颤诊断标准,神志清楚、能进行正常交流,无精神疾病、交流障碍。所有入选患者相互之间无血缘关系及异族通婚史。所有患者给予华法林抗凝治疗前均进行房颤血栓风险CHADS2-VASc评分和抗凝治疗出血风险HASBLED评分,CHADS2-VASc评分≥2分,均给予华法林抗凝治疗。
1.3 排除标准 排除未控制的严重高血压[血压≥180/110 mm Hg(1 mm Hg=0.133 kPa)]、半年内有急性冠脉事件、抗凝药物过敏、出血性体质、外伤倾向、近半年内有出血性脑血管事件史、严重肝肾功能不全和HAS-BLED≥5分者。
1.4 治疗方案
1.4.1 设定华法林抗凝治疗的国际标准化比值(INR) 目标值为1.8~3.0。华法林起始给药剂量为1.875 mg,每日1次。第3~10天重复测定INR,并根据INR值调整华法林剂量,每次增加0.625 mg,直至INR达到目标值。设定INR达到目标值1.8~3.0时华法林给药累计剂量<12.5 mg为低起效剂量,≥12.5 mg为高起效剂量;INR达到目标值1.8~3.0时达标时间<10 d为短起效时间,≥10 d为长起效时间。其他治疗包括控制血压、血糖、血脂、利尿剂使用改善心功能等。观察治疗前和治疗过程中INR值,记录华法林给药剂量、起效剂量(mg)、起效时间(d)。根据抗凝治疗的结果进行分组,将患者华法林药物敏感度按起效剂量和起效时间分为4种不同类型:高起效剂量、低起效剂量、短起效时间和长起效时间,分析CYP2C9和VKORC1基因多态性与华法林起效剂量和起效时间的相关性。
1.4.2 基因多态性检测 所有患者入选后抽取清晨空腹肘静脉血5 ml,EDTA抗凝,用全血DNA提取试剂盒(北京BioTeke生物技术有限公司)提取DNA,采用聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)分析技术进行CYP2C9和VKORC1基因多态性检测。
1.5 统计学方法 应用SPSS 20.0统计软件进行分析。正态分布的计量资料以±s表示,两组间均数的比较采用两独立样本t检验;计数资料以率和构成比表示,采用χ2检验。P<0.05为差异有统计学意义。

表1 患者CYP2C9和VKORC1基因型资料(例)
2 结果
2.1 患者的CYP2C9和VKORC1基因型资料 患者CYP2C9和VKORC1基因型资料见表1。
2.2 低起效剂量组和高起效剂量组患者的基线资料 低起效剂量组患者年龄、SCr、服用β受体阻滞剂者显著高于高起效剂量组(P<0.05或0.01),BMI、WBC低于高起效剂量组(P<0.05);两组间CYP2C9 rs1057910基因构成差异有统计学意义(P<0.05)。见表2。
2.3 短起效时间组和长起效时间组患者的基线资料 短起效时间组患者年龄、SCr、BNP显著高于长起效时间组(P<0.05 或 0.01),BMI、WBC、LVEF 低于长起效时间组(P<0.05或0.01);两组间VKORC1 rs9923231和rs10871454基因构成差异有统计学意义(P<0.05或 0.01)。见表3。
2.4 CYP2C9和VKORC1不同基因型华法林起效剂量和起效时间比较 CYP2C9 rs1057910 CA基因型华法林起效剂量显著低于AA基因型(P<0.01),VKORC1 rs9923231 和 rs10871454 CT 基因型华法林起效时间显著短于TT基因型(P<0.05或0.01),见表4、5。
2.5 CYP2C9和VKORC1基因多态性与华法林药物敏感度预测模型 根据CYP2C9和VKORC1不同基因型对华法林起效剂量和起效时间的不同影响,将华法林药物敏感度分为高度敏感、低度敏感和常规敏感预测模型,见表6。
表4 CYP2C9 rs1057910不同基因型华法林起效剂量的比较(±s)

表4 CYP2C9 rs1057910不同基因型华法林起效剂量的比较(±s)
注:与 AA 比较,aP<0.01
基因rs1057910 AA CA例数177 45华法林起效剂量(mg)10.21±2.05 9.22±2.27a
表5 VKORC1不同基因型华法林起效时间的比较(±s)

表5 VKORC1不同基因型华法林起效时间的比较(±s)
注:与 TT 比较,aP<0.01,bP<0.05
基因 例数 华法林起效时间(d)rs9923231 TT 134 10.64±2.35 CT 88 9.23±2.33a rs10871454 TT 129 10.35±2.28 CT 93 9.71±2.49b

表6 CYP2C9和VKORC1基因多态性与药物敏感性预测模型
3 讨论
CYP2C9是细胞色素氧化酶P450超家族中第二亚家族的一个重要成员,位于染色体10q24[6]。CYP2C9基因具有高度的多态性,其多态性主要取决于编码区的单核苷酸多态性(SNPs)[7]。CYP2C9基因突变类型及其突变频率在不同种族间存在明显差异。在中国人群中,除了野生型CYP2C9*1,CYP2C9*3(rs1057910 A>C)是最主要的也是目前研究最广泛的等位基因突变体,其基因频率为1%~4%,CYP2C9*3(CYP2C9*1/*3 和 CYP2C9*3/*3)携带者比CYP2C9*1/*1携带者华法林平均每日剂量减少26%[8]。其中6个SNP位点可能与华法林药代动力学相关,分别为rs12572351 G>A,rs9332146 G>A,rs4917639 G >T,rs1057910 A>C,rs1934967 G>T,rs1934968 G>A[9]。
表2 低起效剂量组和高起效剂量组患者的基线资料(±s,例)
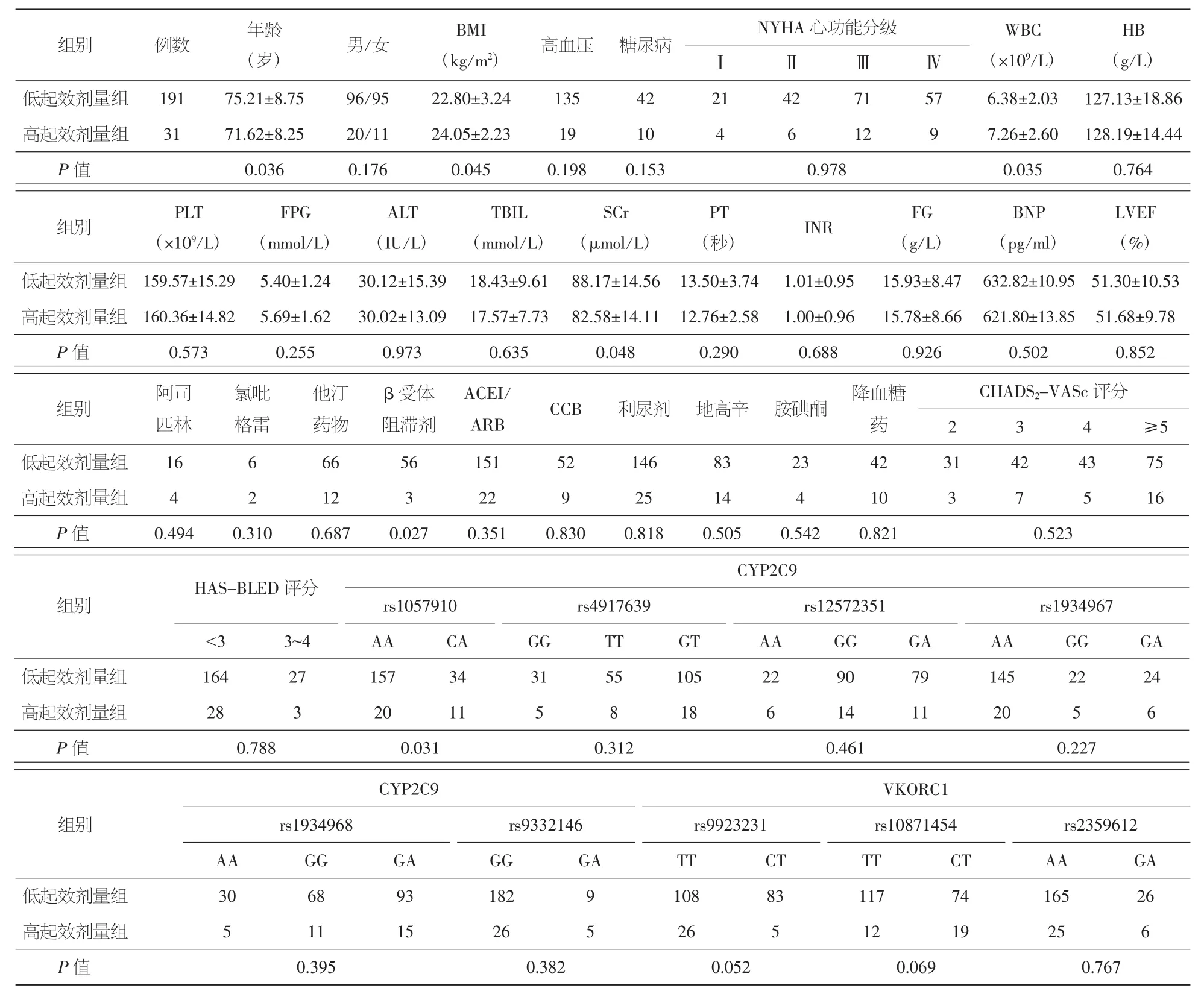
表2 低起效剂量组和高起效剂量组患者的基线资料(±s,例)
注:BMI:体重指数;NYHA:纽约心脏病学会;WBC:白细胞计数;HB:血红蛋白;PLT:血小板计数;FPG:空腹血糖;ALT:丙氨酸转氨酶;TBIL:总胆红素;SCr:血清肌酐;PT:凝血酶原时间;FG:纤维蛋白原;BNP:脑钠肽;LVEF:左室射血分数;ACEI:血管紧张素转换酶抑制剂;ARB:血管紧张素Ⅱ受体拮抗剂;CCB:钙离子拮抗剂
低起效剂量组 191 75.21±8.75 96/95 22.80±3.24 135 42 21 42 71 57 6.38±2.03 127.13±18.86高起效剂量组 31 71.62±8.25 20/11 24.05±2.23 19 10 4 6 12 9 7.26±2.60 128.19±14.44 BNP(pg/ml)组别 PLT(×109/L)FPG(mmol/L)ALT(IU/L)TBIL(mmol/L)SCr(μmol/L) (秒) INR FG(g/L)LVEF(%)低起效剂量组 159.57±15.29 5.40±1.24 30.12±15.39 18.43±9.61 88.17±14.56 13.50±3.74 1.01±0.95 15.93±8.47 632.82±10.95 51.30±10.53高起效剂量组 160.36±14.82 5.69±1.62 30.02±13.09 17.57±7.73 82.58±14.11 12.76±2.58 1.00±0.96 15.78±8.66 621.80±13.85 51.68±9.78 PT低起效剂量组 16 6 66 56 151 52 146 83 23 42 31 42 43 75高起效剂量组 4 2 12 3 22 9 25 14 4 10 3 7 5 16低起效剂量组164271573431551052290791452224高起效剂量组 28 3 20 11 5 8 18 6 14 11 20 5 6低起效剂量组 30 68 93 182 9 108 83 117 74 165 26高起效剂量组 5 11 15 26 5 26 5 12 19 25 6
VKORC1是维生素K环氧化物还原酶复合体的第一个亚基,位于16号染色体短臂(16P11.2),编码含163个氨基酸的18 kDa内质网跨膜蛋白[6]。V KORC1是维生素K依赖性凝血因子生成的限速酶,不但主导维生素K依赖性凝血因子的生成,而且是华法林等香豆素类抗凝药物的作用靶点[10]。在VKORC1编码区和非编码区存在大量的多态性位点,其中对华法林剂量有影响的单核苷酸多态性位点主要有启动子区1639位置G>A(rs9923231),第一个内含子1173位置C>T(rs9934438)。中国汉族人VKORC1-1173TC和CC携带者比TT携带者华法林平均每日剂量高49%和98%,VKORC1-1173C携带者(TC或CC)比TT携带者华法林平均每日剂量高56%[8]。与VKORC1-1639AA携带者相比,VKORC1-1639GA和GG携带者华法林平均每日剂量高40%和101%,VKORC1-1639G携带者(GA或GG)华法林平均每日剂量增加38%[8]。文献报道,3个SNP位点可能与华法林的作用靶点相关,分别为rs9923231 C>T、rs2359612 G>A 和 rs10871454 C>T[9]。
本研究发现,低起效剂量组和高起效剂量组患者CYP2C9 rs1057910基因构成存在显著差异,短起效时间组和长起效时间组间VKORC1 rs9923231和rs10871454基因构成存在显著差异。CYP2C9 rs1057910 CA基因型华法林起效剂量显著低于AA基因型,VKORC1 rs9923231和rs10871454 CT基因型华法林起效时间显著短于TT基因型。根据CYP2C9和VKORC1不同基因型对华法林起效剂量和起效时间的不同影响,将华法林药物敏感度分为高度敏感、低度敏感和常规敏感预测模型。
本研究的局限性是入选患者局限于上海浦东南片地区人群,样本量较小,缺乏多种族人群样本,并且需要进一步开展根据CYP2C9和VKORC1基因多态性指导华法林给药的前瞻性研究,为华法林个体化给药提供重要依据。总之,CYP2C9和VKORC1基因多态性检测结合患者临床情况为指导临床合理使用华法林抗凝提供了新的方法,以基因类型指导调节华法林剂量提供了依据,有助于提高华法林的临床应用和抗凝达标率,对华法林抗凝治疗的管理有较大的实用性。
表3 短起效时间组和长起效时间组患者的基线资料(±s,例)

表3 短起效时间组和长起效时间组患者的基线资料(±s,例)
注:BMI:体重指数;NYHA:纽约心脏病学会;WBC:白细胞计数;HB:血红蛋白;PLT:血小板计数;FPG:空腹血糖;ALT:丙氨酸转氨酶;TBIL:总胆红素;SCr:血清肌酐;PT:凝血酶原时间;FG:纤维蛋白原;BNP:脑钠肽;LVEF:左室射血分数;ACEI:血管紧张素转换酶抑制剂;ARB:血管紧张素Ⅱ受体拮抗剂;CCB:钙离子拮抗剂
?
[1]“华法林钠抗凝治疗的中国专家共识”正式发布.中国心血管病研究,2012,10:820.
[2]Nahar R,Deb R,Saxena R,et al.Variability in CYP2C9 allele frequency:a pilot study of its predicted impact on warfarin response among healthy South and North Indians.Pharmacol Rep,2013,65:187-194.
[3]Mega JL,Giugliano RP.Genotype-guided dosing of warfarin.Clin Chem,2014,60:920-922.
[4]Johnson JA,Cavallari LH.Warfarin pharmacogenetics.Trends Cardiovasc Med,2015,25:33-41.
[5]Jorgensen AL, FitzGerald RJ,Oyee J,et al.Influence of CYP2C9 and VKORC1 on patient response to warfarin:a systematic review and meta-analysis.PLoS One,2012,7:e44064.
[6]Fung E,Patsopoulos NA,Belknap SM,et al.Effect of genetic variants,especially CYP2C9 and VKORC1,on the pharmacology of warfarin.Semin Thromb Hemost,2012,38:893-904.
[7]Zhou SF,Zhou ZW,Huang M.Polymorphisms of human cytochrome P450 2C9 and the functional relevance.Toxicology,2010,278:165-188.
[8]Zhang J,Chen Z,Chen C.Impact of CYP2C9,VKORC1 and CYP4F2 genetic polymorphisms on maintenance warfarin dosage in Han-Chinese patients:A systematic review and meta-analysis.Meta Gene,2016,9:197-209.
[9]刘媛,钟诗龙,谭虹虹,等.CYP2C9与VKORC1基因变异对华法林初始抗凝治疗反应性的影响.中华心血管病杂志,2011,39:929-935.
[10]Yuan HY, Chen JJ, Lee MT, et al.A novel functional VKORC1 promoter polymorphism is associated with interindividual and inter-ethnic differences in warfarin sensitivity.Hum MolGenet,2005,14:1745-1751.
The correlation of the Warfarin drug sensitivity with CYP2C9 and VKORC1 genetic polymorphism in patients with atrial fibrillation
LI Zhi-qiang,HU Chun-yan.Department of Cardiology,Shanghai Pudong Hospital,Fudan University Pudong Medical Center,Shanghai 201399,China
HU Chun-yan,E-mail:18918790181@189.cn
ObjectiveTo detect the CYP2C9 and VKORC1 genetic polymorphism in patients with atrial fibrillation which accepted anticoagulant therapy with Warfarin,analyze the correlations of the CYP2C9 and VKORC1 genetic polymorphism with the effective dose and onset time of Warfarin.Methods222 patients with permanent non-valvular atrial fibrillation were recruited randomly and divided into different groups according to the results of anticoagulant therapy.About the Warfarin drug sensitivity of patient,we defined the low effective dose when accumulated dose of Warfarin less than 12.5 milligrams if international normalized ratio(INR)reached the target value 1.8-3.0,the high effective dose was accumulated dose of Warfarin more than or equal to 12.5 milligrams.According to this,the patients were divided into low effective dose group and high effective dose group.The shot onset time was the onset time of Warfarin less than 10 days if INR reached the target value 1.8-3.0,the long onset time was the onset time more than or equal to 10 days.According to this,the patients were divided into shot onset time group and long onset time group.The correlations of the CYP2C9 and VKORC1 genetic polymorphism with the effective dose and onset time of Warfarin were analyzed.Results⑴The age,serum creatinine(SCr) and the proportion of patients taking beta blockers in low effective dose group were significantly higher than those in high effective dose group(P<0.05 or 0.01);the body mass index (BMI),white blood cell(WBC)count significantly lower than high effective dose group(P<0.05);the genetic makeup of CYP2C9 rs1057910 in the two groups was significantly different(P<0.05).⑵The age,SCr and brain natriuretic peptide(BNP)of patients in shot onset time group were significantly higher than those in long onset time group(P<0.05 or 0.01);the BMI,WBC and left ventricular ejection fraction(LVEF)significantly lower than long onset time group(P<0.05 or 0.01);the genetic makeup of VKORC1 rs9923231 and rs10871454 in the two groups were significantly different(P<0.05 or 0.01).⑶The effective dose of Warfarin in patients with CYP2C9 rs1057910 CA genotype was significantly lower than that with CYP2C9 rs1057910 AA genotype(P<0.01),the onset time of Warfarin in patients with VKORC1 rs9923231 and rs10871454 CT genotype were significantly lower than those with VKORC1 rs9923231 and rs10871454 TT genotype(P<0.05 or 0.01).⑷Based on the influence of CYP2C9 and VKORC1 different genotype on Warfarin effective dose and onset time,we defined Warfarin drug sensitivity as highly sensitivity,low sensitivity and routine sensitivity prediction model.ConclusionCombination CYP2C9 and VKORC1 genetic polymorphism with the clinical setting of patients provided a new method for guiding Warfarin anticoagulant therapy rationally in clinic and provided guidance evidence for using genotype to adjust Warfarin dose.
Warfarin; Drug sensitivity; Genetic polymorphism; CYP2C9; VKORC1
上海市卫生和计划生育委员会科研项目(项目编号:201440058);浦东新区卫生和计划生育委员会领先人才培养项目(项目编号:PWRL2014-03)
201399 上海市,上海市浦东医院心内科,复旦大学附属浦东医院心内科
胡春燕,E-mail:18918790181@189.cn
10.3969/j.issn.1672-5301.2017.12.020
R541.7
A
1672-5301(2017)12-1126-06
2017-08-06)
