不同剂量X线照射对大鼠卵巢功能的影响
2018-01-06王雪芹张永峰刘淑华张淑娴徐爱霞
王雪芹,张永峰,刘淑华,张淑娴,徐爱霞
(潍坊医学院附属医院,山东潍坊261031)
不同剂量X线照射对大鼠卵巢功能的影响
王雪芹,张永峰,刘淑华,张淑娴,徐爱霞
(潍坊医学院附属医院,山东潍坊261031)
目的探讨不同剂量X线照射对大鼠卵巢功能的影响。方法将60只Wistar大鼠随机分为对照组、G0.1组、G1.0组、G10.0组,分别采用0、0.1、1.0、10.0 Gy X线外照射,于照射后1 h、5 d(1个动情周期)、10 d(2个动情周期),分别应用免疫组化SABC法、免疫放射法检测不同剂量X线照射不同时间后Wistar大鼠在不同动物周期中卵巢颗粒细胞Bcl-2蛋白的表达水平及生殖激素雌二醇(E2)、卵泡刺激素(FSH)、黄体生成素(LH)的水平;并比较各组上述指标。结果X线照射后1 h,各组各级卵泡数目及各激素水平比较,P均>0.05。X线照射后5 d,与对照组比较, G0.1组各级卵泡数目升高,血清FSH降低、LH及E2升高;G1.0、G10.0组各级卵泡数目减少,血清FSH升高、LH及E2降低(P均<0.05);X线照射后10 d,G10.0组各级卵泡数目减少,血清FSH升高、LH及E2降低(P均<0.05)。与其余组比较,G10.0组X线照射5、10 d各级卵泡数目减少,血清FSH升高,LH及E2降低(P均<0.05)。与同组内照射后1 h比较,照射后5 d,G0.1组各级卵泡数目升高,血清FSH降低、LH及E2升高(P均<0.05),照射后10 d,均恢复至正常水平;G1.0组照射后5 d各级卵泡数目降低,血清FSH升高、LH及E2降低(P均<0.05),照射后10 d恢复至正常水平; G10.0组照射后5 、10 d各级卵泡数目均降低,血清FSH升高、LH及E2降低(P均<0.05)。与照射后1 h比较,G0.1组照射后5 d Bcl-2阳性表达率升高,G1.0组照射后5 d 降低,G10.0组照射后5、10 d均降低(P均<0.05)。结论低剂量X线照射可一定程度抑制细胞凋亡,避免卵巢损伤;当照射剂量超过一定值(≥1.0 Gy),卵巢功能受损,但损伤是可逆的;当给予超大剂量(10.0 Gy)照射后,卵巢功能严重损伤,甚至出现不可逆性早衰。
卵巢功能;X线电离辐射;X线辐射剂量;卵泡;细胞凋亡;生殖激素;大鼠
X线在医疗领域为人类健康发挥越来越重要作用,但其伴随的电离辐射对机体的危害不容忽视。不孕不育症的常规检查方法——子宫输卵管造影(HSG)中的X 线电离辐射对卵巢的损伤引起医疗专家关注。2014年6月~2016年6月,本实验通过观察HSG中不同X线照射剂量照射大鼠后其生殖激素变化及颗粒细胞凋亡抑制基因Bcl-2的表达,以探讨不同X线辐射剂量对卵巢功能的影响,以期为保护卵巢、优生优育提供更多实验依据。
1 材料与方法
1.1 材料 实验动物:SPF级Wistar大鼠60只,2~3周龄,体质量(100±6.8)g,由山东鲁抗医药有限公司实验动物中心提供,合格证号SCXR鲁20130001,在温度(23±2)℃、相对湿度40%~70%环境下分笼饲养。笼具、垫料、饮用水和饲料均按试验要求标准方法准备,大鼠自主饮食。试剂与药物:促性素孕马血清由杭州动物药品厂提供;100 g/L水合氯醛由潍坊市人民医院提供;Bcl-2试剂盒及PV-9000通用型kit购自北京中山生物科技公司。西门子数字化平板机购自德国西门子公司。
1.2 分组及处理 将60只Wistar大鼠随机分为4组,每组为15只,给予不同照射量X线,管电压72 V,靶皮距100 mm,管电流为20 mAs。对照组不接受X线照射,放置检查室时间基本等同于G0.1组的照射时间; G0.1组接受放射线照射剂量为0.1 Gy; G1.0组接受X线照射剂量为1.0 Gy;G10.0组接受X线照射剂量为10.0 Gy。分别于照射后1 h、5 d(1个动情周期)、10 d(2个动情周期)后,随机选取5只大鼠,给予水合氯醛0.7~1.0 mL进行腹腔注射麻醉,碘伏消毒,通过心包穿刺取血,离心、分离血清,-20 ℃保存。分别于照射后1 h,5、10 d,用4%戊巴比妥钠0.7~1.5 mL行腹腔注射麻醉,卵巢按横轴方向在最大径处纵向剖开,皮肤清洁消毒后取双侧卵巢,去除周围脂肪,生理盐水冲洗。组织放入甲醛中固定,常规脱水,石蜡包埋。所有石蜡组织块行4 μm连续切片,载玻片经APES处理。
1.3 卵泡数目的观察 从切片中随机取出1张做HE染色,显微镜下观察卵泡,在(40×10)光镜下对各级卵泡进行计数,观察始基卵泡、初级卵泡、次级卵泡、窦状卵泡的数目变化。
1.4 细胞Bcl-2蛋白表达的检测 采用免疫组化SABC法。切片脱蜡后用PBS进行水化,然后进行抗原修复并加入一抗,用PBS冲洗,加入二抗培养后用SABC法进行染色,光镜下根据各细胞特点,区分出颗粒细胞,观察颗粒细胞中Bcl-2蛋白表达情况。按细胞有无显色或显色深浅计分:无显色计0分,浅黄色计1分,棕黄色计2分,黄褐色计3分;按显色细胞比例计分:显色细胞<1%计0分,1%~10%计1分,11%~50%计2分,51%~100%计3分。根据阳性细胞染色深浅和阳性细胞占颗粒细胞总数的百分数进行计分,以两者计分的乘积作为最终判断标准:0为阴性;1~4为弱阳性;6为阳性;9为强阳性;≥6为高表达,<6为低表达或不表达。
1.5 大鼠血清雌二醇(E2)、卵泡刺激素(FSH)、黄体生成素(LH)水平的检测 采用免疫放射法。按照放射免疫分析检测试剂盒说明书步骤检测血清E2、FSH、LH水平。
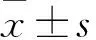
2 结果
2.1 各组不同时间卵巢卵泡数目比较 X线照射后1 h,各组各级卵泡数目比较,P均>0.05。X线照射后5 d,与对照组比较,G0.1组各级卵泡数目升高,G1.0、G10.0组各级卵泡数目减少(P均<0.05);X线照射后10 d,G10.0组各级卵泡数目减少(P均<0.05)。与其余组比较,G10.0组X线照射5、10 d各级卵泡数目减少(P均<0.05)。与同组内照射后1 h比较,照射后5 d,G0.1组各级卵泡数目升高(P均<0.05),照射后10 d降低至正常水平;G1.0组照射后5 d各级卵泡数目降低(P均<0.05),照射后10 d升高至正常水平;G10.0组照射后5 、10 d各级卵泡数目均降低(P均<0.05)。见表1。

表1 各组不同时间各级卵泡数目比较 (个
2.2 各组不同时间颗粒细胞Bcl-2表达比较 照射后1 h、5 d、10 d,对照组颗粒细胞Bcl-2阳性表达率分别为60.0%、80.0%、60.0%,不同时间比较差异无统计学意义(P>0.05);G0.1组颗粒细胞Bcl-2阳性表达率分别为60.0%、100.0%、66.7%,与照射后1 h比较,照射后5 d阳性表达率升高(P<0.05),10 d差异无统计学意义(P>0.05);G1.0组颗粒细胞Bcl-2阳性表达率分别为60.0%、30.0%、53.3%,照射后5 d Bcl-2阳性表达率降低(P<0.05),10 d差异无统计学意义(P>0.05);G10.0组颗粒细胞Bcl-2阳性表达率分别为60.0%、10.0%、10.0%,照射后5、10 d Bcl-2阳性表达率均降低(P均<0.05)。
2.3 各组不同时间血清FSH、LH、E2水平比较 X线照射后1 h,各组血清E2、FSH、LH水平比较,P均>0.05。照射后5 d,与对照组比较,G0.1组血清FSH降低,LH及E2升高;G1.0 组及G10.0组血清FSH升高,LH及E2降低(P均<0.05);X线照射后10 d,G10.0组血清FSH升高,LH及E2降低(P均<0.05)。与其余组比较,G10.0组X线照射5、10 d,血清FSH升高,LH及E2降低(P均<0.05)。与同组内照射后1 h比较,G0.1组照射后5 d FSH降低,LH及E2升高(P均<0.05),照射后10 d,恢复至正常水平;G1.0组照射后5 d FSH升高,LH及E2降低(P均<0.05),照射后10 d恢复至正常水平;G10.0组照射后5、10 d FSH升高,LH及E2降低(P均<0.05)。见表2。
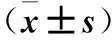
表2 各组不同时间血清FSH、LH、E2水平比较
3 讨论
目前研究证明,卵巢中的卵泡细胞、颗粒细胞对X线照射尤其敏感[1],卵原细胞通过增殖和分化形成初级卵母细胞,初级卵母细胞经过减数第一次分裂形成次级卵母细胞,次级卵母细胞减数第二次分裂形成卵细胞,该过程中若受到一定量电离辐射,卵巢中卵泡数目将减少,同时颗粒细胞也会发生凋亡,更促使卵泡闭锁,影响卵巢分泌功能,导致卵巢不同程度可逆或不可逆损伤,严重影响优生优育[2,3]。本研究结果显示,极低剂量X线照射(本实验为0.10 Gy)不仅不会对卵巢产生危害,反而会一过性刺激卵巢及机体产生应激,Bcl-2表达一过性增强,生殖激素也产生类似的正应激,抑制细胞凋亡,保护卵巢免受危害。该结果提示极低剂量X线辐射可能会促使机体发生应激性反应,对卵巢不会产生损害,我们后续研究会针对该结果进行进一步实验验证。
Bcl-2基因是目前研究较广泛的一种抑制细胞凋亡的基因。Bcl-2蛋白是细胞凋亡的敏感性指标,它可以抑制由多种细胞毒因素所引起的细胞死亡,Bcl-2的过度表达能增强所观察细胞对大多数细胞毒素的抵抗性,在走向凋亡的细胞中低表达或不表达[4~6]。本研究结果是超过一定剂量X线照射后,卵泡颗粒细胞Bcl-2表达降低,细胞凋亡增加,与目前大多数研究结果相符。大量凋亡颗粒细胞中Bcl-2呈低表达或不表达,Bcl-2基因对于卵泡细胞、颗粒细胞凋亡具有很重要的调控作用。本研究发现,X线照射剂量为0.1 Gy时卵巢颗粒细胞Bcl-2蛋白表达水平应激性升高,一定程度上抑制颗粒细胞凋亡;照射剂量为1.0 Gy,颗粒细胞Bcl-2蛋白表达水平降低,从而可使颗粒细胞周期性调解停滞,颗粒细胞发育停滞,卵巢出现早衰。
卵巢的产卵及分泌功能受大脑皮质、下丘脑、垂体及内部调节因素的共同影响,卵泡的发育调控与生殖激素相互影响协同调节[7],如雌激素、孕激素、FSH、LH等。一方面,卵泡在FSH和雌激素的共同参与下逐步发育成熟,雌激素渐入高峰,达峰值后对垂体产生正反馈,使垂体分泌大量的FSH和LH,促使排卵。另一方面,LH可刺激卵泡壁中内膜细胞分泌大量的睾酮,睾酮通过基底膜到达颗粒细胞,作为合成E2的主要前体物质,通过FSH与颗粒细胞受体结合共同将雄激素转化为E2[8],促进卵泡正常发育。本研究结果提示,经过1.0 Gy X线照射后卵巢中颗粒细胞凋亡增加,FSH与颗粒细胞上的FSH受体无法结合从而不能将雄激素转化为E2,体内E2水平下降;另外,不能正反馈作用于下丘脑,使LH水平降低,进一步使卵母细胞成熟抑制素水平升高,从而影响卵母细胞正常发育,最终导致排卵功能下降,甚至导致卵巢产生不可逆性损害[9]。
通过连续分析不同生理周期各观察指标的变化,本研究发现,X线照射后1 h,各组中卵巢Bcl-2蛋白表达及激素水平差异均无统计学意义;说明电离辐射对机体危害产生需要一个变化过程,机体损害无法即时表达。这与Suzuki等[10]研究相一致。低剂量X线辐射(本研究为≤0.1 Gy)第1个动物周期Bcl-2蛋白表达先上调后恢复;FSH短暂降低,LH及E2一过性升高,说明低剂量X线辐射对卵巢未产生明显损伤,反而会刺激卵巢颗粒细胞凋亡抑制基因Bcl-2蛋白表达增强,从而一定程度抑制细胞凋亡,避免卵巢损伤,与以往研究结果不同,可能与自身适应或保护有关。当照射剂量超过一定值(本研究为≥1.0 Gy),电离辐射使Bcl-2蛋白表达降低,颗粒细胞凋亡增加;FSH 升高,E2及LH降低。这种损伤在第1个动物生理周期损伤达高峰,第2生理周期所致损伤明显恢复,说明该照射剂量下会使卵巢卵泡及颗粒细胞凋亡增加,卵巢功能受损,但损伤是可逆的;当给予超大剂量(本研究为10.0 Gy)照射后,Bcl-2蛋白表达明显降低,FSH升高显著,且在第2个动物周期变化无明显恢复,说明卵巢产生严重损伤,甚至发生不可逆性早衰。因此,育龄期妇女在做HCG或其他放射线检查时,降低照射剂量、做好防护措施,对保护卵巢、优生优育至关重要。
总结国内外相关研究,个人认为目前有以下几个问题有待解决[2~5]:①人类HSG中常规剂量X 线照射对卵巢细胞及卵巢功能是否有影响;②不产生卵巢损伤的最大X线剂量为多少,低剂量X线照射产生抑制卵巢凋亡的原理;③是否具有遗传效应,产生遗传效应的最少剂量为多少; ④目前研究多数属于动物实验,如何进行动物-人之间的照射剂量的合理转换;⑤X线照射后卵巢组织及分泌功能改变、病理组织检查及卵泡发育相关基因综合分析判断卵巢损伤情况。以上问题我们将在后续研究中不断跟进,进行大标本动物实验,延长观察周期及时间点,进行更深入的相关研究。
[1] Jang H, Hong K, Choi Y. Melatonin and fertoprotective adjuvants: prevention against premature ovarian failure during chemotherapy[J]. Int J Mol Sci, 2017,18(6):1221.
[2] Aktas C, Kanter M, Kocak Z. Antiapoptotic and proliferative activity of curcumin on ovarian follicles in mice exposed to whole body ionizing radiation[J]. Toxicol Ind Health, 2012,28(9):852-863.
[3] Teng PN, Bateman NW, Darcy KM, et al. Pharmacologic inhibition of ATR and ATM offers clinically important distinctions to enhancing platinum or radiation response in ovarian, endometrial, and cervical cancer cells[J]. Gynecol Oncol, 2015,136 (3):554-561.
[4] Yang YB, Wang S, Li S, et al. Effects of compound Daqiqi decoction combined cisplatin on Bcl-2/Bax expression of nude mice ovarian cancer subcutaneous transplanted tumor[J]. Zhongguo Zhong Yao Za Zhi, 2015,40 (8):1575-1579.
[5] 孙佳星,蔡爱露.低频超声联合载顺铂超声微泡造影剂对卵巢癌细胞增殖和凋亡的影响[J].山东医药,2017,57(8):44-46.
[6] Vaithiyanathan K, Liew SH, Zerafa N, et al. BCL2-modifying factor promotes germ cell loss during murine oogenesis[J]. Reproduction, 2016,151(5):553-562.
[7] Togrul C, Balsak D, Ekinci C, et al. Effects of potentilla fulgens as a prophylactic agent for ischemia/reperfusion injury in the rat ovary[J]. Anal Quant Cytopathol Histpathol, 2015, 37(5):310-316.
[8] Sánchez F, Romero S, Albuz FK, et al. In vitro follicle growth under non-attachment conditions and decreased FSH levels reduces Lhcgr expression in cumulus cells and promotes oocyte developmental competence[J]. J Assist Reprod Genet, 2012,29(2):141-152.
[9] Rinaldi VD, Hsieh K, Munroe R, et al. Pharmacological inhibition of the DNA damage checkpoint prevents radiation-induced oocyte death[J]. Genetics, 2017,206(4):1823-1828.
[10] Suzuki K, Kodama S, Watanabe M. Role of Ku80-dependent end-joining in delayed genomic instability in mammalian cells surviving ionizing radiation[J]. Mutat Res, 2010,683(1-2):29-34.
EffectsofdifferentX-raydosesontheovarianfunctionofrats
WANGXueqin,ZHANGYongfeng,LIUShuhua,ZHANGShuxian,XUAixia
(TheAffiliatedHospitalofWeifangMedicalUniversity,Weifang261031,China)
ObjectiveTo observe the effects of different X-ray doses on the ovarian function of rats.MethodsSixty Wistar rats were randomly divided into four groups : the control group, G0.1 group, G1.0 group and G10.0 group, with different X-ray doses (0, 0.1, 1.0, and 10.0 Gy). At 1 h, 5 d (an estrous cycle), 10 d (two estrous cycles) after exposure, the expression levels of the Bcl-2 protein, the E2, FSH, and LH in the ovarian granulosa cells of Wistar rats in different animal cycles after different X-ray doses were observed by immunohistochemistry and immunoradiometry, and then we compared the above indicators.ResultsAt 1 h after X-ray radiation, no significant difference was found in the number of follicles and the level of each hormone between groups (allP>0.05). At 5 d after X-ray radiation, the number of follicles increased, the serum FSH decreased and the levels of LH and E2increased in the G0.1 group as compared with those of the control group; the number of follicles decreased, the serum FSH increased and the levels of LH and E2decreased in the G1.0 and G10.0 groups (allP<0.05). At 10 d after X-ray radiation, the number of follicles at all levels decreased, serum FSH increased, and LH and E2decreased in the G10.0 group (allP<0.05). Compared with the other groups, the number of follicles decreased, FSH increased, and LH and E2decreased in the G10.0 group at 5 and 10 d after X-ray radiation (allP<0.05). At 5 d after X-ray radiation, the number of follicles increased, the serum FSH decreased, and LH and E2increased in the G0.1 group as compared with that at 1 h (allP<0.05), and they all returned to the normal levels at 10 d (P<0.05); at 5 d after X-ray radiation, the number of follicles decreased, the serum FSH increased, and LH and E2decreased in the G1.0 group as compared with that at 1 h (allP<0.05), and they all returned to the normal levels at 10 d (P<0.05); at 5 and 10 d after X-ray radiation, the number of follicles decreased, the serum FSH increased, and LH and E2decreased in the G10.0 group (allP<0.05). The positive rate of Bcl-2 in the G0.1 group increased at 5 d after X-ray radiation, decreased in the G1.0 group at 5 d after X-ray radiation, and decreased in the G10.0 group at 5 and 10 d after X-ray radiation (allP<0.05).ConclusionsLow-dose X-ray radiation can inhibit the apoptosis to a certain extent, and avoid the ovarian injury. When the radiation dose exceeds a certain value (greater than 1.0 Gy), the ovarian function is impaired, but the damage is reversible.When the oversize dose (10.0 Gy) is given, the ovarian function is severely damaged, even with irreversible premature aging.
ovarian function; ionizing radiation; follicles; apoptosis; reproductive hormone; rat
10.3969/j.issn.1002-266X.2017.45.007
R271
A
1002-266X(2017)45-0024-04
山东省医药卫生科技发展基金项目(2013WS0294);潍坊市科技局软科学基金项目(2012RKX006)。
王雪芹(1976-),女,副主任医师,主要研究方向为肿瘤及生殖影像诊断。 E-mail:xuE20050415@163.com
张永峰(1975-),男,副主任医师,主要研究方向为新生儿疾病及儿童神经系统疾病。E-mail:zy20050415@163.com
2017-08-16)
